Sel Pada Aki (Universitas Negeri Surabaya)
- 1. Oleh : Muhamad Ghadafi (113234019) JURUSAN KIMIA FAKULTAS MIPA UNIVERSITAS NEGERI SURABAYA SEL PADA AKI BAIK DIGUNAKAN PADA
- 3. Dua Jenis Elemen DC ’ü▒Dikenal dua jenis elemen yang merupakan sumber arus searah (DC) dari proses kimiawi, yaitu elemen primer dan elemen sekunder ’ü▒Elemen primer terdiri dan elemen basah dan elemen kering ’ü▒Reaksi kimia pada elemen primer yang menyebabkan elektron mengalir dari elektroda negatif (katoda) ke elektroda positif (anoda) tidak dapat dibalik arahnya ’ü▒Maka jika muatannya habis, maka elemen primer tidak dapat dimuati kembali dan memerlukan penggantian bahan pereaksinya (elemen kering). Sehingga dilihat dari sisi ekonomis elemen primer dapat dikatakan cukup boros. Contoh elemen primer adalah batu baterai (dry cells).
- 4. Contoh Yang Terpampang Nyata Dalam Elemen Sekunder adalah AKI
- 5. Akumulator (Aki) ’ü▒Akumulator (accu, aki) adalah sebuah alat yang dapat menyimpan energi (umumnya energi listrik) dalam bentuk energi kimia ’ü▒Contoh-contoh akumulator adalah baterai dan kapasitor ’ü▒Pada umumnya di Indonesia, kata akumulator (sebagai aki atau accu) hanya dimengerti sebagai "baterai" mobil. Sedangkan di bahasa Inggris, kata akumulator dapat mengacu kepada baterai, kapasitor, kompulsator, dll ’ü▒Akumulator (aki):Akumulator termasuk ke dalam jenis sel sekunder, artinya sel ini dapat dimuati ulang ketika muatannya habis. Ini karena reaksi kimia dalam sel dapat dibalikkan arahnya ’ü▒Jadi sewaktu sel dimuati, energi listrik diubah menjadi energi kimia, dan sewaktu sel bekerja, energi kimia diubah menjadi energi listrik.
- 6. Jenis-Jenis Aki Yang Ada Dimuka Bumi ’ü▒ aki basah konvensional. lebih familiar dengan sebutan aki basah ’ü▒ aki hybrid ’ü▒ aki kalsium ’ü▒ aki bebas perawatan/maintenance free (MF) / aki kering ’ü▒ aki sealed
- 7. AKI KERING ’ü▒Nama lainnya MF battery (Maintenance Free Battery) dan dikenal juga dengan Valve Regulated Lead Acid Battery (VRLA) ’ü▒Yang akan kita bahas adalah jenis aki MF. Aki jenis ini dikemas dalam desain khusus yang mampu menekan tingkat penguapan air aki ’ü▒Uap aki yang terbentuk akan mengalami kondensasi sehingga dan kembali menjadi air murni yang menjaga level air aki selalu pada kondisi ideal ’ü▒Aki jenis ini biasanya terbuat dari basis jenis aki hybrid maupun aki kalsium yaitu selnya menggunakan materi kalsium
- 10. ’ü▒Allesandro Volta, seorang ilmuwan fisika mengetahui, gaya gerak listrik (ggl) dapat dibangkitkan dua logam yang berbeda dan dipisahkan larutan elektrolit. Volta mendapatkan pasangan logam tembaga (Cu) dan seng (Zn) dapat membangkitkan ggl yang lebih besar dibandingkan pasangan logam lainnya (kelak disebut elemen Volta) ’ü▒Hal ini menjadi prinsip dasar bagi pembuatan dan penggunaan elemen sekunder. Elemen sekunder harus diberi muatan terlebih dahulu sebelum digunakan, yaitu dengan cara mengalirkan arus listrik melaluinya (secara umum dikenal dengan istilah 'disetrum') ’ü▒Jadi beda antara elemen primer dan elemen sekunder adalah elemen sekunder dapat dimuati kembali berulang kali.
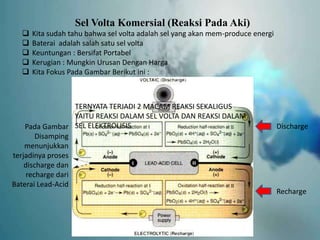
- 11. Sel Volta Komersial (Reaksi Pada Aki) ’ü▒ Kita sudah tahu bahwa sel volta adalah sel yang akan mem-produce energi ’ü▒ Baterai adalah salah satu sel volta ’ü▒ Keuntungan : Bersifat Portabel ’ü▒ Kerugian : Mungkin Urusan Dengan Harga ’ü▒ Kita Fokus Pada Gambar Berikut ini : Pada Gambar Disamping menunjukkan terjadinya proses discharge dan recharge dari Baterai Lead-Acid Discharge Recharge TERNYATA TERJADI 2 MACAM REAKSI SEKALIGUS YAITU REAKSI DALAM SEL VOLTA DAN REAKSI DALAM SEL ELEKTROLISIS
- 12. LEAD STORAGE BATTERY (LSB) (Reaksi Pada Aki Beserta Perhitungan (E Cell) ’ü▒ Tipikal dari LSB adalah mempunyai 6 cell dan paling banyak digunakan adalah 12V ’ü▒ Masing-masing sel mengandung 2 lead ,yaitu : ’ü▒ Pada Anoda = Pb ’ü▒ Pada Katoda = PbO2 ’ü▒ Kedua sistem tersebut dicelupkan dalam larutan H2SO4 ’ü▒ Ketika sel discharge terjadi reaksi seperti berikut : Half reactions: E┬░Cell = 2.0 V Anode: Pb(s)+SO4 2- ’ü¦ PbSO4 (s) +2 e- E┬░ = 0.356 Cathode (Hg): PbO2(s)+SO4 2- +4H++ 2e- ’ü¦PbSO4 (s)+ 2 H2O E┬░ = 1.685V Net: PbO2 (s) + Pb(s) + 2H2SO4 ’ü¦ PbSO4 (s) + 2 H2O E┬░Cell = 2.0 V