Hidrokarbon revisi
- 1. by: Indiatiningsih, SPd SMA NEGERI 8 MALANG Jalan Veteran 37 Malang
- 2. Standar kompetensi Kompetensi Dasar Indikator Memahami sifat-sifat senyawa organik atas dasar gugus fungsi dan senyawa makro molekul. Menggolongkan senyawa hidrokarbon berdasarkan strukturnya dan hubungannnya denagn sifat senyawa. ïķ Mengelompokkan senyawa hidrokarbon berdasarkan kejenuhan ikatan. ïķ Memeberi nama senyawa alkana, alkena, dan alkuna. ïķ Menyimpulkan hubungan titik didih senyawa hidrokarbon dengan massa molekul relatifnya dan strukturnya. ïķ Menentukan isomer struktur (kerangka, posisi, fungsi) atau isomer geometri (cis, trans)
- 3. KEKHASAN ATOM âĒ Karbon yang memiliki no atom 6 memiliki konfigurasi elektron: 2,4 âĒ Dapat dilihat bahwa atom karbon memiliki 4 elektron valensi âĒ Untuk mencapai kestabilan karbon atom karbon dapat membentuk 4 ikatan kovalen
- 4. Alkana AlkunaAlkena Memiliki satu ikatan ganda tiga C C JENUH Senyawa karbon Tidak jenuh Tidak jenuh Memiliki satu ikatan rangkap C C Memiliki satu ikatan tunggal C C
- 5. KOMPOSISI HIDROKARBON âĒ Hidrokarbon merupakan senyawa kimia yang terbentuk dari unsur C (karbon) dan unsur H(hidrogen) âĒ Senyawa hidrokarbon dapat mempunyai ikatan tunggal,rangkap dan rangkap tiga âĒ Contoh ikatan tunggal:metana âĒ Contoh ikatan rangkap:etana âĒ Contoh ikatan rangkap 3:etuna CH CH
- 6. KEGUNAAN KARBON Apa ya kegunaan hidrokarbon ??? Senyawa hidrokarbon antara lain terdapat didalam: âš Bensin tas dan peralatan plastik âš Solar âš lilin âš LPG Semua senyawa senyawa hidrokarbon mengandung unsur C dan H
- 7. Lilin (parafin) adalah salah satu senyawa hidrokarbon yang wujud padat pada suhu kamar. Senyawaan ini mengandung >20 atom C dan titik didihnya >350°C
- 8. Sebagai bahan bakar Tabung gas LPG berisi campuran propana (C3H8) dan butana (C4H10) yang merupakan bahan bakar pengganti minyak tanah
- 9. Polietilena (CH2)n merupakan senyawa yang banyak digunakan untuk tas plastik dan peralatan plastik
- 11. SENYAWA HIDROKARBON TERDIRI DARI: âĒ ALKANA ALKUNA ALKENA
- 14. A. Bila rantai karbon tidak bercabang: âĨ Tata nama Menurut Sistem IUPAC âĨ ïNama alkana ditentukan oleh jumlah atom C-nya CH3-CH3 = etana CH3-CH2-CH2-CH3 = n-butana Contoh: {Jika jumlah atom CâĨ4 diberi awalan n- (normal)}
- 15. Jumlah atom C Rumus molekul struktur Nama Alkana 1 2 3 4 5 6 7 8 9 10 CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 CH4 CH3-CH3 CH3-CH2-CH3 CH3-CH2-CH2-CH3 CH3-CH2-CH2-CH2-CH3 CH3-CH2-CH2-CH2-CH2-CH3 CH3-CH2-CH2-CH2-CH2 -CH2-CH3 CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3 metana etana propana butana pentana heksana heptana oktana nonana dekana Tabel Nama Alkana Perhatikan!!! Semua nama alkana berakhiran âanaâ
- 16. âĒ B>Nama alkana bercabang terdiri dari 2 bagian âĒ bagianI:bagian depan nama cabang âĒ Bagian II:bagian belakang nama rantai induk âĒ Contoh: âĒ CH3-CH2-CH-CH3 CH3 induk cabang 2-metilbutana
- 17. CH3 âĒ C) Rantai induk adalah rantai terpanjang dalam molekul âĒ Contoh: CH3 CH3-CH2-CH2-CH2-CH3 CH2 -CH3 etil metil d) Rantai induk diberi nama alkana yang bergantung pada panjang rantai e) Cabang diberi nama alkil,yaitu alkana yang kehilangan 1 H dan nama nya diberi akhiran-il f) Posisi cabang dinyatakan dengan awalan angka,untuk itu rantai induk perlu diberi nomer,penomeran dimulai dari salah satu ujung rantai induk sehingga penomeran dimulai yang terdekat dengan rantai cabang Contoh: CH3-CH2-CH2-CH2-CH2-CH3 6 5 4 3 2 1
- 18. Alkana (R-H) Gugus Alkil (R) Nama Alkil Tabel Nama Gugus Alkil CH3 CH3 CH3 CH3 CH3 CH3-CH2-CH2-CH2-H (butana) CH3-CH2-CH2-CH2- CH3-CH2-CH2-H (propana) CH3-CH2-CH2- metil etil propil isopropil butil Sek-butil (sekunder butil) isobutil Ters-butil (tersierbutil) CH3-H (metana) CH3-CH2-H (etana) CH3- CH3-CH2- CH3-CH2-CH- CH3-CH- CH3-CH-CH2- CH3-C-
- 19. Nama Alkan Rmus Molekul Mr TItik Leleh (C) Titik Didih (C) metana etana propana butana pentana heksana heptana oktana nonana dekana CH4 C2H6 C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 C9H20 C10H22 16 30 44 58 72 86 100 114 128 142 182 -183 -188 -138 -130 -95 -91 -57 -54 -30 -162 -89 -42 -0.5 36 69 99 126 151 174 Perhatikan tabel titik didih dan titik leleh beberapa senyawa alkana berikut!!
- 20. Apa yang dapat disimpulkan dari tabel tersebut Semakin besar Mr suatu alkana gaya antar molekul semakin kuat sehingga titik didih dan titik leleh semakin besar
- 21. Rumus molekul Rumus Struktur Titik Leleh ( C) Titik didih ( C) Apakah alkana dengan Mr Sama Selalu memiliki TTd dan TTl yang sama? C4H10 isobutana -145 -138 -11.7 -0.5 N-butana CH3 CH3 - CH - CH3 CH3 CH2 CH2 CH3 Pada alkana yang memiliki Mr yang sama, senyawa dengan rantai cabang memiliki TTd dan TTl yang lebih rendah karena alkana rantai bercabang tersusun lebih rapat sehingga interaksi antar molekulnya lemah
- 22. Reaksi: CH4(g) + O2(g) CO2(g)+ H2O(g) Reaksi OKsidasi Pembakaran metana Pembakaran alkana (metana) adalah reaksi oksidasi antara alkana dengan oksigen
- 23. + + 6 molekul CH4 bereaksi dengan 5 molekul O2 membentuk 2 molekul CO2 dan 4 molekul H2O menyisakan 4 molekul CH4 dan 1 molekul O2
- 24. Reaksi halogenasi alkana Produk Pengelupas cat (CH2Cl2) Reaksi substitusi Reaksi: CH4+ Cl2 CH3Cl + HCl Dalam reaksi halogenasi alkana satu/lebih atom H alkana diganti dengan atom halogen substitusi
- 25. + + 5 molekul CH4 habis bereaksi dengan 5 molekul Cl2 membentuk 5molekul CH3Cl dan 5 molekul HCl 5 CH4 +5 Cl2 5 CH3Cl + 5 HCl
- 26. Ujilah Kemampuan Kalian !!! 1. Tulis nama IUPAC dari senyawa-senyawa berikut !! a) CH3-CH2-C-CH2-CH3 CH3 CH3 b) CH3-CH2-CH-CH2-CH2-CH3 CH3 CH2 CH3 c) CH-CH2-C- CH3 CH3 CH3 C3H7 CH3 =3,3-dimetilpentana = 3-etil-2-metilheksana = 2,4,4-trimetilheptana 2. Susunlah keenam alkana berikut sesuai dengan kenaikan titik didihnya! a. 2-metilheksana d. 3,3-dimetilpentana b. 2-metilpentana e. Heksana c. Heptana Jawab: d,b,a,e,c 3. Tulis persamaan reaksi brominasi propana Jawab: C3H8 + Br2 CH2CH2CH3 + HBr Br
- 28. Nama Alkena Rumus Struktur Rumus Molekul etana Propena 1-butena C2H4 C3H6 C4H8 Amati beberapa contoh berikut CnH2n
- 29. âĨ Tata nama menurut Sistem IUPACâĨ 1) Tentukan rantai induk. Contoh: Langkah-langkah: Rantai induk= pentena Rantai induk= pentena a. b . 2) Memberi nomor pada rantai induk a. b . âšpenomoran dimulai dari ujung C yang paling dekat dengan ikatan rangkap C C âš rantai induk= rantai terpanjang dan Mengandung ikatan rangkap C C CH3 CH2 CH2 C CH2 CH3 CH2 CH3 CH3 CH CH2C CH2 CH3 3 3CH3 CH2 CH2 C CH2 CH3 CH2 Contoh: 5 4 3 2 1 3 2 1 5 4
- 30. âš Nama induk berasal dari alkana di mana akhiran âanaâ diganti âenaâ. 3) Beri nama pada rantai induk dan rantai cabang Contoh: âš Gugus alkil diberi nama sesuai jumlah atom C dalam cabang. (penulisan mengikuti aturan pada alkana) a. b . c. Rantai induk=1-pentena gugus alkil= 2-etil â2-etil-1-pentenaâ Rantai induk=1-pentena gugus alkil= 2-metil,4-metil â2,4-dimetil-1-pentenaâ Rantai induk=1,4-heksadiena gugus alkil= 2-etil, 5-metil â2-etil-5-metil-1,4-heksadienaâ âš Jika jumlah ikatan rangkap >1 akhiran ânaâ dari alkan diganti dengan âdienaâ, âtrienaâ dan seterusnya. âš penamaan rantai induk dimulai dari atom C yang pertama terikat pada ikatan rangkap C C, diikuti tanda (,) kemudian nama dari induk. 5 4 3 2 1 3 2 1 5 4 CH3 CH3 CH2 CH2 C CH2 CH3 CH3 CH2 CH2 C CH2 CH3 CH2 CH3 CH CH CH2 C CH2 CH2 CH3CH3 6 5 4 3 2 1
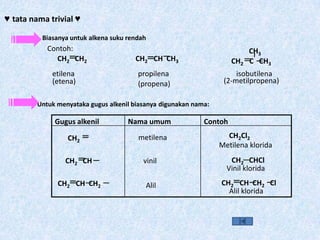
- 31. âĨ tata nama trivial âĨ Biasanya untuk alkena suku rendah CH2 CH2 CH2 CH CH3 CH3 CH2 C CH3 etilena (etena) (propena) (2-metilpropena) propilena isobutilena Untuk menyataka gugus alkenil biasanya digunakan nama: CH2 CH CH2 CH2Cl2 CH2 CH CH2 CH CH2 Cl CH2 CH2 CHCl ContohNama umumGugus alkenil metilena Alil klorida Alil Vinil klorida vinil Metilena klorida Contoh:
- 32. Nama Alkena Rmus Molekul Mr TItik Leleh (C) Titik Didih (C) Etena Propena 1-Butena 1-Pentena 1-Heksena 1-Heptena 1-Oktena 1-Nonena 1-Dekena C2H4 C3H6 C4H8 C5H10 C6H12 C7H14 C8H16 C9H18 C10H20 28 42 56 70 84 98 112 126 140 -169 -185 -185 -165 -140 -120 -102 -81,3 -66,3 -104 -48 -6,2 30 63 94 122 147 171 Amati tabel dibawah ini ??? Semakin besar Mr suatu alkena gaya antar molekul semakin kuat sehingga titik didih dan titik leleh semakin besar Conclution
- 33. Reaksi halogenasi alkena Polivinil klorida Adisi alkena oleh halogen Reaksi: CH 2 CH2 + + Cl2 CH2C l CH2Cl Pada reaksi halogenasi alkena terjadi pemutusan ikatan rangkap reaksi adisi
- 34. + 6 molekul C2H4 bereaksi dengan 5 molekul Cl2 membentuk 4 molekul C2H4Cl2 serta menyisakan 2 molekul C2H4 dan 1 molekul Cl2
- 35. + + n
- 36. Ujilah Kemampuan Kalian !!! 1. Diantara pasanagan senyawa berikut senyawa manakah yang memiliki titik didih lebih tinggi: a. butena dan isobutilena b. 2-etil-2,3-dimetilheksena dan 2,3-dimetil-2-oktena Jawab: a. butena memiliki titik didih lebih tinggi daripada isobutilena b. 2,3-dimetil-2-oktena memiliki titik didih lebih tinggi dari pada 2-etil-2,3-dimetilheksena 2.Periksalah , apakah nama-nama alkena di bawah ini telah sesuai dengan aturan penamaan IUPAC? Jelaskan a. 2-metil-1-butena = b. 4- metil-3-etil-2-pentena = c. 2,3,4-trimetil-1-heksena = 3. Tulis persamaan pembakaran propena !
- 38. Simaklah beberapa senyawa berikut!! C4H6 C2H2 C3H4Propuna Etuna Nama Alkena Rumus Struktur Rumus Molekul 1-Butuna CnH2n-2
- 39. âš rantai induk= rantai terpanjang yang mengandung ikatan ganda tiga C C âš Penomoran dimulai dari ujung C yamg paling dekat dengan ikatan ganda tiga C C Langkah-langkah 1) Tentukan rantai induk. 2) Beri nomor pada rantai induk Contoh: a. b. Contoh: Rantai induk= heptuna Rantai induk= heksuna a. b . 1 2 3 4 1 2 3 4 5 6CH3 C C CH CH3 CH2 CH2 CH3 CH3 CH3 CH3 C C C CH CH2 4 6 7 CH3 C C CH CH3 CH2 CH2 CH3 CH3 CH3 CH3 C C C CH CH2
- 40. 3) Beri nama rantai induk dan rantai cabang âšNama induk berasal dari alkana di mana akhiran âanaâ diganti âunaâ. âš Jika jumlah ikatan rangkap >1 akhiran ânaâ dari alkan diganti dengan âdiunaâ, âtriunaâdan seterusnya âšpenamaan dimulai dari atom C yang pertama terikat pada ikatan ganda tigaC C, diikuti tanda (,) kemudian nama dari induk. a. b. Contoh: âš Cabang / gugus alkil diberi nama sesuai jumlah atom C dalam cabang. (penulisan mengikuti aturan pada alkana) Rantai induk=2-heptuna gugus alkil= 4-metil â4-metil-2-heptunaâ Rantai induk=3-heksuna gugus alkil= 2,2-dimetil â2,2-dimetil-3-heksunaâ Rantai induk=1-pentuna gugus alkil= 3-etil dan 4-metil- â3-etil-4-metil-1-pentunaâ 1 2 3 4 4 6 7 1 2 3 4 5 6 CH3 CH3 CH3 C C C CH2 CH3 CH3 C C CH CH3 CH2 CH2 CH3 5 4 3 2 1 c. CH3 CH CH C CH CH3 CH2 CH3
- 41. Nama Alkana Rmus Molekul Mr TItik Leleh (C) Titik Didih (C) Etuna Propuna 1-Butuna 1-Pentuna 1-Heksuna 1-Heptuna 1-Oktuna 1-Nonuna 1-Dekuna C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 C8H14 C9H16 C10H18 26 40 54 68 82 96 110 124 1138 -81 -103 -126 -90 -132 -81 -79 -50 -44 -85 -23 8 40 71 99.7 126 151 174 Semakin besar Mr suatu alkuna gaya antar molekul semakin kuat sehingga titik didih dan titik leleh semakin besar Conclution Amatilah tabel di bawah ini !
- 42. Reaksi halogenasi alkuna Pembuatan 1,1,2,2 dikloroetan a Reaksi halogena si (adisi) âĒ Pada reaksi halogenasi alkuna terjadi penggantian ikatan rangkap oleh atom Cl Reaksi Adisi âĒ halogenasi alkuna terjadi melalui 2 tahap sehingga berlangsung lebih lambat dari alkena Tahap 1: + Cl2 Tahap2: + Cl2 CH CH CHCl2 CHCl2CHCl CHCl CHCl CHCl
- 43. + + Etuna direaksikan dengan klor berlebih sehingga reaksi berlangsung dua tahap dan dihasilkan tetrakloroetana
- 44. Ujilah Kemampuan Kalian !!! Jawab: a) akan diperoleh 1 mol 1,,2-dibromoetana b) akan diperoleh 2 mol 1,1,2,2-tetrakloropropana 2. Produk apakah yang akan diperoleh jika: a) 1 mol etuna direaksikan dengan 1 mol air brom b) 2 mol propuna direaksikan dengan 4 mol klorin? Jawab: a) 2,5-dimetil-3-heksuna b) 2,2,5trimetil -3-heptuna 1. berikan nama IUPAC pada senyawa berikut ini! a) (CH3)2 CH C C CH CH3 = b) (CH3)3C C C CH CH3 = 3. Susunlah ketiga alkuna berikut sesuai dengan penurunan titik didihnya! a) 1-butuna b) 2-metilpropuna c) 2-pentuna Jawab: c,a,b
- 45. No Rumus Molekul Rumus Struktur 1 C4H10 2 C5H10 3 C4H8 Pelajari beberapa contoh senyawa pada tabel berikut !! C H C H H HCC H H H H C C H H H C H H H H C H H H C C H H H C H H H H C HH H C C H H3C H CH3 C C H H3C CH3 H C C C H H H H H C H H C H H H n-butana (TTd=-0,5°C) 2-metilpropana (TTd=-11,7°C) 1-pentena (TTd=30°C) 2-pentena (TTd=3,72°C) Cis-2-butena (TTd=3,7°C) Trans-2-butena (TTd=0,8°C)
- 46. Apa yang dapat disimpulkan dari contoh tersebut??? Ternyata dari satu rumus molekul dapat diperoleh lebih dari satu rumus struktur. Suatu fenomena dimana terdapat dua senyawa atau lebih yang memiliki rumus kimia yang sama, tetapi rumus struktur atau konfigurasi atomnya berbeda disebut keisomeran atau isomerisme. Senyawa-senyawanya sendiri disebut isomer-isomer
- 47. Keisomeran Struktur (disebabkan oleh perbedaan cara atom-atom atau gugus fungsi saling tergabung dalam suatu molekul) Keisomeran Keisomeran posisi Keisomeran kerangka Keisomeran ruang (disebabkan oleh perbedaan konnfigurasi atau susunan atom dalam ruang) Keisomeran fungsi Keisomeran geometri Keisomeran optik
- 48. Perhatikan contoh di bawah ini C C H H H C H H C H H H H C H H H n-pentana (C5H12) titik didih=36°C C C H H H C H C H H H H C H H H H 2-metilbutana (C5H12) titik didih=28°C Keisomeran kerangka terjadi bila senyawa-senyawa memiliki rumus molekul sama tetapi mempunyai kerangka atom C berbeda.Isomer kerangka dapat terjadi pada alkana, alkena, ataupun alkuna dan
- 49. Perhatikan contoh di bawah ini dan C C H H H H C C H H H H 1-butena (C4H8) titik didih=-6,2°C C C H H H H C C H H H H n-pentana (C4H8) titik didih=0,8°C (trans) atau 3,7°C (cis) Keisomeran posisi terjadi pada senyawa-senyawa yang mempunyai gugus fungsi sama tetapi posisinya sama. Keisomeran ini dapat terjadi pada senyawa-senyawa dengan gugus fungsi seperti alkena dan alkuna