Konsep p h, poh, pkw
- 1. KONSEP pH, pOH, dan pKw
- 2. • Perhatikan gambar berikut ! • Apakah tingkat Keasamannya sama ? Konsep pH, pOH dan pKw
- 3. Konsep pH, pOH dan pKw Derajat Keasaman Sorensen Ahli Kimia Denmark pH 1868 - 1939
- 4. • Nilai pH sama dengan negatif logaritma konsentrasi ion H+ Secara matematika di ungkapkan dengan persamaan berikut : pH = - log [ H + ] Konsep pH, pOH dan pKw
- 5. Ex : • Jika konsentrasi ion H+ = 0,1 M, maka : pH = - log [ H + ] = - log 0,1 = 1 • Jika konsentrasi ion H+ = 0,01 M, maka : pH = - log [ H + ] = - log 0,01 = 2 ( naik 1 satuan ) Konsep pH, pOH dan pKw
- 6. • Analogi dengan pH ( sebagai cara menyatakan konsentrasi ion H+ ), konsentrasi ion OH- juga dapat dinyatakan dengan cara yang sama, yaitu pOH. pOH = - log [ OH- ] Konsep pH, pOH dan pKw pOH
- 7. AZ • Reaksi kesetimbangan air : H2O(l) H+ ( aq ) + OH- ( aq ) • Dari persamaan diatas, di dapat tetapan kesetimbangan air : Kc = [ H+ ] [OH-] [H2O] • Oleh karena [ H2O ] dapat dianggap konstan, maka hasil perkalian Kc dengan [ H2O ] merupakan suatu konstanta yang di sebut tetapan kesetimbangan air ( Kw ) Konsep pH, pOH dan pKw Tetapan Kesetimbangan Air ( Kw )
- 8. AZ Kc = [ H+ ] [OH-] [H2O] • Oleh karena [ H2O ] dapat dianggap konstan, maka hasil perkalian Kc dengan [ H2O ] merupakan suatu konstanta yang di sebut tetapan kesetimbangan air ( Kw ) Kw = [ H+ ] [ OH- ] Konsep pH, pOH dan pKw Tetapan Kesetimbangan Air ( Kw )
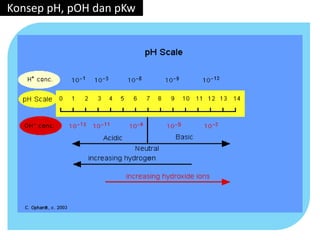
- 9. • Dalam air murni ( larutan netral ), pH = 7 pH = 7 maka, [ H+ ] = 10-7 pOH = 7 maka, [ OH- ] = 10-7 Dalam air murni, [ H+ ] sama besar [ OH- ], maka : [ H+ ] = [ OH- ] = √Kw • Sehingga di peroleh : Kw = [ H+ ] [ OH- ] = 10-7 . 10-7 = 10-14 Konsep pH, pOH dan pKw Hubungan [ H+ ] dengan [ OH- ]
- 10. • Hubungan antara pH dengan pOH dapat diturunkan dari persamaan tetapan kesetimbangan air ( Kw ) Kw = [ H+ ] [ OH- ] • Jika kedua ruas persamaan ini di ambil harga logaritmanya, diperoleh : -log Kw = - log ([ H+ ] x [ OH- ] ) -log Kw = ( - log [ H+ ] +( -log [OH-] ) • Dengan, p = - log , maka pKw = pH + pOH Konsep pH, pOH dan pKw Hubungan pH dengan pOH
- 11. • Dengan, p = - log , maka pKw = pH + pOH • Tetapan Kesetimbangan air ( Kw ) = 1 x 10-14 Kw = 1 x 10-14 maka pKw = 14 • Sehingga diperoleh : pH + pOH = 14 Konsep pH, pOH dan pKw Hubungan pH dengan pOH
- 12. Konsep pH, pOH dan pKw
- 13. 1. Hitunglah pH dari 0.025 mol CH3COOH dalam 250 ml larutannya, jika diketahui Ka = 10-5 2. Hitunglah pH dari 500 ml larutan Ca(OH)2 0.01 M ! Konsep pH, pOH dan pKw Tugas
- 14. TERIMA KASIH




![• Nilai pH sama dengan negatif logaritma
konsentrasi ion H+ Secara matematika
di ungkapkan dengan persamaan
berikut :
pH = - log [ H + ]
Konsep pH, pOH dan pKw](https://image.slidesharecdn.com/konsepphpohpkw-140519034111-phpapp01/85/Konsep-p-h-poh-pkw-4-320.jpg)
![Ex :
• Jika konsentrasi ion H+ = 0,1 M, maka :
pH = - log [ H + ]
= - log 0,1 = 1
• Jika konsentrasi ion H+ = 0,01 M, maka :
pH = - log [ H + ]
= - log 0,01 = 2 ( naik 1 satuan )
Konsep pH, pOH dan pKw](https://image.slidesharecdn.com/konsepphpohpkw-140519034111-phpapp01/85/Konsep-p-h-poh-pkw-5-320.jpg)
![• Analogi dengan pH ( sebagai cara menyatakan
konsentrasi ion H+ ), konsentrasi ion OH- juga
dapat dinyatakan dengan cara yang sama,
yaitu pOH.
pOH = - log [ OH- ]
Konsep pH, pOH dan pKw
pOH](https://image.slidesharecdn.com/konsepphpohpkw-140519034111-phpapp01/85/Konsep-p-h-poh-pkw-6-320.jpg)
![AZ
• Reaksi kesetimbangan air :
H2O(l) H+ ( aq ) + OH- ( aq )
• Dari persamaan diatas, di dapat tetapan
kesetimbangan air :
Kc = [ H+ ] [OH-]
[H2O]
• Oleh karena [ H2O ] dapat dianggap konstan, maka
hasil perkalian Kc dengan [ H2O ] merupakan suatu
konstanta yang di sebut tetapan kesetimbangan air (
Kw )
Konsep pH, pOH dan pKw
Tetapan Kesetimbangan
Air ( Kw )](https://image.slidesharecdn.com/konsepphpohpkw-140519034111-phpapp01/85/Konsep-p-h-poh-pkw-7-320.jpg)
![AZ
Kc = [ H+ ] [OH-]
[H2O]
• Oleh karena [ H2O ] dapat dianggap konstan, maka
hasil perkalian Kc dengan [ H2O ] merupakan suatu
konstanta yang di sebut tetapan kesetimbangan air (
Kw )
Kw = [ H+ ] [ OH- ]
Konsep pH, pOH dan pKw
Tetapan Kesetimbangan
Air
( Kw )](https://image.slidesharecdn.com/konsepphpohpkw-140519034111-phpapp01/85/Konsep-p-h-poh-pkw-8-320.jpg)
![• Dalam air murni ( larutan netral ), pH = 7
pH = 7 maka, [ H+ ] = 10-7
pOH = 7 maka, [ OH- ] = 10-7
Dalam air murni, [ H+ ] sama besar [ OH- ], maka :
[ H+ ] = [ OH- ] = √Kw
• Sehingga di peroleh :
Kw = [ H+ ] [ OH- ]
= 10-7 . 10-7
= 10-14
Konsep pH, pOH dan pKw
Hubungan [ H+ ] dengan
[ OH- ]](https://image.slidesharecdn.com/konsepphpohpkw-140519034111-phpapp01/85/Konsep-p-h-poh-pkw-9-320.jpg)
![• Hubungan antara pH dengan pOH dapat diturunkan
dari persamaan tetapan kesetimbangan air ( Kw )
Kw = [ H+ ] [ OH- ]
• Jika kedua ruas persamaan ini di ambil harga
logaritmanya, diperoleh :
-log Kw = - log ([ H+ ] x [ OH- ] )
-log Kw = ( - log [ H+ ] +( -log [OH-] )
• Dengan, p = - log , maka
pKw = pH + pOH
Konsep pH, pOH dan pKw
Hubungan pH dengan
pOH](https://image.slidesharecdn.com/konsepphpohpkw-140519034111-phpapp01/85/Konsep-p-h-poh-pkw-10-320.jpg)