HTA e nuovi regolamenti DM
- 1. La valutazione multiprofessionale di sistemi tecnologici: ambiti, regole e normative in una legislazione che cambia avv. Silvia Stefanelli www.studiolegalestefanelli.it 1
- 2. avv. Silvia Stefanelli 2 QUANDO NASCE LŌĆÖHTA IN CAMPO GIURIDICO COME CAMBIERAŌĆÖ IL QUADRO GIURIDICO IL RAPPORTO TRA HTA E NUOVI MDR E IVDR
- 3. avv. Silvia Stefanelli art. 15 dir 2011/24/UE Cooperazione nella valutazione delle tecnologie sanitarie 1. LŌĆÖUnione sostiene e facilita la cooperazione e lo scambio di informazioni scientifiche tra gli Stati membri nellŌĆÖambito di una rete volontaria che collega fra loro le autorit├Ā o gli organismi nazionali responsabili della valutazione delle tecnologie sanitarie designati dagli Stati membri. ŌĆ”ŌĆ”ŌĆ”. . La rete si fonda sui principi di buona governance, tra cui la trasparenza, lŌĆÖobiettivit├Ā, lŌĆÖindipendenza delle perizie, la correttezza procedurale e le opportune consultazioni dei soggetti interessati.
- 4. avv. Silvia Stefanelli art. 15 dir 2011/24/UE Cooperazione nella valutazione delle tecnologie sanitarie Gli obiettivi della rete di valutazione delle tecnologie sanitarie consistono nel: ┬╗ŌĆ» sostenere la cooperazione fra le autorit├Ā o gli organismi nazionali; ┬╗ŌĆ» sostenere gli Stati membri nella messa a disposizione di informazioni obiettive, affidabili, tempestive, trasparenti, comparabili e trasferibili sullŌĆÖefficacia relativa nonch├® sullŌĆÖefficacia a breve e a lungo termine, ove applicabile, delle tecnologie sanitarie e rendere possibile ┬╗ŌĆ» uno scambio efficace di tali informazioni fra le autorit├Ā o gli organismi nazionali; ┬╗ŌĆ» sostenere lŌĆÖanalisi della natura e del tipo di informazioni che possono essere scambiate ┬╗ŌĆ» evitare la duplicit├Ā delle valutazioni.
- 5. avv. Silvia Stefanelli art. 15 dir 2011/24/UE Cooperazione nella valutazione delle tecnologie sanitarie La rete di valutazione delle tecnologie sanitarie pu├▓ beneficiare degli aiuti dellŌĆÖUnione. Possono essere erogati aiuti al fine di: ┬╗ŌĆ» contribuire al finanziamento del sostegno amministrativo e tecnico; ┬╗ŌĆ» sostenere la collaborazione tra gli Stati membri nello sviluppare e condividere le metodologie per la valutazione delle tecnologie sanitarie, ivi compresa la valutazione dellŌĆÖefficacia relativa; ┬╗ŌĆ» contribuire a finanziare la messa a disposizione di informazioni scientifiche trasferibili da utilizzare nelle relazioni nazionali e negli studi di casi commissionati dalla rete; ┬╗ŌĆ» facilitare la cooperazione tra la rete e le altre istituzioni ed organi pertinenti dellŌĆÖUnione; ┬╗ŌĆ» facilitare la consultazione delle parti interessate sulle attivit├Ā della rete.
- 6. avv. Silvia Stefanelli art. 15 dir 2011/24/UE Cooperazione nella valutazione delle tecnologie sanitarie 2013/329/UE: Decisione di esecuzione della Commissione, del 26 giugno 2013 , che stabilisce le norme per lŌĆÖistituzione, la gestione e il funzionamento trasparente della rete di autorit├Ā nazionali o di organismi responsabili della valutazione delle tecnologie sanitarie
- 8. avv. Silvia Stefanelli PROBLEMI SORTI OSTACOLI O DISTORSIONI ALLŌĆÖACCESSO AL MERCATO SOVRAPPOSIZIONI OPERATIVE DEGLI ORGANISMI NAZIONALI INSOSTENIBILITAŌĆÖ ECONOMICA PROPOSTA DI NUOVE REGOLAMENTO COMUNITARIO
- 10. avv. Silvia Stefanelli la proposta di regolamento sullŌĆÖHealth Technology Assessment ├© stata approvata dal Parlamento Europeo in prima lettura con emendamenti il 3 ottobre 2018
- 11. avv. Silvia Stefanelli f)ŌĆ»"valutazione delle tecnologie sanitarie": un processo di valutazione comparativa pluridisciplinare, basato su domini di valutazione clinici e domini non clinici, che raccoglie e valuta le evidenze disponibili in merito agli aspetti clinici e non clinici dell'uso di una tecnologia sanitaria;
- 12. avv. Silvia Stefanelli a)ŌĆ»"valutazione clinica": la raccolta e la valutazione delle evidenze scientifiche disponibili in merito a una tecnologia sanitaria sulla base dei seguenti domini clinici di valutazione delle tecnologie sanitarie: ŌĆóŌĆ»la descrizione del problema sanitario trattato dalla tecnologia sanitaria e ŌĆóŌĆ»l'attuale utilizzo di altre tecnologie sanitarie per affrontare tale problema sanitario, ŌĆóŌĆ»la descrizione e la caratterizzazione tecnica della tecnologia sanitaria, ŌĆóŌĆ»l'efficacia clinica relativa e la sicurezza relativa della tecnologia sanitaria; b)ŌĆ»"valutazione non clinica": la parte di una valutazione delle tecnologie sanitarie basata sui seguenti domini non clinici: ŌĆóŌĆ» il costo e la valutazione economica di una tecnologia sanitaria e ŌĆóŌĆ» gli aspetti etici, organizzativi, sociali e giuridici connessi al suo utilizzo;
- 13. avv. Silvia Stefanelli ŌĆóŌĆ» valutazione collaborativa": una valutazione clinica di un dispositivo medico effettuata a livello dell'Unione da varie autorit├Ā e vari organismi di valutazione delle tecnologie sanitarie interessati, partecipanti su base volontaria.
- 14. avv. Silvia Stefanelli N. 4 PILASTRI DI COOPERAZIONE
- 15. avv. Silvia Stefanelli 1) VALUTAZIONI CLINICHE CONGIUNTE (art. 5-11) ┬╗ŌĆ» medicinali Reg. CE 726/2004 (procedura centralizzata) ┬╗ŌĆ» medical device (art. 54 MDR) - classe III e classe IIb + medicinale selezionati sulla base dei seguenti criteri ┬╗ŌĆ» bisogni non soddisfatti ┬╗ŌĆ» potenziale impatti sui pazienti ┬╗ŌĆ» dimensione transfrontaliera ┬╗ŌĆ» valore aggiunto ┬╗ŌĆ» risorse disponibili ┬╗ŌĆ» IVD - classe D (gruppo di esperti art. 106 IVDR)
- 16. avv. Silvia Stefanelli 1) VALUTAZIONI CLINICHE CONGIUNTE (art. 5-11) ┬╗ŌĆ» procedura per la valutazione clinica congiunta considerando 17 La fissazione della tempistica per le valutazioni cliniche congiunte dei dispositivi medici dovrebbe tener conto della via di accesso al mercato molto decentralizzata dei dispositivi medici e della disponibilit├Ā di pertinenti dati comprovati necessari per effettuare una valutazione clinica congiunta. Poich├® le evidenze richieste potrebbero essere disponibili soltanto dopo che un dispositivo medico ├© stato immesso in commercio e al fine di consentire la selezione dei dispositivi medici per la valutazione clinica congiunta in un momento opportuno, dovrebbe essere possibile che le valutazioni di tali dispositivi avvengano dopo la messa sul mercato dei dispositivi medici. art, 6 comma 9 Il sottogruppo designato si assicura che ai portatori di interessi, compresi i pazienti e gli esperti clinici, sia data la possibilit├Ā di presentare osservazioni durante la preparazione dei progetti di relazione sulla valutazione clinica congiunta e di relazione di sintesi e fissa un periodo di tempo durante il quale essi possono presentare osservazioni.
- 17. avv. Silvia Stefanelli 1) VALUTAZIONI CLINICHE CONGIUNTE (art. 5-11) ┬╗ŌĆ» pubblicazione ELENCO DELLE TECNOLOGIE SANITARIE VALUTATE ┬╗ŌĆ» uso del valutazioni cliniche congiunte ┬╗ŌĆ» gli stati membri non effettuano una valutazione clinica n├® iniziano valutazioni per dm incluse nellŌĆÖelenco ┬╗ŌĆ» applicano le relazioni sulle valutazioni cliniche congiunte nelle loro valutazioni delle tecnologie a livello nazionale
- 18. avv. Silvia Stefanelli 1) VALUTAZIONI CLINICHE CONGIUNTE (art. 5-11) Articolo 11 Adozione di norme procedurali dettagliate per le valutazioni cliniche congiunte 1. La Commissione mette a punto, mediante atti di esecuzione, le norme procedurali per: a) la trasmissione di informazioni, dati e evidenze da parte degli sviluppatori di tecnologie sanitarie; b) la nomina di valutatori e covalutatori; c) la determinazione dell'iter procedurale dettagliato e della sua tempistica, e della durata complessiva delle valutazioni cliniche congiunte; d) gli aggiornamenti delle valutazioni cliniche congiunte; e) la cooperazione con l'agenzia europea per i medicinali in merito alla preparazione e all'aggiornamento delle valutazioni cliniche congiunte dei medicinali; f) la cooperazione con i gruppi di esperti e gli organismi notificati in merito alla preparazione e all'aggiornamento delle valutazioni cliniche congiunte dei dispositivi medici.
- 19. avv. Silvia Stefanelli 2) CONSULTAZIONI SCIENTIFICHE CONGIUNTE (art. 12-17) possibilit├Ā per gli sviluppatori di tecnologie sanitarie di chiedere, nella fase di sviluppo di una tecnologia sanitaria, il parere delle autorit├Ā e degli organismi di valutazione delle tecnologie sanitarie sui dati e sulle evidenze che potrebbero essere richiesti nell'ambito di una potenziale futura valutazione clinica congiunta. dialoghi precoci
- 20. avv. Silvia Stefanelli 2) CONSULTAZIONI SCIENTIFICHE CONGIUNTE (art. 12-17) le relazioni sulle consultazioni scientifiche congiunte approvate dal gruppo di coordinamento saranno trasmesse agli sviluppatori di tecnologie sanitarie, non saranno pubblicate, n├® vincoleranno lo sviluppatore o gli Stati membri al momento della valutazione clinica congiunta
- 21. avv. Silvia Stefanelli 3) TECNOLOGIE SANITARIE EMERGENTI (art. 18) studio annuale al fine di individuare tecnologie sanitarie emergenti horizon scanning contribuisce all'individuazione nelle fasi iniziali del loro sviluppo delle tecnologie sanitarie che potrebbero avere un impatto di rilievo sui pazienti, sulla sanit├Ā pubblica o sui sistemi sanitari e l'inclusione di tali tecnologie nelle attivit├Ā congiunte del gruppo di coordinamento
- 22. avv. Silvia Stefanelli 4) TECNOLOGIE SANITARIE EMERGENTI (art. 19) possibilit├Ā che gli Stati membri continuino a collaborare su base volontaria a livello dell'Unione. Questa cooperazione a carattere volontario consentirebbe la valutazione delle tecnologie sanitarie diverse dai medicinali o dai dispositivi medici, valutazioni non cliniche, valutazioni collaborative dei dispositivi medici, ovvero dei dispositivi medici non selezionati per valutazioni cliniche congiunte, e la collaborazione in merito alla presentazione di evidenze supplementari che possano facilitare la valutazione delle tecnologie sanitarie
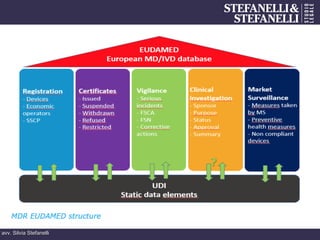
- 24. avv. Silvia Stefanelli IMPORTANTI PUNTI DI CONTATTO VALUTAZIONI CLINICA ED INDAGINE CLINICA SORVEGLIANZA POST- COMMERCAILIZZAZIONE BANCA DATI EUDAMED
- 25. avv. Silvia Stefanelli HEALTH TECHNOLOGY ASSESSMENT benefici possibili danni costi altri aspetti MARCATURA CE sicurezza performance rapporto rischi benefici dati VALUTAZIONI CLINICA ED INDAGINE CLINICA
- 26. avv. Silvia Stefanelli POSSIBILI SINERGIE Ō£ōŌĆ» unŌĆÖunica indagine clinica per due obiettivi Ō£ōŌĆ» espansione dei prodotti innovativi pi├╣ veloce e meno costosa Ō£ōŌĆ» migliore comprensione e controllo dellŌĆÖefficacia ed efficienza del DM dopo lŌĆÖimmissione in commercio il quadro ├© favorito della prossima approvazione de Proposta di REGOLAMENTO DEL PARLAMENTO EUROPEO E DEL CONSIGLIO relativo a un quadro applicabile alla libera circolazione dei dati non personali
- 28. avv. Silvia Stefanelli collaborazione tra HTA e NOTIFY BODY collaborazione tra HTA e MDCG
- 29. Grazie per la Vostra attenzione www.studiolegalestefanelli.it