01 presentaciĂ³ unitat 1 solucions
- 1. Tema 1 Ciències Naturals QuĂmica 4t ESO
- 2. 1.La matèria. ClassificaciĂ³: MATĂˆRIA Mescles - barreja de substĂ ncies - les propietats varien segons el tipus i la proporciĂ³ de les substĂ ncies que la formen - per separar-les procediments fĂsics Homogènies (solucions) no distingim els components (ex. aigua amb sal, aliatges bronze, aire,...) Heterogènies distingim els components (ex. sorra + sal, ferro + sofre,...) SubstĂ ncies pures - 1 sola susbtĂ ncia - propietats sĂ³n invariables - separaciĂ³ per procediments quĂmics (electrĂ²lisi del l'aigua) Cos simple formats per Ă toms iguals, amb el mateix Z (H2, O2, S8,...) Cos Composts formats per Ă toms diferents, amb diferent Z (H2O, NH3, CH4,...) La matèria Ă©s tot allĂ² que ocupa un lloc a l’espai i tĂ© massa
- 3. • Indica quins sĂ³n els estats en que es presenta la matèria i fĂ©s una il.lustraciĂ³ seguint el model cinètic que els representi. • A què anomenem propietats caracterĂstiques de la matèria? Digues tres exemples. SĂ³n aquelles propietats el valor de les quals no depèn de la quantitat de matèria i que permeten identificar- la i distingir-la de les altres: el punt de fusiĂ³, el d’ebulliciĂ³, la densitat, la solubilitat, la duresa, el color, l’olor, el sabor, la fragilitat, la ductilitat …
- 4. Indica quines de les segĂ¼ents substĂ ncies sĂ³n pures i quines sĂ³n mescles:  Aire  Llet  Xocolata  Or  Coure  Fructosa  Petroli mescla mescla mescla mescla pura pura pura
- 5. • Digues quin mètode utilitzaries per separar les substĂ ncies de les mescles segĂ¼ents. a) llimadures de ferro i pols de sofre. b) sorra i aigua. c) oli i aigua. magnetisme filtraciĂ³ decantaciĂ³
- 6. 2.Canvis fĂsics i canvis quĂmics:  Anomenem canvi fĂsic aquell en què no varia la naturalesa de les substĂ ncies. En sĂ³n exemples: canvi de posiciĂ³, d’estat, de temperatura, la dissoluciĂ³â€¦  Anomenem canvi quĂmic o reacciĂ³ quĂmica les transformacions en què una o diverses substĂ ncies es converteixen en unes altres de noves. En sĂ³n exemples: la combustiĂ³, oxidaciĂ³ dels metalls…
- 7. La fusiĂ³ del gel Ă©s un canvi fĂsic, perquè la naturalesa de la substĂ ncia aigua no ha canviat. Passem d’aigua sĂ²lida a aigua lĂquida L’oxidaciĂ³ d’un clau de ferro Ă©s un canvi quĂmic perquè la naturalesa de les substĂ ncies ha variat. El ferro reacciona amb O2 de l’aire i s’obtĂ© Ă²xid de ferro.
- 8. 2.Les solucions, un exemple de canvi fĂsic:  Una soluciĂ³ o dissoluciĂ³ Ă©s una mescla homogènia, Ă©s a dir, una barreja en què no podem distingir a ull un, ni amb microscopi, els diferents components.
- 9. 3.Els components d’una soluciĂ³:  Els components d’una soluciĂ³ sĂ³n el solut i el dissolvent.  El solut Ă©s la substĂ ncia que es dissol, Ă©s a dir, que disgrega o dispersa en una altra, que anomenem dissolvent.  En una soluciĂ³ nomĂ©s hi ha un dissolvent, perĂ² poden haver-hi diversos soluts.
- 10. 4.Tipus de solucions:  Solucions gasoses: mescles homogènies de gasos aire (O2, N2, CO2, vapor H2O…)  Solucions lĂquides:  Gas-lĂquid begudes carbĂ²niques  LĂquid-lĂquid benzina, alcohol+aigua  SĂ²lid-lĂquid sal en aigua, sucre en aigua  Solucions sĂ²lides: mescles homogènies de diferents metalls o bĂ© un metall i uns altres tipus de substĂ ncies. S’anomenen aliatges bronze, acer inoxidable, llautĂ³â€¦
- 11.  En les solucions lĂquid-sĂ²lid, el sĂ²lid sempre Ă©s el solut i el lĂquid, el dissolvent.  En les solucions entre lĂquids o gasos, el solut Ă©s el component minoritari i el dissolvent el majoritari. A excepciĂ³ de quan el lĂquid Ă©s aigua, aquesta Ă©s el dissolvent, independentment de la proporciĂ³ en què es trobi.
- 13. 5.ComposiciĂ³ de les solucions:  Per identificar una soluciĂ³ NO hi ha prou amb indicar-ne els components que la formen, sinĂ³ que cal expressar la proporciĂ³ en què es troben.  Ho podem fer de manera qualitativa o quantitativa.
- 14. 5.1. Qualitativa:  Una soluciĂ³ s’anomena diluĂ¯da quan la quantitat de solut dissol Ă©s petita en comparaciĂ³ de la quantitat de dissolvent.  Si una soluciĂ³ contĂ© molt solut, s’anomena concentrada.  Una soluciĂ³ estĂ saturada quan ja no Ă©s possible dissoldre mĂ©s solut.
- 15. 5.2. Quantitativa. ConcentraciĂ³ d’una soluciĂ³:  La concentraciĂ³ d’una soluciĂ³ indica la quantitat de solut dissolta en una quantitat determinada de soluciĂ³.  ConcentraciĂ³ en massa  Tant per cent en massa  Molaritat
- 16. • ConcentraciĂ³ en massa (g/l) La concentraciĂ³ en massa Ă©s el nombre de grams de solut que hi ha dissolt en cada litre de soluciĂ³.  Unitats: g/l Ă³ g/dm3  FĂ³rmula: g solut/ l soluciĂ³  Exemple: Donada una soluciĂ³ de sucre en aigua de concentraciĂ³ en massa 20 g/l. Qui Ă©s solut? Dissolvent? Què vol dir 20 g/l? Solut: sucre Dissolvent: aigua 20 g/l: Indica que hi ha 20 g de solut (sucre) per cada litre de soluciĂ³. Si tenim 1 l de soluciĂ³ hi ha 20 g de sucre, si tenim 500 ml de soluciĂ³ hi ha 10 g de sucre, si tenim 250 ml de soluciĂ³ hi ha 5 g de sucre…
- 17. • Tant per cent en massa (%) El tant per cent en massa Ă©s el nombre de grams de solut que hi ha dissolt en 100 g de soluciĂ³.  FĂ³rmula: g solut/ g soluciĂ³ x 100  Exemple: Donada una soluciĂ³ aquosa de sal comuna al 2%. Qui Ă©s solut? Dissolvent? Què vol dir 2%? Solut: sal (clorur de sodi) Dissolvent: aigua 20 g/l: Indica que hi ha 2 g de solut (sal) per cada 100 g de soluciĂ³, o tambĂ©, 2 g de sal per cada 98 g d’aigua. Si tenim 100 g de soluciĂ³ hi ha 2 g de sal, si tenim 50 g de soluciĂ³ hi ha 1 g de sal, si tenim 10 g de soluciĂ³ hi ha 0’2 g de sal…
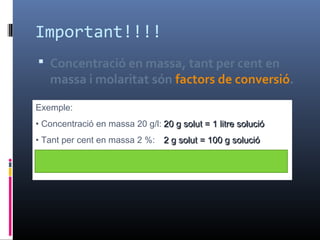
- 18. Important!!!!  ConcentraciĂ³ en massa, tant per cent en massa i molaritat sĂ³n factors de conversiĂ³. Exemple: • ConcentraciĂ³ en massa 20 g/l: 20 g solut = 1 litre soluciĂ³20 g solut = 1 litre soluciĂ³ • Tant per cent en massa 2 %: 2 g solut = 100 g soluciĂ³2 g solut = 100 g soluciĂ³ • Molaritat 0’5 M: 0’5 mols solut = 1 litre soluciĂ³0’5 mols solut = 1 litre soluciĂ³
- 19. • Dissolem en aigua 10 g de nitrat de potassi (KNO3) fins que obtenim 500 cm3 de soluciĂ³. Quina Ă©s la concentraciĂ³ en massa de la soluciĂ³ obtinguda? • En 150 g d’aigua es dissolen 15 g de sulfat de coure (II) CuSO4. Quin Ă©s el % en massa de solut de la soluciĂ³ preparada? • Quants grams de solut i de dissolvent hi ha en 500 g d’una soluciĂ³ al 10 % en massa de solut? 20 g / L 9,1 % 50 g solut i 450 g dissolvent
- 20. 6.La solubilitat: • per què l’oli i l’aigua no poden mesclar-se? • per què tirem sal a les carreteres nevades? • per què Ă©s mĂ©s fĂ cil dissoldre el colacao en llet calenta que en llet freda?
- 21.  La solubilitat Ă©s una propietat caracterĂstica de les substĂ ncies i es defineix com la capacitat que tĂ© una substĂ ncia de dissoldre´s en un dissolvent.  Hi ha substĂ ncies que es dissolen en uns lĂquids i que en canvi no ho fan en uns altres. La sal Ă©s soluble en aigua perĂ² no en oli o alcohol…  Quan dos lĂquids poden mesclar-se diem que sĂ³n miscibles. Quan quĂmicament Ă©s impossible que es dissolguin, s’anomenen inmiscibles. Per exemple aigua i oli .  La solubilitat depèn de la temperatura del dissolvent. La solubilitat de la majoria de les susbstĂ ncies sĂ²lides augmenta amb la T. Els gasos es dissolen millor en fred.
- 22. • La solubilitat d’una substĂ ncia en un dissolvent determinat i a una temperatura donada es pot quantificar, perquè es pot determinar la quantitat mĂ xima de solut que es pot dissoldre en una quantitat determinada de dissolvent, a aquella temperatura. • La solubilitat s’expressa en nombre de g de solut en 100 g de dissolvent. • Es considera que una substĂ ncia Ă©s insoluble en un dissolvent quan en 100 g d’aquest es dissolen menys de 0’1 g de solut. • Quan es representa grĂ ficament la solubilitat d’una substĂ ncia en funciĂ³ de la temperatura, s’obtĂ© la corba de solubilitat.
- 23. Com es pot observar al grĂ fic, no totes les substĂ ncies es comporten de la mateixa manera. La majoria de les substĂ ncies augmenten la seva solubilitat amb la temperatura, perĂ², la solubilitat del NaCl gairebĂ© no varia amb la temperatura.
- 24. •Per què es bull aigua quan es vol preparar una infusiĂ³? • Se sap que a 30 ºC es dissolen com a mĂ xim 14 g d’una substĂ ncia en 50 g d’aigua. Quina Ă©s la solubilitat d’aquesta substĂ ncia? • La solubilitat del clorur de potassi a 400 ºC Ă©s de 38 g de KCl en 100 g d’aigua. Quants grams es dissoldran en 150 g d’aigua? 28 g 57 g 91 g es dissoldran i 9 g quedaran sense dissoldre’s • La solubilitat del nitrat de sodi a 30 ºC Ă©s de 91 g de NaNO3 en 100 g d’aigua. Si afegim 100 g de nitrat de sodi a 100 g d’aigua a aquesta temperatura, quants grams es dissoldran i quants quedaran sense dissoldre’s?
- 25. 7.Material per preparar solucions: balança espà tula matràs aforat proveta vas de precipitats