1. Struktura atoma i PSE.pdf
- 1. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 1
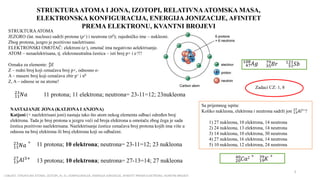
- 2. STRUKTURAATOMA I JONA, IZOTOPI, RELATIVNAATOMSKA MASA, ELEKTRONSKA KONFIGURACIJA, ENERGIJA JONIZACIJE, AFINITET PREMA ELEKTRONU, KVANTNI BROJEVI I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, AFINITET PREMA ELEKTRONU, KVANTNI BROJEVI 2 STRUKTURAATOMA JEZGRO (lat. nucleus) sadr┼Ši protone (p+) i neutrone (n0); zajedni─Źko ime ŌĆō nukleoni. Zbog protona, jezgro je pozitivno naeletrisano. ELEKTRONSKI OMOTA─ī: elektroni (e-), omota─Ź ima negativno aelektrisanje. ATOM ŌĆō nenaelektrisana, tj. elekroneutralna ─Źestica ŌĆō isti broj p+ i e-!!! Oznaka za elemente: ØÉĖ ØæŹ ØÉ┤ Z ŌĆō redni broj koji ozna─Źava broj p+, odnosno e- A ŌĆō maseni broj koji ozna─Źava zbir p+ i n0 Z, A ŌĆō odnose se na atome! ØæüØæÄ 11 23 11 protona; 11 elektrona; neutrona= 23-11=12; 23nukleona NASTAJANJE JONA (KATJONA I ANJONA) Katjoni (+ naelektrisani joni) nastaju tako ┼Īto atom nekog elementa odbaci odre─Äen broj elektrona. Tada je broj protona u jezgru ve─ći od broja elektrona u omota─Źu zbog ─Źega je sada ─Źestica pozitivno naelektrisana. Naelektrisanje ─Źestice ozna─Źava broj protona kojih ima vi┼Īe u odnosu na broj elektrona ili broj elektrona koji su odba─Źeni. ØæüØæÄ + 11 23 11 protona; 10 elektrona; neutrona= 23-11=12; 23 nukleona ØÉ┤ØæÖ3: 13 27 13 protona; 10 elektrona; neutrona= 27-13=14; 27 nukleona ØÉ┤Øæö 47 108 ØÉĄØæ¤ 35 79 ØæåØæÅ 51 121 ØÉČØæÄ2 + 20 40 ØÉŠ + 19 39 Sa prijemnog ispita: Koliko nukleona, elektrona i neutrona sadr┼Ši jon ØÉ┤ØæÖ 13 27 3+? 1) 27 nukleona, 10 elektrona, 14 neutrona 2) 24 nukleona, 13 elektrona, 14 neutrona 3) 14 nukleona, 10 elektrona, 30 neutrona 4) 27 nukleona, 16 elektrona, 14 neutrona 5) 10 nukleona, 12 elektrona, 24 neutrona Zadaci CZ: 1, 8
- 3. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 3 Anjoni (ŌĆō naelektrisani joni) nastaju primanjem elektrona. Tada je broj elektrona ve─ći od broja protona, te jon ima negativno naelektrisanje. Naelektrisanje ozna─Źava koliko je elektrona do┼Īlo, odnosno koliki je broj elektrona koji su vi┼Īak u odnosu na broj protona. ØÉČØæÖ 17 35 Atom: 17 protona; 17 elektrona; 35-17=18 neutrona; 35 nukleona ØÉČØæÖ ŌłÆ 17 35 Anjon: 17 protona; 18 elektrona; 35-17=18 neutrona; 35 nukleona Øæé2 ŌłÆ 8 16 ØÉĄØæ¤ ŌłÆ 35 80 Øæü3 ŌłÆ 7 14 IZOTOPI Izotopi su atomi istog elementa (imaju isti broj protona i elektrona) koji se razlikuju po broju neutrona (isti redni, a razli─Źit maseni broj). Maseni broj (relativna atomska masa) svakog pojedina─Źnog izotopa se ra─Źuna kada se masa atoma podeli sa 1/12 mase ugljenikovog izotopa 12C (unificirana jedinica u=1,67┬Ę10-27kg) H 1 1.008 Relativna atomska masa izotopa se ra─Źuna prema izrazu: Ar= ØæÜØæÄØæĪØæ£ØæÜØæÄ Øæó ØæśØæö ØæśØæö =/ Primer 1. Izra─Źunati relativnu atomsku masu atoma ─Źija je masa 3.848┬Ę 10-20 mg. ma= 3.848┬Ę 10-20 mg= 3.848┬Ę 10-23 g= 3.848┬Ę 10-26 kg Ar= 3.848ŌłÖ10ŌłÆ26 ØæśØæö 1.67ŌłÖ10ŌłÆ27ØæśØæö = 23 Primer 2. Kolika je masa atoma (mg) ugljenikovog izotopa 13C? ØæÜØæÄ = ØÉ┤Øæ¤ ŌłÖ Øæó = 13 ŌłÖ 1.67 ŌłÖ 10;27 ØæśØæö = 21.58 ŌłÖ 10;27 ØæśØæö = 2.158 ŌłÖ 10;26 ØæśØæö = 2.158 ŌłÖ 10;23 Øæö = 2.158 ŌłÖ 10;20 ØæÜØæö 1.Kolika je masa atoma (mg, g, kg) slede─ćih izotopa: a) 27Al; b) 7Li; c) 65Cu? 2. Izra─Źunati Ar izotopa ─Źija je masa atoma: a) 1.66┬Ę10-20 mg b) 1.046┬Ę10-25 kg James Chedvik otkrio neutrone m(p+)~m(no)
- 4. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 4 Relativna atomska masa elementa ra─Źuna se u odnosu na procentnu zastupljenost izotopa, na osnovu izraza: Izra─Źunati relativnu atomsku masu litijuma, ako je njegov izotop 6Li u prirodi zastupljen 7.59%, dok je izotop 7Li zastupljen 92.41%. Ar(Li)= (7.59% ŌłÖ6):(92.41%ŌłÖ7) 100 = 6.92 Primer 1. Primer 2. Neon je u prirodi zastupljen u obliku dva izotopa 20Ne i 22Ne. Izra─Źunati procentnu zastupljenost izotopa u prirodnoj sme┼Īi, ako je relativna atomska masa neona 20.2. 20.2 = 20ŌłÖØæź :(22ŌłÖØæ”) 100 = 20Øæź:22(100;Øæź) 100 = 20Øæź :2200;22Øæź 100 1) 2) x + y =100 y =(100 ŌĆō x) 20.2 ŌłÖ 100 =20x+2200-22x 22Øæź ŌłÆ 20Øæź =2200-2020 2x=180 x=90; y=10% Zadaci CZ: 13, 15, 16 20Ne x ŌĆō procentna zastupljenost 22Ne y ŌĆō procentna zastupljenost
- 5. S-ORBITALA (PODNIVO) ima oblik sfere. Pojavljuje se od prvog nivoa, sastoji se od jedne atomske orbitale i maksimalno prima 2 elektrona. Oznaka 1s2 zna─Źi da se na prvom nivou (n=1) u s orbitali (podnivo) nalaze 2 elektrona. 1s2 3s2 5s1 4s3 ? I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 5 STRUKTURA ELEKTRONSKOG OMOTA─īA Energetski nivoi predstavljaju putanje kretanja elektrona (sfere,ljuske, slojevi). Ozna─Źavaju se brojem n (glavni kvantni broj) i mogu imati vrednosti 1-7. Mogu biti obele┼Šeni i slovima: K, L, M, N, O, P ąĖ Q. n= 1, 2, 3, 4, 5, 6, 7 K, L, M, N, O, P, Q Elektroni svojim kretanjem zauzimaju odre─Äeni prostor koji se naziva atomska orbitala (predstavlja deo prostora u atomu gde je verovatno─ća nala┼Šenja elektrona najve─ća). Postoje s, p, d i f ŌĆō orbitale. P-ORBITALA (PODNIVO) se pojavljuje od drugog nivoa. Sastoji se od maksimalno 3 atomske orbitale koje se predstavljaju na osama koordinatnog sistema i shodno tome, ozna─Źavaju se px, py, pz. U p podnivo masimalno staje 6 elektrona, koji se raspore─Äuju po┼Ītuju─ći Hundovo pravilo. Hund: Orbitale jednakog sadr┼Šaja energije (degenerisane orgitale), popunjavaju se tako ┼Īto vi┼Īe podorbitala bude najpre delimi─Źno popunjeno jednim elektronom I to istog spina, a tek tada zapo─Źinje potpuno popunjavanje podorbitala. Takvo popunjavanje je energetski najpovoljnije. px py pz
- 6. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 6 4p4 4 nivo p podnivo 4 elektrona Hund 4px 4py 4pz 4px 4py 4pz 2 nesparena elektrona 0 nesparenih elektrona 5p3 5px 5py 5pz 3 nesparena elektrona 5px 5py 5pz 1 nesparen elektron 3p2 3px 3py 3pz ŌĆō ne postoji! 2 nesparena elektrona Ukoliko nema elektrona, atomska orbitala ne postoji! Zbog toga ka┼Šemo da p podnivo sadr┼Ši maksimalno 3 atomske orbitale! 2p6 2px 2py 2pz 2px 2py 2pz PARAMAGNETICI ŌĆō supstance koje sadr┼Še nesparene elektrone - pona┼Īaju se kao magneti, magnetno polje ih privla─Źi! DIJAMAGNETICI ŌĆō supstance kod kojih su svi elektroni spareni - magnetno polje ih odbija!
- 7. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 7 D-ORBITALA (PODNIVO) se pojavljuje od tre─ćeg nivoa. Sastoji se od 5 atomskih orbitala u koje maksimalno staje 10 elektrona, koji se sme┼Ītaju u skladu sa Hundovim pravilom. dxy dyz dxz dx2-y2 dz 2 4d5 dxy dyz dxz dx2-y2 dz 2 nd8 dxy dyz dxz dx2-y2 dz 2 nd4 ŌĆō 1 elektron nedostaje da d nivo bude polupopunjen nd9 ŌĆō 1 elektron nedostaje da d nivo bude popunjen Nestabilna stanja d podnivoa! Treba─će nam malo kasnije! f-ORBITALA (PODNIVO) se pojavljuje od ─Źetvrtog nivoa. Sastoji se od 7 atomskih orbital u koje max. staje 14 elektrona 4f 5 4 nivo f podnivo 5 elektrona fz 3, fyz 2, fxz 2, fxyz, fz(x 2 -y 2 ), fy(3x 2 -y 2 ), fx(x 2 -3y 2 )
- 8. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 8 Nivo Podnivo Ukupan (max) broj a.o. Max broj eŌĆō 1 s 1 2 2 s, p 4 8 3 s, p, d 9 18 4 s, p, d, f 16 32 5 s, p, d, f 16 32 6 s, p, d, f 16 32 7 s, p, d, f 16 32 1. Koliki je maksimalni broj atomskih orbitala na tre─ćem energetskom nivou? a) 3 b) 9 c) 18 d) 32 e) 16 2. Koliki je maksimalni broj elektrona na ─Źetvrtom energetskom nivou? 3. Koliki je maksimalan broj podnivoa na ─Źetvrtom energetskom nivou? IZGRADNJA ELEKTRONSKOG OMOTA─īA Elektroni se sme┼Ītaju u orbitale po slede─ćem redosledu: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s Ve┼Šbanje 1. Napisati najstabilnije elektronske konfiguracije atoma datih elemenata: ŌĆó 19X 1s2 2s2 2p6 3s2 3p6 4s1 ŌĆó 36E 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 ŌĆó 15Y ŌĆó 18N ŌĆó 32L ŌĆó 20K ŌĆó 24G ŌĆó 36S ŌĆó 39W s - blok p - blok p - blok s - blok d - blok f - blok Zadaci CZ: 2, 27, 28
- 9. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 9 ODRE─ÉIVANJE PERIODE I GRUPE NA OSNOVU ELEKTRONSKE KONFIGURACIJE Polo┼Šaj u PSE (perioda i grupa) odre─Äuje se samo za atome elemenata! Prvo odredi blok kojem element pripada, a zatim primeni odgovaraju─će pravilo! s ŌĆō blok (A grupe) p ŌĆō blok (A grupe) (IA / alkalni, IIA / zemnoalkalni metali): nsŌēż2 (osim 1s2 ŌĆō He) Grupa: broj elektrona iz s orbitale. Perioda je odre─Äena poslednjim energetskim nivoom ŌĆō n. ŌĆó 19X 1s2 2s2 2p6 3s2 3p6 4s1 IA -grupa 4 (N) perioda ŌĆó 20X 1s2 2s2 2p6 3s2 3p6 4s2 IIA -grupa 4 (N) perioda ŌĆó 11X 1s2 2s2 2p6 3s1 IA -grupa 3 (M) perioda Plemeniti gasovi : 1s2 ŌĆō He ns2 np6 Ne, Ar; ns2 (n-1)d10 np6 ŌĆō Kr, Xe, Rn VIIIA /18/0: sabiraju se elektroni iz s i p orbitala istog nivoa. Perioda je odre─Äena poslednjim energetskim nivoom ŌĆō n. (IIIA, IVA, VA, VIA / halkogeni, VIIA / halogeni elementi): ns2 np<6 ns2 (n-1)d10 np< 6 Grupa: broj elektrona iz s i p orbitale najvi┼Īeg nivoa. Perioda je odre─Äena poslednjim energetskim nivoom ŌĆō n. ŌĆó 2He 1s2 ŌĆó 10Ne 1s2 2s2 2p6 ŌĆó 18Ar 1s2 2s2 2p6 3s2 3p6 ŌĆó 36Kr [Ar] 4s2 3d10 4p6 ŌĆó 54Xn [Kr] 5s2 4d10 5p6 VIIIA/0/18; 1 perioda 2 perioda 3 perioda 4 perioda 5 perioda ŌĆó 15P 1s2 2s2 2p6 3s2 3p3 ŌĆó 9F 1s2 2s2 2p5 ŌĆó 35Br [Ar] 4s2 3d10 4p5 VIIA/17; 2 perioda VIIA/17; 4 perioda VA/15; 3 perioda Najstabilnije el. konfiguracije u PSE! Zadaci CZ: 5, 6, 7, 9, 10, 11, 14, 25. Najizra┼Šenija metalna svojstva pokazuju elementi IA grupe (alkalni), a zatim IIA grupe (zemnoalkalni). Najizra┼Šenija nemetalna svojstva pokazuju elementi VIIA grupe (halogeni), a zatim VIA grupe (halkogeni). Elementi koji se nalaze unutar iste grupe imaju najsli─Źnije osobine!!!
- 10. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 10 d - blok Elementi d-bloka (IIIB, IVB, VB, VIB, VIIB, VIIIB, IB, IIB): ns2 (n-1)dŌēż8 Grupa: broj elektrona iz ns i (n-1)d orbitala. Perioda je odre─Äena poslednjim energetskim nivoom ŌĆō n. ŌĆó 25Mn 1s2 2s2 2p6 3s2 3p6 4s2 3d5 ŌĆó 26Fe 1s2 2s2 2p6 3s2 3p6 4s2 3d6 ŌĆó 27Co 1s2 2s2 2p6 3s2 3p6 4s2 3d7 ŌĆó 28Ni 1s2 2s2 2p6 3s2 3p6 4s2 3d8 ŌĆó 23V 1s2 2s2 2p6 3s2 3p6 4s2 3d3 ŌĆó 22Ti 1s2 2s2 2p6 3s2 3p6 4s2 3d2 IIIB/3; 4 perioda IVB/4; 4 perioda VB/5; 4 perioda VIIB/7; 4 perioda VIIIB/8; 4 perioda VIIIB/9; 4 perioda VIIIB/10; 4 perioda ŌĆó 24Cr 1s2 2s2 2p6 3s2 3p6 4s2 3d4 = 1s2 2s2 2p6 3s2 3p6 4s1 3d5 VIB/6; 4 perioda ŌĆó 29Cu 1s2 2s2 2p6 3s2 3p6 4s2 3d9 = 1s2 2s2 2p6 3s2 3p6 4s1 3d10 IB/11; 4 perioda ŌĆó 30Zn 1s2 2s2 2p6 3s2 3p6 4s2 3d10 IIB/12; 4 perioda !!!!!! Najstabilnija el. konfiguracija ŌĆó 21Sc 1s2 2s2 2p6 3s2 3p6 4s2 3d1
- 11. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 11 Elektronska konfiguracija jona Primer : Odrediti polo┼Šaj u PSE (periodu i grupu) elementa X, ako njegov jon X3- ima elektronsku konfiguraciju 1s2 2s2 2p6 3s2 3p6. Pozicija u PSE mo┼Še da se odredi samo za neutralni atom. Preko broja elektrona u jonu, moramo da shvatimo koliko ima elektrona u atomu i tek onda da odredimo periodu i grupu. X3- 1s2 2s2 2p6 3s2 3p6 ; X3- jon sadr┼Ši 18 elektrona. Po┼Īto je jon tri puta negativno naelektrisan, jon X3- u odnosu na atom X ima 3 elektrona vi┼Īka, ┼Īto ukazuje da je broj protona u atomu X = 15, a ujedno to je i broj elektrona u neutralnom atomu. X 1s2 2s2 2p6 3s2 3p3 VA grupa i tre─ća perioda; broj protona je 15, a ujedno to je i redni broj. Zadaci za ve┼Šbanje: 1. Jon Y2+ ima elektronsku konfiguraciju argona. Odrediti periodu, grupu i redni broj elementa Y. 2. Neki element N se nalazi u drugoj periodi i VIA grupi. Napisati el. konfiguraciju njegovog najstabilnijeg jona. 3. Neki element M se nalazi u tre─ćoj periodi i IA grupi. Napisati el. konfiguraciju njegovog najstabilnijeg jona. 4. Ako je el. Konfiguracija jona X2- [Kr] 5s2 4d10 5p6 , odrediti periodu i grupu elementa X. Zadaci CZ: 24
- 12. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 12 E 1s2 2s2 2p6 3s2 3p5 4s1 1s2 2s2 2p6 3s2 3p6 + E ekscitovano stanje nestabilna elektronska konfiguracija osnovno stanje stabilna elektronska konfiguracija ŌĆó Redni broj elementa je 18. ŌĆó Prilikom vra─ćanja elektrona iz 4s u 3p podnivo energija se vezuje. ŌĆó Prilikom vra─ćanja elektrona iz 4s u 3p podnivo energija se emituje (osloba─Äa). ŌĆó Element se nalazi u 4. periodi. ŌĆó Data elektronska konfiguracija je najstabilnija. Niels Bohr
- 13. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 13 ENERGIJA JONIZACIJE (Ei) Energija jonizacije predstavlja energiju koju je potrebno dovesti jednom atomu nekog elementa u gasovitom stanju da bi se iz njegovog poslednjeg nivoa udaljio najslabije vezan elektron, pri ─Źemu nastaje jon. Ovaj proces se mo┼Še predstaviti: X(g) + Ei ŌåÆ X+ (g) + eŌĆō Dovo─Äenjem prve energije jonizacije udaljava se jedan elektron, dok dovo─Äenjem slede─će ŌĆō druge Ei udaljava se slede─ći elekron,... ┼Āto je energija jonizacije ni┼Ša, to atom lak┼Īe otpu┼Īta elektron. Najve─ću mo─ć jonizacije imaju dakle oni elementi PSE koji imaju niske energije jonizacije ŌĆō IA i IIA grupa. Ei u periodi raste, u grupi opada. - 1 elektron, I Ei - 1 elektron, I Ei 11Na 1s2 2s2 2p6 3s1 - 1 elektron, I Ei 11Na+ 1s2 2s2 2p6 [Ne] 3Li 1s2 2s1 3Li+ 1s2 [He] 19K 1s2 2s2 2p6 3s2 3p6 4s1 19K+ 1s2 2s2 2p6 3s2 3p6 [Ar] 20Ca 1s2 2s2 2p6 3s2 3p6 4s2 -2 elektrona I i II Ei 20Ca2+ 1s2 2s2 2p6 3s2 3p6 [Ar] 13Al 1s2 2s2 2p6 3s2 3p1 13Al3+ 1s2 2s2 2p6 [Ne] -3 elektrona I, II i III Ei U kojem od navedenih nizova energija jonizacije raste? a) He, Ne, O, N, Mg, Na b) F, Cl, O, Ne, Br, Na, Ar c) K, Na, Mg, Al, O, Ar d) H, Li, Na, K, Rb, Mg Za odgovor na ovo pitanje neophodno je znati poziciju elemenata u PSE napamet! Zadaci CZ: 4, 19, 20, 26
- 14. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 14 Molarna energija jonizacije (Ei,mol) predstavlja energiju koju je potrebno dovesti jednom molu atoma nekog elementa u gasovitom stanju, da bi se iz svakog atoma udaljio electron. ØÉĖØæ¢,ØæÜØæ£ØæÖ= ØÉĖØæ¢ ŌłÖ ØæüØÉ┤ Ei se izra┼Šava u aJ / J / kJ (1 aJ = 1┬Ę10-18 J = 1┬Ę 10-21 kJ). NA=6.023┬Ę1023 atoma/mol Primer: Izra─Źunati molarnu energiju jonizacije natrijuma, ako je Ei(Na)=0,82 aJ. Ei(Na)=0,82 aJ = 0,82┬Ę10-18 J = 8,2┬Ę10-19 J= 8,2┬Ę10-22 kJ ØÉĖØæ¢,ØæÜØæ£ØæÖ = 8,2 ŌłÖ 10;19 ØÉĮ ØæÄØæĪØæ£ØæÜ ŌłÖ 6 ŌłÖ 1023 ØæÄØæĪØæ£ØæÜ ØæÜØæ£ØæÖ = 492000 ØÉĮ ØæÜØæ£ØæÖ = 492 ØæśØÉĮ ØæÜØæ£ØæÖ Zadaci CZ: 17, 18. AFINITET PREMA ELEKTRONU (Ea) Predstavlja energiju koja se osloba─Äa kada atom nekog elementa u gasovitmo stanju primi elektron i na taj na─Źin se stabilizuje. Mo┼Še se predstaviti jedna─Źinom: X(g) + eŌĆō ŌåÆ XŌĆō (g) + E Ea je veli─Źina koja je karakteristi─Źna za VIIA i VIA grupu elemenata. Ea u periodi raste, a u grupi opada, a nave─ću vrednost u PSE imaju: F>Cl > Br > I > O > S. Zadaci CZ: 3, 21, 22, 23
- 15. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 15 KVANTNI BROJEVI Prema Paulijevom principu isklju─Źenja ne postoje dva elektrona koja imaju sva ─Źetiri kvantna broja ista. Postoje 4 kvantna broja: n ŌĆō glavni kvantni broj Mo┼Še imati vrednosti od 1-7 ┼Īto ozna─Źava broj energetskog nivoa na kojem se elektron nalazi: n= 1, 2, 3, 4, 5, 6, 7 l ŌĆō orbitalni ili sporedni kvantni broj Ra─Źuna se preko n: lŌēż ØÆÅ ŌłÆ ؤŠn = 1 lŌēż ؤŠŌłÆ ؤŠl= Ø¤Ä n = 2 lŌēż Ø¤É ŌłÆ ؤŠlŌēż 1 l= ؤÄ, ؤŠn = 3 lŌēż ؤæ ŌłÆ ؤŠlŌēż 2 l= ؤÄ, ؤÅ, Ø¤É n = 4 lŌēż Ø¤Æ ŌłÆ ؤŠlŌēż 3 l= ؤÄ, ؤÅ, ؤÉ, 3 s-orbitala s p s p d s p d f Nivo Podnivo Max broj a.o. Max broj eŌĆō 1 s 1 2 2 s, p 4 8 3 s, p, d 9 18 4 s, p, d, f 16 32 5 s, p, d, f 16 32 6 s, p, d, f 16 32 7 s, p, d, f 16 32 n l ml ms
- 16. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 16 ml ŌĆō magnetni kvantni broj Pokazuje uticaj magnetnog polja na prostornu orijentaciju orbitala Ra─Źuna se za izabrano l i ozna─Źava atomsku orbitalu (ku─ćicu) u kojoj se elektron nalazi: ml= -l, ....., 0, ....., l jedna orjentacija orbitale u s-podnivou l = 0 s ŌĆōorbitala ml=0 l = 1 p ŌĆō orbitala ml = -1 0 1 px py pz l = 2 d ŌĆō orbitala ml = -2 -1 0 1 2 dxy dyz dxz dx2-y2 dz 2 l = 3 f ŌĆō orbitala ml = -3 -2 -1 0 1 2 3 ’éĘ ms ŌĆō spinski kvantni broj. Ozna─Źava smer rotacije elektrona i mo┼Še imati vrednosti ili ┬Į ili - ┬Į . ms ŌĆō spinski kvantni broj Ozna─Źava smer rotacije elektrona i mo┼Še imati vrednosti ili ┬Į ili - ┬Į . 4px 4py 4pz ms = 1/2 ms = -1/2 ms = 1/2 ms = 1/2 n = 4 l = 1 ml = -1(4px) 0 (4py) 1 (4pz) Zadaci CZ: 12 postoje tri mogu─će orjentacije orbitala u p-podnivou postoji pet mogu─ćih orjentacija orbitala u d-podnivou postoji sedam mogu─ćih orjentacija orbitala u f-podnivou
- 17. I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 17 Ve┼Šbanje: U datoj elektronskoj konfiguraciji elementa: E: 1s2 2s2 2p6 3s2 3p6 odrediti kvantne brojeve za svaki elektron iz tre─ćeg en. nivoa. n = 3 l = 0 ml = 0 ms = +1/2 n = 3 l = 0 ml = 0 ms = -1/2 n = 3 l = 1 ml = -1 ms = +1/2 n = 3 l = 1 ml = -1 ms = -1/2 n = 3 l = 1 ml = 0 ms = +1/2 E : 1s2 2s2 2p6 3s2 3p6 3px 3py 3pz 3s n = _ l = _ ml = _ ms = _ n = _ l = _ ml = _ ms = _ n = _ l = _ ml = _ ms = _ Primeri zadataka sa prijemnog ispita 1. Kojom od navedenih kombinacija kvantnih brojeva je mogu─će opisati energetsko stanje elektrona u atomu? a) n = 2 l = 2 ml = -1 ms = +1/2 b) n = 3 l = 1 ml = -1 ms = 0 c) n = 0 l = 1 ml = 0 ms = +1/2 d) n = 1 l = 0 ml = 0 ms = +1/2 e) n = 4 l = 3 ml = 3 ms = +1/2 2. Koja od navedenih tvrdnji je ta─Źna? a) s-Orbitalama odgovara orbitalni kvantni broj 1. b) Element elektronske konfiguracije 1s2 2s2 2p3 ima jedan nesparen elektron. c) Orbitalni kvantni broj odre─Äuje prostornu orijentaciju atomskih orbitala. d) Prilikom popunjavanja orbitala elektronima, prvo se popunjava 3d, a zatim 4s orbitala. e) Jedno od mogu─ćih energetskih stanja elektrona je ono sa kvantnim brojevima: n = 2, l = 1, ml = -1, ms = +1/2.







![I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL. KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI 9
ODRE─ÉIVANJE PERIODE I GRUPE NA OSNOVU ELEKTRONSKE KONFIGURACIJE
Polo┼Šaj u PSE (perioda i grupa) odre─Äuje se samo za atome elemenata!
Prvo odredi blok kojem element pripada, a zatim primeni odgovaraju─će pravilo!
s ŌĆō blok (A grupe) p ŌĆō blok (A grupe)
(IA / alkalni, IIA / zemnoalkalni metali): nsŌēż2
(osim 1s2 ŌĆō He)
Grupa: broj elektrona iz s orbitale.
Perioda je odre─Äena poslednjim energetskim nivoom ŌĆō n.
ŌĆó 19X 1s2 2s2 2p6 3s2 3p6 4s1 IA -grupa
4 (N) perioda
ŌĆó 20X 1s2 2s2 2p6 3s2 3p6 4s2
IIA -grupa
4 (N) perioda
ŌĆó 11X 1s2 2s2 2p6 3s1
IA -grupa
3 (M) perioda
Plemeniti gasovi : 1s2 ŌĆō He
ns2 np6 Ne, Ar;
ns2 (n-1)d10 np6 ŌĆō Kr, Xe, Rn
VIIIA /18/0: sabiraju se elektroni iz s i p orbitala istog nivoa.
Perioda je odre─Äena poslednjim energetskim nivoom ŌĆō n.
(IIIA, IVA, VA, VIA / halkogeni, VIIA / halogeni elementi):
ns2 np<6
ns2 (n-1)d10 np< 6
Grupa: broj elektrona iz s i p orbitale najvi┼Īeg nivoa.
Perioda je odre─Äena poslednjim energetskim nivoom ŌĆō n.
ŌĆó 2He 1s2
ŌĆó 10Ne 1s2 2s2 2p6
ŌĆó 18Ar 1s2 2s2 2p6 3s2 3p6
ŌĆó 36Kr [Ar] 4s2 3d10 4p6
ŌĆó 54Xn [Kr] 5s2 4d10 5p6
VIIIA/0/18; 1 perioda
2 perioda
3 perioda
4 perioda
5 perioda
ŌĆó 15P 1s2 2s2 2p6 3s2 3p3
ŌĆó 9F 1s2 2s2 2p5
ŌĆó 35Br [Ar] 4s2 3d10 4p5
VIIA/17; 2 perioda
VIIA/17; 4 perioda
VA/15; 3 perioda
Najstabilnije el. konfiguracije u PSE!
Zadaci CZ:
5, 6, 7, 9, 10,
11, 14, 25.
Najizra┼Šenija metalna svojstva
pokazuju elementi IA grupe (alkalni),
a zatim IIA grupe (zemnoalkalni).
Najizra┼Šenija nemetalna svojstva
pokazuju elementi VIIA grupe
(halogeni), a zatim VIA grupe
(halkogeni).
Elementi koji se nalaze unutar iste grupe imaju najsli─Źnije osobine!!!](https://image.slidesharecdn.com/1-221115101256-b25ca7fb/85/1-Struktura-atoma-i-PSE-pdf-9-320.jpg)

![I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL.
KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI
11
Elektronska konfiguracija jona
Primer : Odrediti polo┼Šaj u PSE (periodu i grupu) elementa X, ako njegov jon X3- ima elektronsku konfiguraciju 1s2 2s2 2p6 3s2 3p6.
Pozicija u PSE mo┼Še da se odredi samo za neutralni atom. Preko broja elektrona u jonu, moramo da shvatimo koliko ima elektrona u atomu i tek onda
da odredimo periodu i grupu.
X3- 1s2 2s2 2p6 3s2 3p6 ; X3- jon sadr┼Ši 18 elektrona. Po┼Īto je jon tri puta negativno naelektrisan, jon X3- u odnosu na atom X ima 3 elektrona vi┼Īka,
┼Īto ukazuje da je broj protona u atomu X = 15, a ujedno to je i broj elektrona u neutralnom atomu.
X 1s2 2s2 2p6 3s2 3p3 VA grupa i tre─ća perioda; broj protona je 15, a ujedno to je i redni broj.
Zadaci za ve┼Šbanje:
1. Jon Y2+ ima elektronsku konfiguraciju argona. Odrediti periodu, grupu i redni broj elementa Y.
2. Neki element N se nalazi u drugoj periodi i VIA grupi. Napisati el. konfiguraciju njegovog najstabilnijeg jona.
3. Neki element M se nalazi u tre─ćoj periodi i IA grupi. Napisati el. konfiguraciju njegovog najstabilnijeg jona.
4. Ako je el. Konfiguracija jona X2- [Kr] 5s2 4d10 5p6 , odrediti periodu i grupu elementa X.
Zadaci CZ: 24](https://image.slidesharecdn.com/1-221115101256-b25ca7fb/85/1-Struktura-atoma-i-PSE-pdf-11-320.jpg)

![I OBLAST: STRUKTURA ATOMA, IZOTOPI, Ar, EL.
KONFIGURACIJA, ENERGIJA JONIZACIJE, KVANTNI BROJEVI
13
ENERGIJA JONIZACIJE (Ei)
Energija jonizacije predstavlja energiju koju je potrebno dovesti jednom atomu nekog elementa u gasovitom stanju da bi se iz njegovog poslednjeg nivoa
udaljio najslabije vezan elektron, pri ─Źemu nastaje jon. Ovaj proces se mo┼Še predstaviti: X(g) + Ei ŌåÆ X+
(g) + eŌĆō
Dovo─Äenjem prve energije jonizacije udaljava se jedan elektron, dok dovo─Äenjem slede─će ŌĆō druge Ei udaljava se slede─ći elekron,...
┼Āto je energija jonizacije ni┼Ša, to atom lak┼Īe otpu┼Īta elektron. Najve─ću mo─ć jonizacije imaju dakle oni elementi PSE koji imaju niske energije jonizacije ŌĆō IA
i IIA grupa. Ei u periodi raste, u grupi opada.
- 1 elektron, I Ei
- 1 elektron, I Ei
11Na 1s2 2s2 2p6 3s1
- 1 elektron, I Ei
11Na+ 1s2 2s2 2p6 [Ne]
3Li 1s2 2s1
3Li+ 1s2 [He]
19K 1s2 2s2 2p6 3s2 3p6 4s1
19K+ 1s2 2s2 2p6 3s2 3p6 [Ar]
20Ca 1s2 2s2 2p6 3s2 3p6 4s2
-2 elektrona
I i II Ei
20Ca2+ 1s2 2s2 2p6 3s2 3p6 [Ar]
13Al 1s2 2s2 2p6 3s2 3p1
13Al3+ 1s2 2s2 2p6 [Ne]
-3 elektrona
I, II i III Ei
U kojem od navedenih nizova energija jonizacije raste?
a) He, Ne, O, N, Mg, Na
b) F, Cl, O, Ne, Br, Na, Ar
c) K, Na, Mg, Al, O, Ar
d) H, Li, Na, K, Rb, Mg
Za odgovor na ovo pitanje neophodno je znati poziciju
elemenata u PSE napamet!
Zadaci CZ: 4, 19, 20, 26](https://image.slidesharecdn.com/1-221115101256-b25ca7fb/85/1-Struktura-atoma-i-PSE-pdf-13-320.jpg)



















































