3. enzim
- 1. Enzim
- 2. Cakupan: ? Definisi umum ? Bagian penting dari enzim ? Bagaimana enzim bekerja ? Hubungan enzim ? substrat ? Hubungan enzim ? inhibitor ? Faktor-faktor yang mempengaruhi kerja enzim ? Kinetika enzim
- 3. Definisi Umum Dlm sistem biologi ? reaksi kimia selalu memerlukan katalis. Tanpa katalis ? sangat lama ˇú diperlukan ? Enzim yg berfungsi sbg biokatalisator ENZIM = protein yang berfungsi untuk mempercepat reaksi dengan jalan menurunkan tenaga aktivasi dan tidak mengubah kesetimbangan reaksi, serta bersifat sangat spesifik.
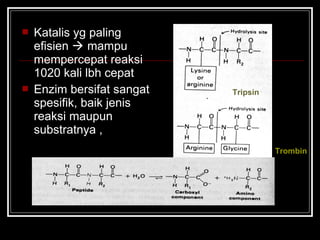
- 5. ? Katalis yg paling efisien ? mampu mempercepat reaksi 1020 kali lbh cepat ? Enzim bersifat sangat spesifik, baik jenis reaksi maupun substratnya , Tripsin Trombin
- 6. ? Enzim tidak ikut bereaksi dgn substrat atau produknya ? Aktifitas dapat dikontrol sesuai dengan kebutuhan organisme itu sendiri Contoh : enzim yg mengkatalisis reaksi pertama pada suatu siklus biosintesis biasanya di hambat oleh produk akhirnya(feedback inhibition) ? Beberapa enzim disintesis dlm btk tidak aktif. Dan akan diaktifkan oleh kondisi dan waktu yang sesuai (enzim allosterik) . prekursor yg tidak aktif disebut ? zymogen
- 7. Tiga sifat utama enzim : ? Kemampuan katalitiknya ? Spesifisitas ? Kemampuan untuk diatur (regulasi)
- 8. Bagian-bagian enzim Holoenzim Apoenzim/ apoprotein Gugus prostetik Koenzim Kofaktor
- 9. Bagian-bagian enzim (lanjutan) ? Seperti halnya protein lain, enzim memiliki BM antara 12,000 ¨C 1 juta kd ? Beberapa enzim tidak membutuhkan molekul kimiawi lain untuk aktifitasnya, beberapa membutuhkan ? kofaktor / koenzim ? Kofaktor ? ion-ion anorganik yg dibutuhkan enzim untuk melakukan fungsinya ? Koenzim ? molekul organik (komplek) yang dibutuhkan enziim untuk melakukan fungsinya
- 12. ? Gugus prostetik = Koenzim atau kofaktor yang terikat sangat kuat bahkan terikat dengan ikatan kovalen dengan enzim ? ? Holoenzim = Enzim aktif lengkap dengan semua komponennya ? Apoenzim / apoprotein = Bagian yang terdiri dari protein saja pada suatu enzim ? Fungsi koenzim adalah sebagai karier sementara dari gugus fungsional yg berperan dalam reaksi enzimatis
- 13. Klasifikasi enzim ? 1. Oksido reduktase Pemindahan elektron ? 2.Transferase Pemindahan ggs fungsional ? 3.Hidrolase Reaksi hidrolisis(pemindahan ggs fungsional ke air) ? 4. Liase Pemindahan ggs ke ikatan ganda ? 5. Isomerase Pemindahan ggs di dalam mo lekul menghasilkan isomer ? 6. Ligase Pembentukan ikatan C-C, C- S C-O dan C-N
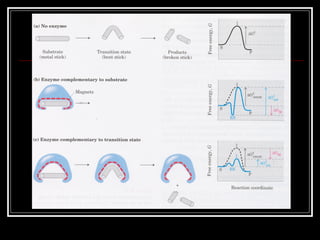
- 14. Bagaimana enzim bekerja ? Reaksi tanpa enzim: ? Lambat ? Membutuhkan suhu yang tinggi ? Tekanan yang tinggi ? Reaksi enzimatis ? Enzim memberikan suatu lingkungan yg spesifik di dalam sisi aktifnya, sehingga reaksi secara energetik dapat lebih mudah terjadi
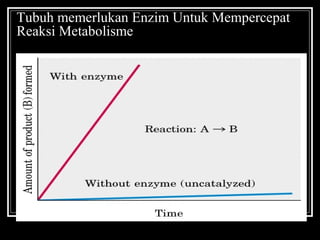
- 15. Tubuh memerlukan Enzim Untuk Mempercepat Reaksi Metabolisme
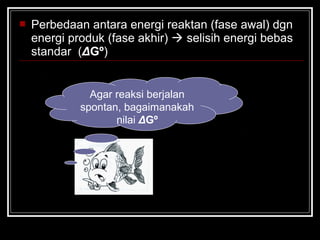
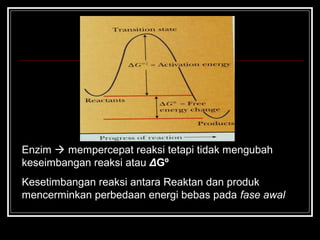
- 16. ? Perbedaan antara energi reaktan (fase awal) dgn energi produk (fase akhir) ? selisih energi bebas standar (¦¤G?) Agar reaksi berjalan spontan, bagaimanakah nilai ¦¤G?
- 17. Enzim ? mempercepat reaksi tetapi tidak mengubah keseimbangan reaksi atau ¦¤G? Kesetimbangan reaksi antara Reaktan dan produk mencerminkan perbedaan energi bebas pada fase awal
- 18. Kecepatan reaksi tergantung energi aktifasi ¦¤G?ˇŮ ? suatu pasokan energi dibutuhkan untuk mengawali suatu reaksi Energi aktifasi untuk reaksi yg dikatalis dengan ensim lebih rendah dr reaksi tanpa ensim Glukosa + 6 O2 ? 6 CO2 + 6 H2O ¦¤G? = -2880 kJ/mol
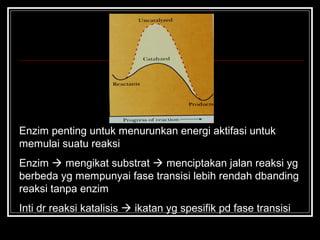
- 19. Enzim penting untuk menurunkan energi aktifasi untuk memulai suatu reaksi Enzim ? mengikat substrat ? menciptakan jalan reaksi yg berbeda yg mempunyai fase transisi lebih rendah dbanding reaksi tanpa enzim Inti dr reaksi katalisis ? ikatan yg spesifik pd fase transisi
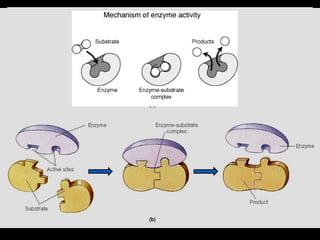
- 20. ? Substrat terikat ? interaksi nonkovalen E + S ? ES ? EP ? E + P ? Kekuatan enzim dlm mengkatalisis suatu reaksi ? kemampuan enzim membawa substrat bersama-sama pd orientasi yang tepat untuk terjadinya suatu reaksi ? Substrat terikat pd ? sisi aktif yi cekukan pd protein yg berisi asam amino yg penting untuk terjadinya suatu reaksi kimia
- 22. Karakteristik sisi aktif enzim ? merupakan bagian kecil dari enzim (Mengapa enzim harus memiliki ukuran besar?) ? sisi aktif merupakan suatu cekukan yang bersifat 3 dimensi. ? memberikan linkungan mikro yg sesuai utk terjadinya suatu reaksi kimia ? substrat terikat pada sisi aktif dengan interaksi / ikatan yang lemah. ? Spesifitas enzim dipengaruhi oleh asam amino yg menyusun sisi aktif suatu enzim
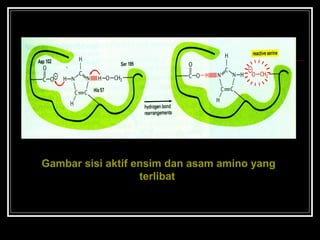
- 23. Gambar sisi aktif ensim dan asam amino yang terlibat
- 24. ? Sisi aktif mempunyai 2 bagian yg penting: ? Bagian yang mengenal substrat dan kemudian mengikatnya ? Bagian yang mengkatalisis reaksi, setelah substrat diikat oleh enzim ? Asam amino yang membentuk kedua bagian tersebut tidak harus berdekatan dalam urutan secara linear, tetapi dalam konformasi 3D mereka berdekatan
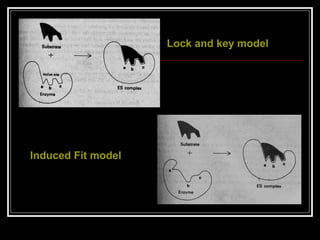
- 25. Teori untuk menjelaskan kerja enzim: ? Lock and Key analogy Enzim memiliki struktur sisi spesifik yang cocok dengan substrat. Mampu menerangkan spesifitas ensim ttp tidak dapat menerangkan stabilitas fase transisi ensim ? Induced Fit theory mempertimbangkan fleksibilitas protein, sehingga pengikatan suatu substrat pada enzim menyebabkan sisi aktif mengubah konformasinya sehingga cocok dgn substratnya. ? dpt menerangkan fase transisi ES komplek
- 26. Lock and key model Induced Fit model
- 27. Faktor-faktor yg mempengaruhi kerja enzim ? pH ? setiap enzim mempunyai pH optimum utk bekerja. contoh : pepsin ? pH 2, amylase ? pH 7.0 ? Temperatur ? setiap kenaikan suhu 10?C (sampai 40?C), kecepatan reaksi naik 2 x lipatnya dan reaksi terhambat dan berhenti pada 60?C. Mengapa? ? [S] dan atau [E]
- 28. Kinetika Reaksi Enzimatis E + S ES E + P K1 K2 K-1 K1 : konstanta pembentukan ES komplek K2 : konstanta konfersi ES komplek ke P K-1 : konstanta konstan pemecahan ES komplek ke E bebas Enzim sangat efisien dalam mengkatalis suatu reaksi, steady state (keseimbangan reaksi) segera dapat tercapai apabila : Kecepatan pembentukan ES komplek sama dengan kecepatan pemecahannya
- 29. K-1 + K2 = Km ? konstanta Michaelis K2 Vmax [S] V = ? Persamaan Michaelis-Menten Km + [S]
- 30. ? Ketika kondisi diatur sehingga [S] = Km maka Vmax [S] V = dan V = Vmax / 2 ? [S] + [S]
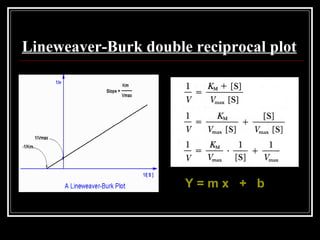
- 31. Lineweaver-Burk double reciprocal plot Y = m x + b
- 32. Penghambatan Reaksi Enzimatis ? Kerja enzim dapat dihambat secara reversible atau irreversible ? Irreversible ? pembentukan atau pemecahan ikatan kovalen dalam enzim ? Reversible ? suatu senyawa dapat terikat dan kemudian dpt lepas kembali Reversible inhibitor ini dpt dibagi : ? competitive ? non-competitive ? un-competitive
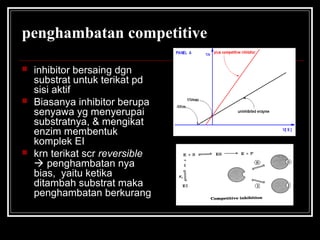
- 33. penghambatan competitive ? inhibitor bersaing dgn substrat untuk terikat pd sisi aktif ? Biasanya inhibitor berupa senyawa yg menyerupai substratnya, & mengikat enzim membentuk komplek EI ? krn terikat scr reversible ? penghambatan nya bias, yaitu ketika ditambah substrat maka penghambatan berkurang
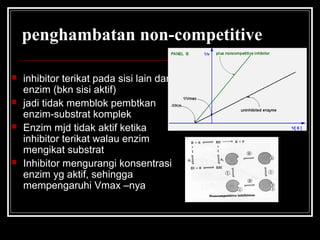
- 34. penghambatan non-competitive ? inhibitor terikat pada sisi lain dari enzim (bkn sisi aktif) ? jadi tidak memblok pembtkan enzim-substrat komplek ? Enzim mjd tidak aktif ketika inhibitor terikat walau enzim mengikat substrat ? Inhibitor mengurangi konsentrasi enzim yg aktif, sehingga mempengaruhi Vmax ¨Cnya
- 35. Penghambatan un-competitive ? Terikat pd sisi selain sisi aktif enzim ? Berbeda dgn non- competitive ? inhibitor ini hanya terikat pd ES komplek ? Sehingga tidak terikat pd enzim bebas ? Vmax berubah, dan Km juga berubah
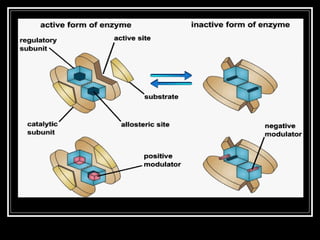
- 36. Enzim allosterik ? Enzim allosterik mengalami perubahan konformasi ? sebagai respon terhadap pengikatan modulator efektor ? Enzim Allosterik biasanya lebih komplek dari enzim nonalostrerik, enzim allosterik , memiliki sub unit lebih dari satu ? Memiliki satu atau lebih sisi allosterik / regulator untuk mengikat modulator. ? Seperti halnya substrat, setiap regulator memiliki sisi pengikatan yang berbeda ? Untuk enzim homotropik ? sisi aktif dan sisi regulator sama
- 38. ? Aktivitas spesifik = jumlah produk yang dihasilkan oleh suatu enzim pada waktu dan kondisi tertentu per milligram enzim ? Kecepatan reaksi = konsentrasi hilangnya substrat (atau produk yg dihasilkan) per unit waktu (mol L ? 1s ? 1) ? Aktivitas enzim = mol yg dirubah per unit waktu (kecepatan x volume reaksi) ? Aktivitas enzim merupakan pengukuran jumlah enzim yang ada ? Unit SI = katal, 1 katal = 1 mol s-1 ? unit yg sangat besar ? 1 unit enzim = 1 enzyme unit (EU) = 1 ¦Ěmol min-1 (¦Ě = micro, x 10-6).
- 39. ? Aktivitas spesifik = mol yang dirubah per unit waktu massa enzim ( akrivitas enzim/massa aktual enzim yg ada). Unit SI = katal kg-1,ˇú unit yg lebih praktis = ¦Ěmol mg-1 min-1 ? Aktivitas spesifik = ukuran efisiensi enzim, biasanya konstan untuk enzim murni ? Jika aktivitas spesifik 100 % enzim murni diketahui, kemurnian dapat dihitung ? Jika % kemurnian adalah 100 % (aktivitas spesifik sampel enzim/aktivitas spesifik enzim murni). Sampel yang tidak murni memiliki aktifitas spesifik yg lebih rendah ? beberapa kandungannya bukan merupakan enzim /pengotoran
- 40. Peranan Enzim ? 1. Penyelidikan reaksi-reaksi metabolik dan pengaturannya ? 2. Sebagai katalisator dalam industri yg mensintesis hormon/antibiotik ? 3. Membantu dlm menegakkan diagnosa krn kadar enzim pd keadaan patologik tertentu dpt mengalami perub yg nyata dlm darah ataupun jaringan, penyakit genetik (endonuklease retriksi) *. 4. Dalam pengolahan pangan, pertanian, peternakan dan pd akv. Sehari-hari dirumah
- 41. Pembagian Enzim berdasarkan lokasinya ? Enzim plasma fungsional: Enzim atau proenzim tertentu terdapat sepanjang waktu dlm sirkulasi individu normal, substrat juga terdapat dlm sirkulasi dan melakukan fungsi fisiologis dlm darah Contoh: Lipoprotein lipase, pseudokolinesterse, proenzim bekuan darah dan lisis bekuan darah umumnya disintesis dlm hati, konsentrasi dlm darah sama atau lebih tinggi dibandingkan dlm jaringan
- 42. Enzim plasma non fungsional: ? Tidak melakukan fungsi fisiologis dlm darah ? Substrat sering tdk ada dlm plasma ? Konsentrasi dlm darah individu normal berjutakali lebih rendah dibanding dlm jaringan
- 43. LOKASI ENZIM ? Dalam sel hati: Enzim-enzim glikolisisˇú sitoplasma ? Enzim-enzim siklus asam sitrat ˇú mitokondria, sel pankreas, lambung dan saliva ? Isozim : enzim yg mengkatalisa reaksi yg sama tetapi sifat fisika dan kimia protein menunjukkan perbedaan yg bermakna

















![Faktor-faktor yg mempengaruhi kerja
enzim
? pH ? setiap enzim mempunyai pH optimum utk
bekerja.
contoh : pepsin ? pH 2, amylase ? pH 7.0
? Temperatur ? setiap kenaikan suhu 10?C
(sampai 40?C), kecepatan reaksi naik 2 x lipatnya
dan reaksi terhambat dan berhenti pada 60?C.
Mengapa?
? [S] dan atau [E]](https://image.slidesharecdn.com/3-enzim-130502203713-phpapp02/85/3-enzim-27-320.jpg)

![K-1 + K2
= Km ? konstanta Michaelis
K2
Vmax [S]
V = ? Persamaan Michaelis-Menten
Km + [S]](https://image.slidesharecdn.com/3-enzim-130502203713-phpapp02/85/3-enzim-29-320.jpg)
![? Ketika kondisi diatur sehingga [S] = Km maka
Vmax [S]
V = dan V = Vmax / 2
? [S] + [S]](https://image.slidesharecdn.com/3-enzim-130502203713-phpapp02/85/3-enzim-30-320.jpg)