Analisa Kation dan Anion
- 1. ANALISIS KATION DAN ANION Analisis kualitatif: ŌĆóMetode Instrumental ŌĆóMetode kimia klasik Dasar identifikasi suatu unsur: sifat kimia dan fisika unsur tersebut (warna, reaksinya dengan reagen-reagen tertentu, hasil reaksinya :larutan, endapan, gas).
- 2. ANALISIS KATION DAN ANION Analisis kualitatif: ŌĆóMetode Instrumental ŌĆóMetode kimia klasik Dasar identifikasi suatu unsur: sifat kimia dan fisika unsur tersebut (warna, reaksinya dengan reagen-reagen tertentu, hasil reaksinya :larutan, endapan, gas).
- 3. ŌĆóSuatu analisis dikelompokkan menjadi: 1. Tes pendahuluan 2. Penentuan ion-ion logam (kation) dalam larutan 3. Penentuan anion dalam larutan ŌĆó Zat-zat yang dianalisis kemungkinan: padatan non metalik, larutan, metal/alloy, ataupun zat yang tidak larut.
- 4. Pemeriksaan Pendahuluan ŌĆóSecara organoleptis: amati sifat-sifat fisik zat tersebut ŌĆóBentuk : padat (amorf atau kristalin), atau larutan. ŌĆóWarna : padatan: Merah :Pb3O4, HgO, Sb2S3, Kuning: CdS, As2S3, PbI2, Biru : garam-garam kobalt(Co2+ ) anhidrat, garam-garam tembaga (Cu2+ )terhidrat.......................dll Tabel 1. Beberapa warna ion dalam pelarut air ion warna ion warna Cu 2+ biru CrO42- kuning Ni2+ hijau Cr2O72- Merah-jingga Fe2+ hijau MnO4- ungu Cr3+ hijau Mn2+ Merah jambu
- 5. ŌĆóPemeriksaan pendahuluan untuk kation: 1. Pemanasan dalam tabung pemijaran Untuk bahan-bahan yang mudah terurai, peristiwa yang dapat diamati: perubahan warna, pelelehan, sublimasi, terjadi uap air, atau gas. Pengamatan Kesimpulan Kuning ketika panas, kuning ketika dingin PbO dan beberapa garam Pb Kuning ketika panas, putih ketika dingin ZnO dan garam-garam Zn Terbentuk sublimat hitam-biru, uap lembayung I Sublimat abu-abu, mudah digosok menjadi butir- Hg butir bulat
- 6. 2. Reaksi nyala: Bahan dibasahi HCl pekat, diambil sedikit dengan kawat platina, dipanaskan di nyala oksidasi atas. Warna diamati. (Sebelumnya kawat platina dipijarkan sampai tidak mewarnai api) Warna nyala kation kuning Na Hijau kuning Ba Kuning merah Ca Hijau kebiruan Cu 3. Mutiara boraks: ujung kawat platina dipijarkan sampai merah lalu dimasukkan ke dalam boraks halus, dipanaskan sampai terbentuk butiran transparan.butiran ini disentuhkan pada analat, lalu dipanaskan dalam api oksidasi dan dalam api reduksi.warna diamati pada saat mutiara boraks panas dan setelah dingin.
- 7. Nyala oksidasi Nyala reduksi logam Coklat kekuningan atau merah Hijau ketika panas dan dingin Fe ketika panas, kuning ketika dingin Biru ketika panas dan dingin Biru ketika panas dan dingin Kobalt Kuning tua ketika panas, hijau Hijau ketika panas dan dingin kromium ketika dingin Lembayung ketika panas dan Tak berwarna ketika panas Mangan dingin dan dingin ŌĆóAnalisis kualitatif melibatkan beberapa reaksi kimia, seperti reaksi asam basa, redoks, kompleks dan pengendapan.
- 8. ANALISA KATION ’é¦Untuk tujuan analisis kualitatif, kation diklasifikasikan dalam 5 golongan berdasarkan sifat-sifat kation terhadap beberapa reagensia. ’é¦Reagensia golongan untuk klasifikasi kation yang paling umum: HCl, H2S, amonium sulfida, dan amonium karbonat, berdasarkan atas apakah suatu kation bereaksi dengan reagensia ini dan membentuk endapan ’é¦Jadi, klasifikasi kation yang paling umum didasarkan atas perbedaan kelarutan dari klorida, sulfida, dan karbonat dari kation tersebut.
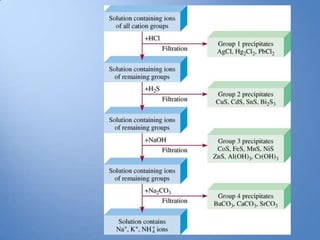
- 9. Kelompok Kation Analisis Kualitatif Golongan Kation Pereaksi Pengendap 1 Pb2+, Hg+, Ag+ HCl encer 2 Hg2+, Cu2+, Bi2+, Cd2+, As5+, H2S dalam asam mineral Sb3+, Sb5+, Sn2+, Sn4+ encer 3 Co2+, Ni2+, Fe2+, Fe3+, Cr3+, Amonium sulfida dalam Al3+, Zn2+, Mn2+ suasana netral atau amoniakal 4 Ca2+, Mg2+ , Sr2+ Amonium karbonat dengan adanya amonium klorida dalam suasana netral atau sedikit asam 5 Na+, K+, NH4+ , Mg2+
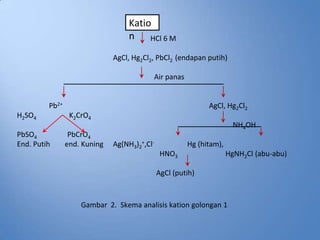
- 11. Katio n HCl 6 M AgCl, Hg2Cl2, PbCl2 (endapan putih) Air panas Pb2+ AgCl, Hg2Cl2 H2SO4 K2CrO4 NH4OH PbSO4 PbCrO4 End. Putih end. Kuning Ag(NH3)2+,Cl- Hg (hitam), HNO3 HgNH2Cl (abu-abu) AgCl (putih) Gambar 2. Skema analisis kation golongan 1
- 12. Catatan: ŌĆóJika tidak terbentuk endapan dengan HCl, dapat dipastikan tidak terdapat ion Ag+ dan Hg22+ , tetapi ion Pb masih mungkin ada karena ion Pb masih mungkin larut. ŌĆóKelarutan PbSO4 = 1,3.10-8 sedangkan PbCrO4 adalah 2.10-16 pada 20┬░C, sehingga PbCrO4 memberikan tes yang lebih sensitif untuk Pb
- 13. ŌĆóSuatu analisis dikelompokkan menjadi: 1. Tes pendahuluan 2. Penentuan ion-ion logam (kation) dalam larutan 3. Penentuan anion dalam larutan ŌĆó Zat-zat yang dianalisis kemungkinan: padatan non metalik, larutan, metal/alloy, ataupun zat yang tidak larut.
- 14. Pemeriksaan Pendahuluan ŌĆóSecara organoleptis: amati sifat-sifat fisik zat tersebut ŌĆóBentuk : padat (amorf atau kristalin), atau larutan. ŌĆóWarna : padatan: Merah :Pb3O4, HgO, Sb2S3, Kuning: CdS, As2S3, PbI2, Biru : garam-garam kobalt(Co2+ ) anhidrat, garam-garam tembaga (Cu2+ )terhidrat.......................dll Tabel 1. Beberapa warna ion dalam pelarut air ion warna ion warna Cu 2+ biru CrO42- kuning Ni2+ hijau Cr2O72- Merah-jingga Fe2+ hijau MnO4- ungu Cr3+ hijau Mn2+ Merah jambu
- 15. ŌĆóPemeriksaan pendahuluan untuk kation: 1. Pemanasan dalam tabung pemijaran Untuk bahan-bahan yang mudah terurai, peristiwa yang dapat diamati: perubahan warna, pelelehan, sublimasi, terjadi uap air, atau gas. Pengamatan Kesimpulan Kuning ketika panas, kuning ketika dingin PbO dan beberapa garam Pb Kuning ketika panas, putih ketika dingin ZnO dan garam-garam Zn Terbentuk sublimat hitam-biru, uap lembayung I Sublimat abu-abu, mudah digosok menjadi butir- Hg butir bulat
- 16. 2. Reaksi nyala: Bahan dibasahi HCl pekat, diambil sedikit dengan kawat platina, dipanaskan di nyala oksidasi atas. Warna diamati. (Sebelumnya kawat platina dipijarkan sampai tidak mewarnai api) Warna nyala kation kuning Na Hijau kuning Ba Kuning merah Ca Hijau kebiruan Cu 3. Mutiara boraks: ujung kawat platina dipijarkan sampai merah lalu dimasukkan ke dalam boraks halus, dipanaskan sampai terbentuk butiran transparan.butiran ini disentuhkan pada analat, lalu dipanaskan dalam api oksidasi dan dalam api reduksi.warna diamati pada saat mutiara boraks panas dan setelah dingin.
- 17. Nyala oksidasi Nyala reduksi logam Coklat kekuningan atau merah Hijau ketika panas dan dingin Fe ketika panas, kuning ketika dingin Biru ketika panas dan dingin Biru ketika panas dan dingin Kobalt Kuning tua ketika panas, hijau Hijau ketika panas dan dingin kromium ketika dingin Lembayung ketika panas dan Tak berwarna ketika panas Mangan dingin dan dingin ŌĆóAnalisis kualitatif melibatkan beberapa reaksi kimia, seperti reaksi asam basa, redoks, kompleks dan pengendapan.
- 18. ANALISA KATION ’é¦Untuk tujuan analisis kualitatif, kation diklasifikasikan dalam 5 golongan berdasarkan sifat-sifat kation terhadap beberapa reagensia. ’é¦Reagensia golongan untuk klasifikasi kation yang paling umum: HCl, H2S, amonium sulfida, dan amonium karbonat, berdasarkan atas apakah suatu kation bereaksi dengan reagensia ini dan membentuk endapan ’é¦Jadi, klasifikasi kation yang paling umum didasarkan atas perbedaan kelarutan dari klorida, sulfida, dan karbonat dari kation tersebut.
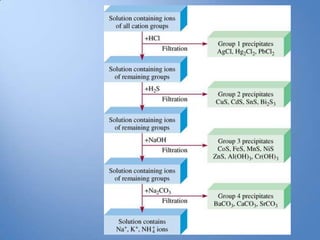
- 19. Kelompok Kation Analisis Kualitatif Golongan Kation Pereaksi Pengendap 1 Pb2+, Hg+, Ag+ HCl encer 2 Hg2+, Cu2+, Bi2+, Cd2+, As5+, H2S dalam asam mineral Sb3+, Sb5+, Sn2+, Sn4+ encer 3 Co2+, Ni2+, Fe2+, Fe3+, Cr3+, Amonium sulfida dalam Al3+, Zn2+, Mn2+ suasana netral atau amoniakal 4 Ca2+, Mg2+ , Sr2+ Amonium karbonat dengan adanya amonium klorida dalam suasana netral atau sedikit asam 5 Na+, K+, NH4+ , Mg2+
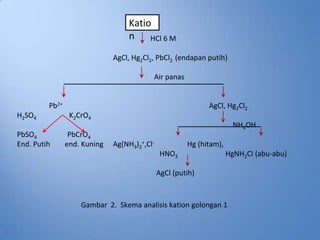
- 21. Katio n HCl 6 M AgCl, Hg2Cl2, PbCl2 (endapan putih) Air panas Pb2+ AgCl, Hg2Cl2 H2SO4 K2CrO4 NH4OH PbSO4 PbCrO4 End. Putih end. Kuning Ag(NH3)2+,Cl- Hg (hitam), HNO3 HgNH2Cl (abu-abu) AgCl (putih) Gambar 2. Skema analisis kation golongan 1
- 22. Catatan: ŌĆóJika tidak terbentuk endapan dengan HCl, dapat dipastikan tidak terdapat ion Ag+ dan Hg22+ , tetapi ion Pb masih mungkin ada karena ion Pb masih mungkin larut. ŌĆóKelarutan PbSO4 = 1,3.10-8 sedangkan PbCrO4 adalah 2.10-16 pada 20┬░C, sehingga PbCrO4 memberikan tes yang lebih sensitif untuk Pb