Anû lisi espectroscûýpic
- 1. Anû lisi espectroscûýpic Determinaciû° de lãestructura de les molû´cules Consuelo Batalla GarcûÙa INS Valldemosa Barcelona
- 2. ûndex ã Anû lisi espectroscûýpic ã Lãespectre electromagnû´tic ã Anû lisi per espectroscûýpia infraroja (IR) ã Ressonû ncia magnû´tica nuclear (RMN) ã Espectrometria de masses (EM) ã Espectroscûýpia ultraviolada (UV) ã Exercicis ã VûÙdeos ã Bibliografia ã EnllaûÏos web
- 3. Anû lisi espectroscûýpic ã Sãutilitza per determinar lãestructura dãun compost quûÙmic. ã Sû°n tû´cniques no destructives que requereixen molt poca quantitat de substû ncia. ã En general, en una tû´cnica espectroscûýpica: o Sãirradia una mostra amb una font de llum. o Es mesura la quantitat de llum transmesa a diferents longituds dãona, utilitzant un detector. o Els resultats obtinguts es registren en un grû fic.
- 4. Lãespectre electromagnû´tic Lãespectre electromagnû´tic ûˋs la representaciû° dels diferents tipus dãenergia de radiaciû° i les seves corresponents longituds dãona.
- 5. ã Quan una molû´cula absorbeix energia electromagnû´tica, pateix algun tipus d'excitaciû°. ã El tipus dãexcitaciû° depû´n del tipus de radiaciû° electromagnû´tica que se li apliqui, fenomen en el qual es basa l'espectroscûýpia electromagnû´tica. ã Cada detall estructural de la molû´cula tûˋ assignada una energia d'absorciû° diferent i diferenciada ja que cada û tom tûˋ una massa determinada i cada enllaûÏ tûˋ una forûÏa i un disseny propi. ã Les diferents combinacions de masses i forces dãenllaûÏ provoquen vibracions a diferents freqû¥û´ncies i diferents absorcions. ã A partir dels grû fics i de les diferents bandes dãabsorciû° sãaconsegueix fer una definiciû° mûˋs o menys precisa de la molû´cula estudiada. ã Les diferents tû´cniques espectroscûýpiques sû°n una poderosa eina per a la determinaciû° dãestructures. Aquestes tû´cniques sû°n complementû ries i sû°n mûˋs poderoses quan sãutilitzen de forma conjunta.
- 6. Tipus de radiaciû° Longitud dãona Energia Tipus dãexcitaciû° Raigs Gamma, Raig X Raigs cûýsmics < 100 nm >286 kcal Poden produir la ionitzaciû° de la molû´cula i fins i tot produir modificacions nuclears. Ultraviolada 100 nm-350 nm 286 kcal-82 kcal Electrûýnica Visible 350 nm- 800 nm 82 kcal- 36 kcal Electrûýnica Infraroig prûýxim 0ã8ôçm -2 ôçm 36 kcal-14ã3 kcal Harmûýnics de deformacions de lãenllaûÏ Infraroig mitjû 2ôçm -16ôçm 14ã4 kcal-1ã8 kcal Deformacions de lãenllaûÏ Infraroig llunyû 16ôçm -300ôçm 1ã8 kcal- 0ã1 kcal Deformacions de lãenllaûÏ Microones 1 cm 10-4 kcal Rotacional Ones de radio metres 10-6 kcal Transicions de spin nuclear i electrûýnic
- 7. Anû lisi per espectroscûýpia infraroja (IR) ã Es deu a les vibracions dels enllaûÏos i proporciona informaciû° dels grups funcionals presents. ã Els fotons de llum infraroja, de longituds dãona compreses entre 8 ôñ 10-5 cm i 1 ôñ 10-2 cm (energies entre 4,6 i 46 kJ ôñ mol-1) no tenen suficient energia per produir transicions electrûýniques, perûý poden fer que grups dãû toms vibrin respecte als enllaûÏos que els connecten (veure http://es.wikipedia.org/wiki/Espectroscopia_infrarroja). ã La freqû¥û´ncia de vibraciû° depû´n de les masses dels û toms i de la rigidesa de dãenllaûÏ. Els û toms mûˋs pesats vibren mûˋs lentament que els mûˋs lleugers. ã En un grup dãenllaûÏos amb energia dãenllaûÏ similars, la freqû¥û´ncia disminueix en augmentar la massa atûýmica. ã Els enllaûÏos mûˋs forts generalment sû°n mûˋs rûÙgids per la qual cosa necessiten mûˋs forûÏa per allargar-se o comprimir-se. ã En un grup dãû toms amb massa similar, la freqû¥û´ncia augmenta en augmentar lãenergia dãenllaûÏ.
- 9. Veure mûˋs exemples: http://liceoagb.es/quimiorg/ir3.html
- 10. ã A lãeix horitzontal es representa el nombre dãona, , en cm-1, i una escala entre 4000 cm-1 i 500 cm-1. ã A lãeix vertical es representa el percentatge de llum, energia, absorbida o transmesa. ã Quan lãabsorciû° estû prûýxima al 0% vol dir que la molû´cula ûˋs transparent a les radiacions dãaquest nombre dãona. ã La regiû° compresa entre 800 cm-1 i 1400 cm-1, ûˋs difûÙcil dãinterpretar, ja que hi han molts pics. Aquesta zona sãanomena empremta digital de la molû´cula i ûˋs una part de lãespectre caracterûÙstica de cada molû´cula.
- 11. EnllaûÏ MûÙnim nombre dãona (cm-1) Nombre dãona mû xima (cm-1) Grup funcional C ã O 1000 1300 Alcohols i û´sters C ã N 1180 1360 Amina o amida C = C 1610 1680 Alquens C ãÀ C 2100 2260 Alquins C C 1500 1600 Anells aromû tics C = O 1650 1760 Aldehids, cetones, û cids, û´sters, amides O ã H 2500 3300 ûcids carboxûÙlics (banda molt ampla) C ã H 2850 3000 Alcans C ã H 3050 3150 Alquens C ã H 3000 3000 Anells aromû tics C ã H 3300 Alquins O ã H 3230 3550 H enllaûÏat en els alcohols N ã H 3300 3500 Amina o amida O ã H 3580 3670 OH lliure en alcohols C ãÀ N 2100 2260 Nitrils ãNO2 1515 1345 1560 1385 Nitroderivats Freqû¥û´ncia dãalguns grups funcionals
- 12. Espectrofotûýmetre Nicolet 510 FT-IR
- 13. Esquema del funcionament dãun espectrofotûýmetre dãIR ã El raig de referû´ncia tûˋ la mateixa intensitat que lãincident. ã La diferû´ncia entre la intensitat del raig de referû´ncia i del raig que es transmet mesura la quantitat de radiaciû° absorbida. ã La freqû¥û´ncia de la radiaciû° es varia automû tica i contûÙnuament amb el monocromador (utilitza prismes o xarxes de difracciû° que fan que nomûˋs entri una freqû¥û´ncia de llum cada vegada en el detector). ã El senyal del detector ûˋs proporcional a la intensitat de la llum entre els raigs, o feixos de referû´ncia i de mostra.
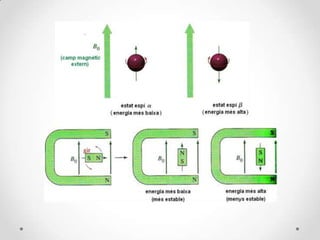
- 14. Ressonû ncia magnû´tica nuclear (RMN) ã ûs lãeina mûˋs potent per a la determinaciû° dãuna estructura orgû nica i proporciona molta informaciû° sobre lãestructura del compost. ã Sãutilitza per determinar nuclis, tals com els nuclis 1H, 13C, 15N, 19F i 31P. ã Els espectres informen detalladament del nû¤mero, la naturalesa i l'ambient que rodeja alguns elements claus de la molû´cula. Aquests elements, isûýtops, han de tenir un nû¤mero atûýmic o un nû¤mero mû ssic imparell, i per tant tenen un espûÙ nuclear. ã Per als quûÙmics orgû nics ûˋs molt û¤til la RMN de 1H o 13C (nosaltres ens centrarem en la ressonû ncia magnû´tica de protû°, 1H-RMN). ã El protû° es pot visualitzar girant com si fos una esfera de cû rrega positiva rotant sobre el seu eix, comportant-se com un corrent elû´ctric que genera un camp magnû´tic, portant associat un moment magnû´tic (ö¥). ã En absû´ncia de camp magnû´tic extern, els moments magnû´tics del protû° estan orientats a lãatzar, perûý quan sãaplica un camp magnû´tic extern (Bo), el moment magnû´tic del protû° sãalinea en la direcciû° del camp, en el mateix sentit (espûÙ öÝ) o en sentit contrari (espûÙ öý). La diferû´ncia dãenergia entre aquestes dues orientacions ûˋs proporcional a la forûÏa del camp magnû´tic extern: ãE = k ôñ Bo, on: k = hö° / 2ü ö°: raû° giromagnû´tica (constant per a un determinat nucli)
- 16. En un camp magnû´tic el protû° pot passar dãun nivell dãenergia a lãaltra per absorciû° o emissiû° dãuna quantitat dãenergia discreta: ãE = hö§ ö§: freqû¥û´ncia de la radiaciû° absorbida o emesa
- 17. ã Quan un nucli estû sotmû´s a una combinaciû° correcta de camp magnû´tic i radiaciû° electromagnû´tica per produir un canvi dãespûÙ, es diu que estû en ressonû ncia, per aixûý sãanomena RMN: (hö° / 2ü) ôñ Bo = hö§ ã Per als camps magnû´tics que sãutilitzen, les freqû¥û´ncies de ressonû ncia del protû° es troben en la regiû° de radiofreqû¥û´ncies de lãespectre electromagnû´tic. ã En RMN, la mostra es colôñloca en el camp magnû´tic d'un electroimant, el qual s'obtûˋ fent passar corrent elû´ctric per una bobina. ã Amb l'augment del camp magnû´tic els nuclis dels elements s'exciten i la transiciû° entre els nivells energû´tics queda enregistrada com a una variaciû° de voltatge. ã La representaciû° grû fica de la variaciû° de voltatge dû°na lloc a l'espectre, i origina els diferents pics. ã Cada pic, i el seu û rea, informa del nû¤mero total de nuclis que s'exciten. ã La mostra sempre ha d'estar en estat lûÙquid, si no ûˋs lûÙquida s'ha de dissoldre en un dissolvent lliure de protons, per tal que el dissolvent no afecti a lãespectre obtingut.
- 18. Esquema del funcionament dãun espectrûýmetre de RMN
- 19. ã Els espectres sû°n el resultat de l'absorciû° d'energia dels diferents isûýtops claus de la molû´cula. ã ûs possible deduir l'estructura perquû´ cada isûýtop clau, mai absorbeix la mateixa quantitat l'energia ni de la mateixa manera, degut a que els protons o altres isûýtops estan condicionats pels û toms que els envolten. ã Depenent de la posiciû° de l'isûýtop i de la quantitat dels isûýtops que li envolten, la variaciû° dãenergia ûˋs diferent.
- 20. ã En un espectrûýmetre de RMN, els protons es sotmeten a un camp magnû´tic extern, on sãalineen bûˋ en el sentit del camp o el contrari. ã A continuaciû° sãirradien amb una freqû¥û´ncia de rû dio que quan lãabsorbeixen, fa que els protons canviû₤n lãorientaciû° relativa del seu espûÙ nuclear respecte al camp extern. ã Els protons dãuna molû´cula amb diferents entorns, exposats a una radiofreqû¥û´ncia constant, absorbeixen la radiaciû° a intensitats de camp magnû´tic diferent. ã ûs difûÙcil mesurar amb precisiû° el camp absolut on un protû° absorbeix, per tant, per expressar els desplaûÏaments quûÙmics es determina el valor relatiu amb referû´ncia a una mostra patrû°. ã El compost de referû´ncia patrû° que mûˋs sãutilitza ûˋs el tetrametilsilû (TMS - (CH3)4Si), ja que tots els seus protons absorbeixen a la mateixa freqû¥û´ncia, la qual ûˋs molt alta i, gairebûˋ, no lãadquireix cap altre protû°. AixûÙ ûˋs un bon exemple amb qui contrastar els resultats obtinguts. ã Als espectres de RMN es representen els desplaûÏaments quûÙmics dels protons (öÇ) en parts per miliû° (ppm):
- 21. Valors aproximats de desplaûÏaments quûÙmics (Aquests valors depenen dels substituents que hi hagi al seu entorn) Tipus de Protû° Estructura DesplaûÏament QuûÙmic, ppm Ciclopropû C3H6 0.2 Primari R-CH3 0.9 Secundari R2-CH2 1.3 Terciari R3-C-H 1.5 VinûÙlic C=C-H 4.6-5.9 Acetilû´nic triple enllaûÏ, CãÀC-H 2-3 Aromû tic Ar-H 6-8.5 BenzûÙlic Ar-C-H 2.2-3 AlôñlûÙlic C=C-CH3 1.7 Fluorurs H-C-F 4-4.5 Clorurs H-C-Cl 3-4 Bromurs H-C-Br 2.5-4 Iodurs H-C-I 2-4 Alcohols H-C-OH 3.4-4 ûters H-C-OR 3.3-4 Esters RCOO-C-H 3.7-4.1 Esters H-C-COOR 2-2.2 ûcids H-C-COOH 2-2.6 Composts CarbonûÙlics H-C-C=O 2-2.7 AldehûÙdic R-(H-)C=O 9-10 HidroxûÙlic R-C-OH 1-5.5 Fenûýlic Ar-OH 4-12 Enûýlic C=C-OH 15-17 CarboxûÙlic RCOOH 10.5-12 AmûÙ RNH2 1-5
- 23. Espectrûýmetres de RMN Varian Gemini 200 Varian Mercury-400
- 24. Espectrometria de masses (EM) ã Serveix per identificar compostos desconeguts, conû´ixer la seva massa molecular i lãestructura de la molû´cula. ã Consisteix en bombardejar la mostra de la substû ncia a analitzar amb un feix d'electrons accelerats dãalta energia. ã El xoc dels electrons amb la mostra fa que les molû´cules sãionitzin i es fragmentin, tot depenent de la grandû ria de la molû´cula i de la seva estructura. Aquest procûˋs de fragmentaciû° condueix a una mescla dãions caracterûÙstics. ã Es formen fragments carregats i sense carregar, perûý a lãespectrûýmetre de masses nomûˋs es detecten fragments carregats. El catiû°-radical corresponent a la massa de la molû´cula original es coneix com a iû° molecular, M+. ã Una vegada produû₤da la ionitzaciû° i la fragmentaciû°, els ions sû°n separats per deflexiû° magnû´tica. Els ions sû°n atrets per la placa de lãaccelerador carregada negativament, la qual tûˋ un colôñlimador (orifici petit) per permetre que passin alguns dels ions. ã El fluix dãions entra en un tub de buit i amb una part corbada colôñlocada entre els pols dãun imant. ã Quan la partûÙcula carregada passa a travûˋs del camp magnû´tic, la seva trajectûýria es desvia en funciû° de la relaciû° cû rrega-massa, m/z (m/e en la nomenclatura antiga). La majoria dels ions tenen cû rrega +1, per tant la desviaciû° dependrû de la seva massa.
- 25. Esquema del funcionament dãun espectrûýmetre de masses
- 26. Espectre de masses del n-decû ã La informaciû° que proporciona ûˋs tabulada i lãespectre es representa com un grû fic de barres o com una taula dãabundû ncies relatives. ã El pic base ûˋs el pic mûˋs intens i facilita el coneixement de les proporcions relatives dels diferents ions o fragments.
- 27. Espectrûýmetre de masses Trace DSQ Thermo Finnigan
- 28. Espectroscûýpia ultraviolada (UV) ã Detecta les transicions electrûýniques dels sistemes conjugats i proporciona informaciû° sobre la grandû ria i lãestructura de la part conjugada de la molû´cula. ã Les freqû¥û´ncies UV corresponen a longituds dãona mûˋs curtes i a energies molt mûˋs altes que les dãIR. ã Quan els espectrofotûýmetres abasten la regiû° del visible sãanomenen espectrofotûýmetres UV-visible. ã Els sistemes conjugats normalment tenen orbitals vacants de baixa energia Les transicions electrûýniques cap a aquests orbitals es produeixen a absorcions caracterûÙstiques de la regiû° UV. ã Per mesurar lãespectre dãUV dãun compost, la mostra es dissol en un dissolvent (moltes vegades en etanol) lãabsorciû° del qual no superi 200 nm. La mostra dissolta es colôñloca en una celôñla de quars i part del dissolvent es colôñloca en una altra celôñla de referû´ncia. ã Lãespectrûýmetre dãUV opera comparant la quantitat de llum transmesa a travûˋs de la mostra amb la quantitat de llum del feix de referû´ncia. ã Els espectres dãUV-visible sû°n amplis i no aporten molts detalls, ûˋs per aquesta raû° que sãutilitzen molt poc.
- 29. Esquema del funcionament dãun espectrûýmetre UV
- 31. Exercicis 1.- Indiqueu i justifiqueu quines de les substû ncies quûÙmiques segû¥ents tindran mûˋs pics en els seus espectres dãinfraroig: CH4 Ne CH3CH2 CH2 CH2 CH2 CH2OH NH2 CH2COOH 2.- Dãun compost orgû nic tenim les dades segû¥ents: bon dissolvent orgû nic, Te = 34,6 ô¤C i fû°rmula empûÙrica C4H10O. Els estudis espectroscopis ens indiquen que la massa molar ûˋs 74 i que contûˋ un grup û´ter i radicals etil. De quin compost es tracta? 3.- En un compost orgû nic de temperatura dãebulliciû°, Te = -7,5 ô¤C, es detecta espectroscûýpicament la presû´ncia de nitrogen i que la seva massa molar ûˋs 31. De quin compost parlem? 4.- Dos grams dãun compost orgû nic es cremen i sãobtenen 4 g de CO2 y 1,64 grams dãaigua. Espectroscûýpicament es detecta la presû´ncia dãun grup carboxil i que la seva massa molar ûˋs 88. Indica quin dels segû¥ent compost ûˋs: a) ûcid butanoic. b) Acetaldehid. c) Acetona (propanona) d) ûcid acû´tic.
- 34. VûÙdeos 1.- Espectrometria dãabsorciû° a lãUV-visible: http://upcommons.upc.edu/video/handle/2099.2/1145 2.- Espectrofotometria dãIR: http://upcommons.upc.edu/video/handle/2099.2/3230 3.- Espectrometria de masses: http://www.youtube.com/watch?v=-xZilj_pgCM 4.- Cromatografia de gases / espectrometria de masses: http://tv.upc.edu/contenidos/cromatografia-de-gases-espectrometria-de-masas 5.- RMN de protû°: http://www.youtube.com/watch?v=uNM801B9Y84
- 35. Bibliografia 1.- Leroy G. Wade (2004) 5ôˆ Ediciû°n. QuûÙmica Orgû nica. Madrid: Pearson Educaciû°n S.A
- 36. EnllaûÏos web 1.- Interacciû° entre les radiacions electromagnû´tiques i la matû´ria: http://es.slideshare.net/joseangelb7/interaccioradiacionsamblamateria 2.- https://sites.google.com/a/xtec.cat/iesjoanmiro-fisicaiquimica/2n- batxillerat-quimica