Asid dan bes2
- 2. Asid • Asid ialah bhn kimia yg mengion di dlm air menghasilkan ion hidrogen • Cth : HCl → H+ + Cl- HNO3→ H+ + NO3 - • Asid hidroklorik ialah asid monoprotik (hasilkan 1 ion hidrogen) • Asid sulfurik ialah asid diprotik (2 ion hidrogen) H2SO4→ 2H+ + SO4 2-
- 3. Bes dan Alkali • Bes ialah bahan yg boleh mengion di dlm air menghasilkan ion hidroksida, OH- . • Contoh bes ialah hidroksida logam dan oksida logam • Bes yg boleh larut dlm air dikenali sbg alkali. • Cth : NaOH →Na+ + OH- NH3 + H2O NH4 + + OH-
- 4. SIFAT KIMIA ASID Asid + bes →→garam + air HCl + CuO → CuCl2 + H2O Asid + logam → garam + gas hidrogen HNO3 + Mg → Mg(NO3)2 + H2 Asid + logam karbonat → garam + air + karbon dioksida H2SO4 + CaCO3 → CaSO4 + H2O + CO2
- 5. Sifat - sifat asid • Asid mempunyai sifat2 fizik berikut : • Rasa masam • Menghakis • pH bawah dr 7 • Mengkonduksi elektrik • Sifat kimia asid • Bertindakbalas dgn logam reaktif menghasilkan garam dan gas hidrogen • Bertindakbalas dgn karbonat utk menghasilkan garam, air dan gas karbon dioksida
- 6. Sifat-sifat alkali • Sifat-sifat fizik • Rasa pahit dan licin • Bersifat menghakis • Tukar kertas litmus merah kpd biru • Nilai pH lebh dr 7 • Mengkonduksikan elektrik
- 7. SIFAT KIMIA ALKALI • Alkali + Asid → Garam + Air NaOH + HCl → NaCl + H2O • Alkali + ion Logam →Logam hidroksida tak terlarutkan OH- + Cu2+ → Cu(OH)2 • Alkali + garam ammonium →garam + air + gas ammonia NaOH + NH4Cl → NaCl + H2O + NH3
- 8. KEKUATAN ASID DAN ALKALI A) Skala pH Skala pH digunakan untuk menunjukkan darjah keasidan atau kealkalian sesuatu larutan akueus pH = - log [H3O+ ] pH kurang 7 – asid pH sama dengan 7 – neutral pH lebih drpd 7 – alkali
- 12. • Asid kuat ialah asid yang bercerai penuh dalam air menghasilkan ion hidrogen yang berkepekatan tinggi. • Asid lemah yang bercerai secara separa dalam air menghasilkan ion hidrogen yang berkepekatan RENDAH.
- 17. Kepekatan Asid dan Alkali • Kepekatan larutan merujuk kepada kuantiti bahan terlarut dalam isipadu larutan, biasanya 1dm3 . walaubagaimanapun, unit kepekatan yg biasa digunakan oleh ahli kimia ialah kemolaran (mol/dm3 ) atau kepekatan molar (M) Kepekatan = jisim bahan terlarut (g/dm3 ) isipadu larutan Kepekatan = bilangan mol bhn terlarut (mol/dm3 ) isipadu larutan Kemolaran ialah bilangan mol bahan terlarut yg hadir dalam 1dm3 larutan
- 18. Kepekatan Asid dan Alkali Cari (a)Kepekatan larutan dalam gram per dm3 apabila 36.5 g hidrogen klorida, Hcl dilarutakan dalm air untuk menghasilkan 500 cm3 larutan. (b)Kemolaran larutan yang mana dengan melarutkan 0.30 mol natrium hidroksida, NaOH dalam air suling untuk menghasilkan 250cm3 larutan
- 19. Kepekatan Asid dan Alkali • Kepekatan • (mol dm-3 ) Kemolaran (mol dm-3 ) x jisim molar
- 20. Kepekatan Asid dan Alkali 1. Kemolaran sebotol larutan asid nitrik, HNO3 ialah 2.0 mol dm-3 . apakah kepekatan larutan dalam g dm-3 ? 2. Seorang pelajar mengisikan 25cm3 larutan natrium hidroksida, NaOH dalam kelalang kon dengan menggunakan pipet . Kepekatan alkali ialah 1.5 mol dm-3. kira bilangan mol natrium hidroksida? 3. Asid fosforik pekat, H3PO4 ditambahkan perlahan- lahan ke dalam air untuk menghasilkan 5.0 dm3 larutan asid cair. 100 g asid fosforik, H3PO4 tulen hadir dalam larutan. Cari kepekatan asid, dalam g dm-3 .
- 21. Penyediaan Larutan Piawai • Ahli kimia perlu mengetahui kepekatan larutaan yang digunakan dengan tepat. • Sesuatu larutan yang kepekatannya diketahui dengan jitu disebut sebagai larutan piawai.
- 22. Penyediaan Larutan Piawai Contoh 1 mol dm-3 larutan natrium hidroksida Kira jisim natrium hidroksida yang diperlukan Timbang setepatnya 40 g natrium hidroksida Tambah air suling sehingga mencapai tanda kalibrasi Larutkan pepejal dengan sedikit air suling Pindahkan pepejal terlarut aalam kelalang volumetrik. Bilas bikar dengan air suling dan tambahkan air basuhan ke dalam kelalang.
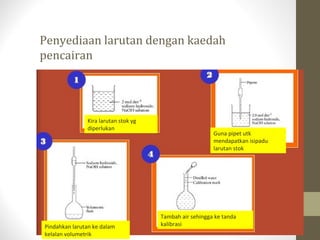
- 23. Penyediaan larutan dengan kaedah pencairan Kira larutan stok yg diperlukan Guna pipet utk mendapatkan isipadu larutan stok Pindahkan larutan ke dalam kelalan volumetrik Tambah air sehingga ke tanda kalibrasi
- 24. Pencairan • M1V1 = M2V2
- 26. Peneutralan • Tindakbalas asid dan bes dikenali sebagai peneutralan. • Hanya garam dan air hasil daripada peneutralan. Contoh : HCl + NaOH → NaCl + H2O
- 27. Latihan • Tulis persamaan kimia yang lengkap bagi tindakbalas peneutralan yg berikut : (a)Asid nitrik dan kalsium hidroksida (b)Asid sulfurik dan barium hidroksida (c)Asid etanoik, CH3COOH dan kalim hidroksida (d)Asid fosforik dan ammonia
- 28. Peneutralan dalam kehidupan seharian • Pertanian • Tanah berasid dirawat dengan serbuk kapur, CaO, batu kapur atau abu dr kayu terbakar. • Tanah beralkali dirawat dengan kompos. • Kapur, CaO digunakan mengawal keasidan dalam proses pembiakan ikan.
- 29. Peneutralan dalam kehidupan seharian • Perindustrian • Bahan berasid dari kilang dirawat dgn kapur sebelum dilepaskan. • Gas berasid spt sulfur dioksida, SO2 yg dikeluarkan oleh stesen janakuasa atau kilang dineutralkan oleh kapur, CaO sebelum dibebaskan ke atmosfera. • Ammonia, NH3 mencegah penggumpalan lateks meleui peneutralan asid yang dihasilkan oleh bakteria di dalam lateks.
- 30. Peneutralan dalam kehidupan seharian • Kesihatan • Antasid mengandungi bes spt magnesium hidroksida, Mg(OH)2 dan aluminium hidroksida, Al(OH)3 untuk meneutrlakan asid berlebihan di dalam perut. • Cuka digunakan utk merawat sengatan penyengat yg brsifat alkali. • Serbuk penaik digunakan untuk merawat sengatan lebah dan gigitan semut yng berasid.
- 31. •Bagaimana kita melakukan peneutralan di dalam makmal?
- 32. Pentitratan asid - bes • Pentitratan ialah teknik yg sangat berguna dalam makmal • Pentitratan menggunakan suatu larutan untuk menganalisi suatu larutan yang lain • Dalam pentitratan asid- bes , suatu asid yang diketahui kepekatannya ditambah secara perlahan-lahan daripada buret ke dalam kelalang kon yang mengaandungi suatu isipadu alkali untuk peneutralan lengkap berlaku. • Penunjuk asid-bes digunakan untuk mengesan tamatnya proses pentitratan apabila petunjuk itu bertukar warna. • Takat itu disebut sebagai takat akhir.
- 33. •Jom kita lakukan eksperimen pentitratan asid-bes








![KEKUATAN ASID DAN
ALKALI
A) Skala pH
Skala pH digunakan untuk menunjukkan darjah keasidan atau
kealkalian sesuatu larutan akueus
pH = - log [H3O+
]
pH kurang 7 – asid
pH sama dengan 7 – neutral
pH lebih drpd 7 – alkali](https://image.slidesharecdn.com/asiddanbes2-170202000209/85/Asid-dan-bes2-8-320.jpg)