Atom och molekylorbitaler
- 1. Vad är en atomorbital och hur hänger detta ihop med skalen? Traditionellt benämner man de platser runt en atom där de kan hålla sina elektroner som skal. Detta är en förlegad och inte så användbar modell. Om vi vill kunna använda atomens struktur till att förklara kemisk bindning och andra fenomen noggrannare måste använda en mer avancerad modell. Denna modell är kvantmekanisk i sin natur och anger förenklat energinivåer (orbitaler) som är möjliga för elektronen befinna sig i runt en specifik atom. Dessa nivåer kan beräknas med en ekvation för sannolikhetsfördelningen av elektronerna runt en atomkärna som postulerades av Ernest Schrödinger. De möjliga energinivåerna (orbitaler) är lösningar till denna ekvation. Varje lösning (orbital) kan hålla max 2 elektroner. • Huvudnivå: Som grundregel kan man säga att detta motsvarar raden i det periodiska systemet. Varje huvudnivå har ett visst antal möjliga energinivåer (undernivåer), antalet beror på hur många frihetsgrader varje nivå har (förenklat antalet variabler som bestämmer ekvationen för huvudnivån) De olika undernivåerna ser alltid likadana ut (utseende och antal e-) men har olika energi beroende på vilken huvudnivå de tillhör. Undernivå 1 kallas för s. s är alltid den första undernivån som fylls på varje huvudnivå. Antalet elektroner i varje undernivå bestäms i sin tur av hur många orbitaler undernivån har. (orbital =plats i rymden runt atomen som kan upptas av max 2 elektroner, lösning till Schrödinger ekvationen) • Undernivå 1 kallas för s. s är alltid den första undernivån som fylls på varje huvudnivå. Undernivå 1(s) består av 1 st orbital (plats för 2 elektroner). Första s undernivån heter 1s (eftersom den tillhör den 1:a huvudnivån). Den andra s undernivån kallas för 2s (då den tillhör huvudnivå 2) osv. • Undernivå 2 kallas för p. p är alltid den andra undernivån som fylls på varje huvudnivå från och med undernivå 2. Undernivå 2(p) består av 3 st orbitaler (var och en med plats för 2 elektroner). Första p undernivån heter 2p (eftersom den tillhör 2 huvudnivån), den andra p undernivån kallas för 3p (då den tillhör huvudnivå 3) osv. • Undernivå 3 kallas för d. d är alltid den tredje undernivån som fylls på varje huvudnivå från och med undernivå 3. Undernivå 3(d) består av 5 st orbitaler (var och en med plats för 2 elektroner). Första d undernivån heter 3d (eftersom den tillhör 3:e huvudnivån), den andra d undernivån kallas för 4d (då den tillhör huvudnivå 4) osv.
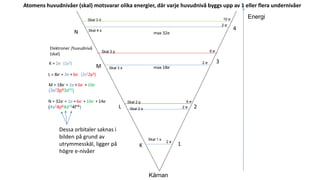
- 2. K = 2e- (1s2) L = 8e- = 2e-+ 6e- (2s22p6) M = 18e- = 2e-+ 6e- + 10e- (3s23p63d10) N = 32e- = 2e-+ 6e- + 10e- + 14e- (4s24p64d104f14) Elektroner /huvudnivå (skal) 1 2 3 4 K L M N max 18e- max 32e- Energi Kärnan 6 e- 2 e- 6 e- 2 e- 2 e- 2 e- 10 e- Skal 2 s Skal 2 p Skal 3 s Skal 3 p Skal 3 d Skal 4 s Skal 1 s Dessa orbitaler saknas i bilden på grund av utrymmesskäl, ligger på högre e-nivåer Atomens huvudnivåer (skal) motsvarar olika energier, där varje huvudnivå byggs upp av 1 eller flera undernivåer
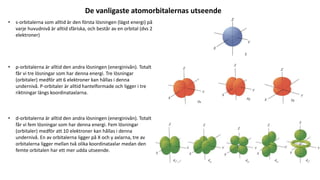
- 3. De vanligaste atomorbitalernas utseende • s-orbitalerna som alltid är den första lösningen (lägst energi) på varje huvudnivå är alltid sfäriska, och består av en orbital (dvs 2 elektroner) • p-orbitalerna är alltid den andra lösningen (energinivån). Totalt får vi tre lösningar som har denna energi. Tre lösningar (orbitaler) medför att 6 elektroner kan hållas i denna undernivå. P-orbitaler är alltid hantelformade och ligger i tre riktningar längs koordinataxlarna. • d-orbitalerna är alltid den andra lösningen (energinivån). Totalt får vi fem lösningar som har denna energi. Fem lösningar (orbitaler) medför att 10 elektroner kan hållas i denna undernivå. En av orbitalerna ligger på X och y axlarna, tre av orbitalerna ligger mellan två olika koordinataxlar medan den femte orbitalen har ett mer udda utseende.