Axit nitric muối nitrat
- 1. B├ĆI GIß║óNG H├ōA Hß╗īC 11 B├ĆI 9: AXIT NITRIC V├Ć MUß╗ÉI NITRAT
- 2. B├ĆI 9: AXIT NITRIC V├Ć MUß╗ÉI NITRAT A. Axit nitric B. Muß╗æi nitrat
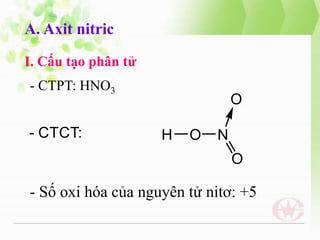
- 3. A. Axit nitric I. Cß║źu tß║Īo ph├ón tß╗Ł - CTPT: HNO3 - Sß╗æ oxi h├│a cß╗¦a nguy├¬n tß╗Ł nitŲĪ: +5
- 4. II. T├Łnh chß║źt vß║Łt l├Ł - Trß║Īng th├Īi: chß║źt lß╗Ång - M├Āu sß║»c: kh├┤ng m├Āu - T├Łnh tan: tan trong nŲ░ß╗øc theo bß║źt k├¼ tß╗ē lß╗ć n├Āo - ─Éß╗Ö bß╗ün: k├®m bß╗ün - Nß╗ōng ─æß╗Ö cß╗¦a dung dß╗ŗch ─æß║Łm ─æß║Ęc: 68% - Khß╗æi lŲ░ß╗Żng ri├¬ng: 1,4g/cm3
- 5. III. T├Łnh chß║źt h├│a hß╗Źc 1. T├Łnh axit - L├Ām quß╗│ t├Łm h├│a ─æß╗Å - T├Īc dß╗źng vß╗øi oxit bazŲĪ CuO + 2HNO3 ŌåÆ Cu NO3 2 + H2O - T├Īc dß╗źng vß╗øi bazŲĪ Mg OH 2 + 2HNO3 ŌåÆ Mg NO3 2 + 2H2O - T├Īc dß╗źng vß╗øi muß╗æi cß╗¦a axit yß║┐u hŲĪn NaHCO3 + HNO3 ŌåÆ NaNO3 + CO2 + H2O
- 6. 2. T├Łnh oxi h├│a: - HNO3 c├│ t├Łnh oxi h├│a mß║Īnh - T├╣y thuß╗Öc v├Āo nß╗ōng ─æß╗Ö cß╗¦a dung dß╗ŗch axit v├Ā bß║Żn chß║źt cß╗¦a chß║źt khß╗Ł m├Ā HNO3 sß║Į bß╗ŗ khß╗Ł tß║Īo ra NO2, NO, N2O, N2 hoß║Ęc NH4NO3.
- 7. a. T├Īc dß╗źng vß╗øi kim loß║Īi - C├Īc kim loß║Īi sß║Į bß╗ŗ oxi h├│a l├¬n mß╗®c oxi h├│a cao nhß║źt v├Ā tß║Īo muß╗æi nitrat. Fe + 4HNO3 (lo├Żng)ŌåÆFe(NO3)3 + NO+ 2H2O Ag + 2HNO3 (─æß║Ęc)ŌåÆ AgNO3 + NO2 + H2O
- 9. - Pt v├Ā Au kh├┤ng phß║Żn ß╗®ng vß╗øi dung dß╗ŗch HNO3. - Al, Cr, Fe bß╗ŗ thß╗ź ─æß╗Öng h├│a trong dung dß╗ŗch HNO3 ─æß║Ęc, nguß╗Öi. - C├Īc kim loß║Īi mß║Īnh khß╗Ł HNO3 lo├Żng th├Ānh N2, N2O hoß║Ęc NH4NO3. 4Mg + 10HNO3 (lo├Żng)ŌåÆ4Mg(NO3)2 + NH4NO3 + 5H2O 5Zn + 12HNO3 (lo├Żng)ŌåÆ 5Zn(NO3)2 + N2 + 6H2O
- 10. b. T├Īc dß╗źng vß╗øi phi kim 0 ’Ć½ 6 6HNO ’Ć½ S ’é« H SO ’Ć½ 6NO ’éŁ ’Ć½ 2H O 3 2 4 2 2 0 ’Ć½ 5 5HNO ’Ć½ P ’é« H PO ’Ć½ 5NO ’éŁ ’Ć½ H O 3 3 4 2 2 0 ’Ć½ 4 4HNO ’Ć½ C ’é« CO ’éŁ ’Ć½ 4NO ’éŁ ’Ć½ 2H O 3 2 2 2
- 11. b. T├Īc dß╗źng vß╗øi hß╗Żp chß║źt 3 3 3 4HNO ’Ć½ FeO’é«Fe(NO ) ’Ć½ NO2 ’éŁ ’Ć½2H2O 3 2 3 3 2 10HNO ’Ć½ 3Fe(OH) ’é«3Fe(NO ) ’Ć½ NO ’éŁ ’Ć½8H O
- 12. IV. ß╗©ng dß╗źng: Axit nitric
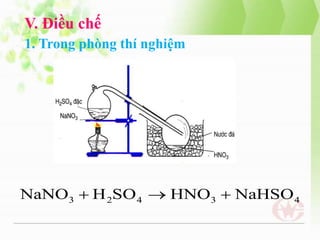
- 13. V. ─Éiß╗üu chß║┐ 1. Trong ph├▓ng th├Ł nghiß╗ćm NaNO3 ’Ć½ H2SO4 ’é«HNO3 ’Ć½ NaHSO4
- 14. 2. Trong c├┤ng nghiß╗ćp 0 850 900 C 3 2 Pt 2 4NH 5O NO 6H O ’ĆŁ ’Ć½ ’éŠ’éŠ’éŠ’éŠ’é« ’Ć½ 2 2 2NO’Ć½O ’é«2NO 2 2 2 3 4NO ’Ć½O ’Ć½ 2H O’é«4HNO