Bab 3. sistem periodik unsur
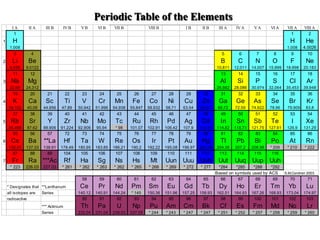
- 2. I A II A III B IVB VB VI B VII B VIII B I B II B III A IVA VA VI A VII A VIII A 1 1 2 1 H H He 1.008 1.008 4.0026 3 4 5 6 7 8 9 10 2 Li Be B C N O F Ne 6.939 9.0122 10.811 12.011 14.007 15.999 18.998 20.183 11 12 13 14 15 16 17 18 3 Na Mg Al Si P S Cl Ar 22.99 24.312 26.982 28.086 30.974 32.064 35.453 39.948 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.102 40.08 44.956 47.89 50.942 51.996 54.938 55.847 58.932 58.71 63.54 65.37 69.72 72.59 74.922 78.96 79.909 83.8 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.468 87.62 88.906 91.224 92.906 95.94 * 98 101.07 102.91 106.42 107.9 112.41 114.82 118.71 121.75 127.61 126.9 131.29 55 56 57 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 6 Cs Ba **La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.91 137.33 138.91 178.49 180.95 183.85 186.21 190.2 192.22 195.08 196.97 200.29 204.38 207.2 208.98 * 209 * 210 * 222 87 88 89 104 105 106 107 108 109 110 111 112 113 114 115 116 7 Fr Ra ***Ac Rf Ha Sg Ns Hs Mt Uun Uuu Uub Uut Uuq Uup Uuh * 223 226.03 227.03 * 261 * 262 * 263 * 262 * 265 * 268 * 269 * 272 * 277 *284 *285 *288 *292 Based on symbols used by ACS S.M.Condren 2003 58 59 60 61 62 63 64 65 66 67 68 69 70 71 * Designates that **Lanthanum Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu all isotopes are Series 140.12 140.91 144.24 * 145 150.36 151.96 157.25 158.93 162.51 164.93 167.26 168.93 173.04 174.97 radioactive 90 91 92 93 94 95 96 97 98 99 100 101 102 103 *** Actinium Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Series 232.04 231.04 238.03 237.05 * 244 * 243 * 247 * 247 * 251 * 252 * 257 * 258 * 259 * 260 Periodic Table of the Elements
- 3. SISTEM PERIODIK MODERN 1. PERIODE Merupakan sebutan untuk lajur-lajur yg mengarah secara mendatar dlm SPU Sistem periodik modern terdiri dari 7 periode
- 4. Periode Jumlah Unsur Nomor Atom (Z) 1 2 1-2 2 8 3-10 3 8 11-18 4 18 19-36 5 18 37-54 6 32 55-86 7 32 87-118
- 5. 2. GOLONGAN Merupakan lajur-lajur yg tersusun secara tegak Terdiri dari golongan utama dan golongan transisi Golongan utama merupakan golongan A (1A- VIIIA) Golongan transisi merupakan golongan B (1B- VIIIB)
- 6. 1. Golongan 1A = golongan Alkali 2. Golongan IIA = golongan Alkali tanah 3. Golongan IIIA = golongan Boron 4. Golongan IVA = golongan Karbon 5. Golongan VA = golongan Nitrogen 6. Golongan VIA = golongan Oksigen 7. Golongan VIIA = golongan Halida/Halogen 8. Golongan VIIIA = golongan Gas Mulia
- 7. 3. UNSUR TRANSISI DAN TRANSISI DALAM A. UNSUR TRANSISI berisikan golongan transisi yg merupakan golongan peralihan. Unsur-unsur ini terletak pada golongan B B. UNSUR TRANSISI DALAM Unsur transisi dalam terdiri dari kelompok LANTANIDA (unsur dgn nomor atom 57-70) dan AKTINIDA (unsur dgn nomor atom 89-102)
- 8. 4. HUBUNGAN KONFIGURASI ELEKTRON DENGAN SISTEM PERIODIK Penyusunan sistem periodik didasarkan atas kemiripan sifat. Apabila dilihat lebih dalam, maka kemiripan sifat ini akan berhubungan erat dengan konfigurasi elektronnya Unsur Nomor Atom K L M N O P Q H 1 1 Li 3 2 1 Na 11 2 8 1 K 19 2 8 8 1 Rb 37 2 8 18 8 1 Cs 55 2 8 18 18 8 1 Fr 87 2 8 18 32 18 8 1
- 9. Sehingga dapat disimpulkan : NOMOR PERIODE = JUMLAH KULIT NOMOR GOLONGAN = ELEKTRON VALENSI Unsur-unsur segolongan akan memiliki pola konfigurasi elektron valensi yg mirip, sehingga diletakkan dalam satu golongan
- 10. SOAL Diketahui unsur A memiliki konfigurasi elektron 2 8 8 4. Tentukan letak unsur tersebut dalam sistem periodik unsur !
- 11. B. PERKEMBANGAN DASAR PENGELOMPOKAN UNSUR 1. PENGELOMPOKAN ATAS LOGAM DAN NONLOGAM â—Ź Disusun oleh LAVOISIER yg terdiri atas unsur LOGAM dan NON LOGAM â—Ź Masih disusun secara sederhana, belum didasarkan pada kenaikansifat maupun kenaikan nomor atom â—Ź Unsur Logam (16 unsur) : emas,tembaga,timah, seng,antimon,besi,molibdenum,wolffram,kobalt,mang an,perak,nikel,timbal,platina,bismut,dan raksa) Unsur non logam (7 unsur) : belerang,arsen,karbon,hidrogen,fosfor,oksigen, dan nitrogen
- 12. 2. TRIADE DOBEREINER â—Ź Disusun oleh J.W. DOBEREINER â—Ź Triade mrpkn sebutan untuk penggolongan di dalam kelompok-kelompok tiga unsur. Penggolongan disusun secara berurutan berdasarkan kenaikan massa atom relatifnya Massa atom relatif unsur yg kedua merupakan rata-rata massa atom relatif unsur pertama dan ketiga. Selain itu, sifat unsur yg kedua memiliki kemiripan dengan unsur pertama dan ketiga
- 13. EXAMPLE Unsur Massa Atom Wujud Li 6,94 Padat Na 22,99 Padat K 39,10 padat Massa Atom Na (Ar Na) = (6,94 + 39,10) : 2 = 23,02
- 14. 3. HUKUM OKTAF NEWSLANDS â—Ź Disusun oleh John Newslands berdasarkan kenaikan massa atom relatifnya sesuai hukum Oktaf â—Ź Unsur-unsur disusun ke dalam kelompok 7 unsur dan diketahui sifat unsur kedelapan mempunyai sifat mirip dengan unsur pertama, unsur kesembilan mirip dengan unsur kedua dan seterusnya.
- 15. EXAMPLE H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe
- 16. 4. SISTEM PERIODIK MENDELEEV â—ŹDisusun oleh Dmitry Ivanovich Mendeleev â—Ź Disusun berdasarkan kenaikan massa atom relatif, sifat fisika, dan sifat kimianya TABEL SISTEM PERIODIK MENDELEEV YG TELAH DISEMPURNAKAN TH. 1871 TERDIRI ATAS GOLONGAN (LAJUR TEGAK) DAN PERIODE (LAJUR MENDATAR)
- 17. Missing elements: 44, 68, 72, & 100 amu Tabel Periodik Mendeleev
- 18. 5. SISTEM PERIODIK MODERN DARI HENRY G.MOSELEY â—ŹDisusun oleh Moseley dengan melibatkan penggunaan sinar X yg dikenakan target unsur untuk penentuan nomor atom dari berbagai jenis unsur â—Ź Hasil penelitiannya, diketahui dpt memprediksi 3 unsur baru, yaitu unsur dengan Z = 43, 61, dan 75 Selain itu, penelitiannya membuktikan bahwa nomor atom lebih memiliki makna dibandingkan nomor massa, sehingga diperoleh susunan tabel periodik unsur berdasarkan kenaikan nomor atom
- 19. C. SIFAT-SIFAT PERIODIK UNSUR 1. Jari-jari atom 2. Jari-jari ion 3. Energi ionisasi 4. Afinitas elektron 5. Keelektronegatifan 6. Sifat logam dan non logam
- 20. 1. Jari-Jari Atom â—Ź Jari-jari atom merupakan jarak dari inti atom sampai ke elektron pada kulit terluar â—Ź dalam 1 golongan, semakin ke bawah jari-jari atom semakin besar karena jumlah kulit yg dimiliki atom semakin banyak, maka kulit terluar semakin jauh dari inti atom â—Ź dalam 1 periode, dari kiri ke kanan semakin pendek. Sekalipun jumlah kulitnya sama, tapi banyaknya proton bertambah sehingga elektron- elektron terluar tertarik lebih dekat ke arah inti
- 21. 2. Jari-Jari Ion • memiliki kecenderungan sama seperti jari-jari atom • ion positive lebih kecil daripada atom • ion negatif lebih besar daripada atom
- 22. 3. Energi Ionisasi • energi yang dibutuhkan untuk melepas elektron untuk membentuk ion positif • nilainya kecil untuk logam, elektron mudah lepas • nilainya besar untuk non logam, elektron sulit untuk lepas • Bertambah dari sudut kiri bawah ke sudut kanan atas tabel periodik unsur
- 23. Energi Ionisasi energi ionisasi pertama • energi yang dibutuhkan untuk melepas elektron pertama dari atom energi ionisasi kedua • energi yang dibutuhkan untuk melepas elektron kedua dari ion (a+1) dan seterusnya .
- 24. 4. Afinitas Elektron • energi yang dibebaskan ketika suatu atom mengikat elektron • Kecenderungannya sama dengan energi ionisasi, bertambah dari sudut kiri bawah ke sudut kanan atas • logam memiliki “EA” lebih rendah • nonlogam memiliki “EA” tinggi
- 25. 5. Keelektronegatifan • Merupakan kemampuan suatu atom untuk menarik elektron dalam ikatannya • Unsur-unsur dalam 1 golongan dari atas ke bawah harga keelektronegatifannya berkurang • Unsur-unsur dalam 1 periode dari kiri ke kanan harga keelektronegatifannya semakin besar
- 26. 6. Sifat Logam dan Non Logam • Dalam 1 golongan dari atas ke bawah sifat logam bertambah • Dalam 1 periode dari kiri ke kanan sifat logam berkurang
Editor's Notes
- #15: Hukum Ok