BAB 5
- 1. Presentasi Powerpoint Pengajar oleh Penerbit ERLANGGA Divisi Perguruan Tinggi Bab 5 Gas CopyrightĖýÂĐĖýTheĖýMcGraw-HillĖýCompanies,ĖýInc.ĖýĖýPermissionĖýrequiredĖýforĖýreproductionĖýorĖýdisplay.
- 2. BeberapaĖýzatĖýyangĖýberwujudĖýgasĖýpadaĖýsuhuĖý250C danĖýtekananĖý1ĖýAtm 5.1
- 3. 5.1
- 4. Sifat-sifatĖýfisisĖýyangĖýkhasĖýdariĖýgas âĒ GasĖýmempunyaiĖývolumeĖýdanĖýbentukĖýmenyerupaiĖýwadahnya. âĒ GasĖýmerupakanĖýwujudĖýmateriĖýyangĖýpalingĖýmudahĖýdimampatkan. âĒ Gas-gasĖýakanĖýsegeraĖýbercampurĖýsecaraĖýmerataĖýdanĖýsempurnaĖý jikaĖýditempatkanĖýdalamĖýwadahĖýyangĖýsama. âĒ GasĖýmemilikiĖýkerapatanĖýyangĖýjauhĖýlebihĖýrendahĖýdibandingkanĖý cairanĖýdanĖýpadatan. 5.1
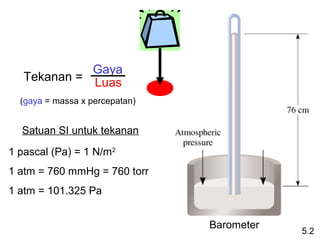
- 5. Gaya TekananĖý=Ėý Luas (gayaĖý=ĖýmassaĖýxĖýpercepatan) SatuanĖýSIĖýuntukĖýtekanan 1ĖýpascalĖý(Pa)Ėý=Ėý1ĖýN/m2 1ĖýatmĖý=Ėý760ĖýmmHgĖý=Ėý760Ėýtorr 1ĖýatmĖý=Ėý101.325ĖýPa Barometer 5.2
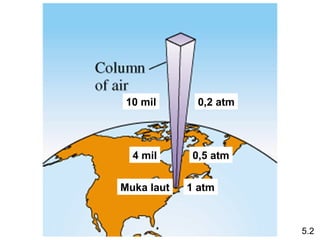
- 6. 10 mil 0,2 atm 4 mil 0,5 atm Muka laut 1 atm 5.2
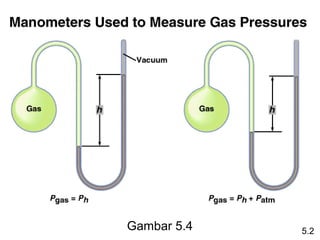
- 7. GambarĖý5.4 5.2
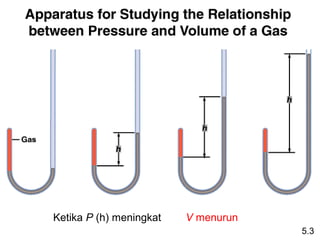
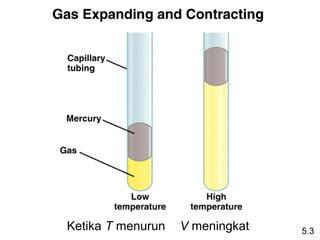
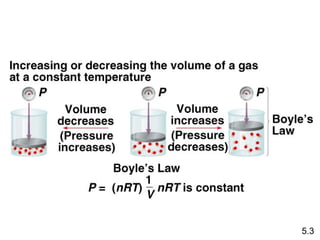
- 8. KetikaĖýPĖý(h)Ėýmeningkat VĖýmenurun 5.3
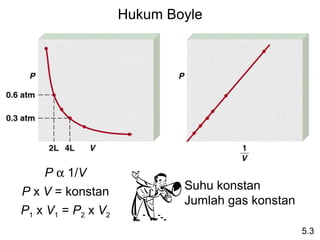
- 9. HukumĖýBoyle PĖýÎąĖý1/V PĖýxĖýVĖý=Ėýkonstan SuhuĖýkonstan JumlahĖýgasĖýkonstan P1ĖýxĖýV1Ėý=ĖýP2ĖýxĖýV2 5.3
- 10. SuatuĖýsampelĖýgasĖýklorinĖýmemilikiĖývolumeĖý946ĖýmLĖýpadaĖý tekananĖý726ĖýmmHg.ĖýĖýBerapaĖýtekananĖýgasĖý(dlmĖýmmHg)Ėý JikaĖývolumeĖýberkurangĖýpadaĖýsuhuĖýkonstanĖýmenjadiĖý 154ĖýmL? P1ĖýxĖýV1Ėý=ĖýP2ĖýxĖýV2 P1Ėý=Ėý726ĖýmmHg P2Ėý=Ėý? V1Ėý=Ėý946ĖýmL V2Ėý=Ėý154ĖýmL P1ĖýxĖýV1 726ĖýmmHgĖýxĖý946ĖýmL P2Ėý=Ėý = =Ėý4460ĖýmmHg V2 154ĖýmL 5.3
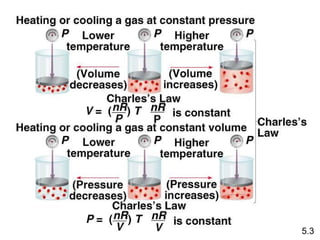
- 11. KetikaĖýTĖýmenurun VĖýmeningkat 5.3
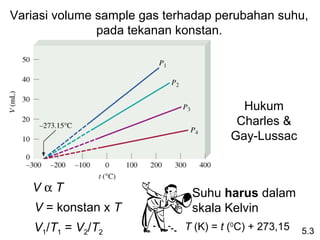
- 12. Variasi volume sample gas terhadap perubahan suhu, pada tekanan konstan. Hukum Charles & Gay-Lussac VÎąT Suhu harus dalam V = konstan x T skala Kelvin V1/T1 = V2/T2 T (K) = t (0C) + 273,15 5.3
- 13. Suatu sampel gas karbon monoksida 3,20 L pada 125 0 C. Pada suhu berapakah volume gas tsb. akan menjadi 1,54 L jika tekanan konstan? V1/T1 = V2/T2 V1 = 3,20 L V2 = 1,54 L T1 = 398,15 K T2 = ? T1 = 125 (0C) + 273,15 (K) = 398,15 K V2 x T1 1,54 L x 398,15 K T2 = = = 192 K V1 3,20 L 5.3
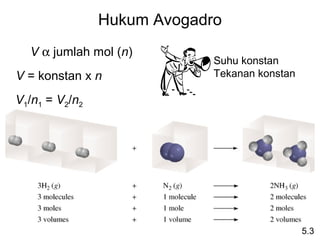
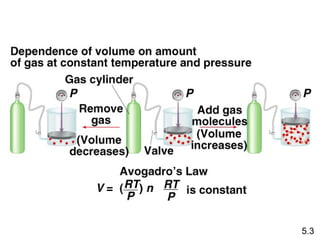
- 14. Hukum Avogadro V Îą jumlah mol (n) Suhu konstan V = konstan x n Tekanan konstan V1/n1 = V2/n2 5.3
- 15. Amonium terbakar pada oksigen membentuk nitrik oksida (NO) dan uap air. Berapa banyak volume NO dihasilkan dari 1 volume amonium pada kondisi suhu dan tekanan konstan? 4NH3 + 5O2 4NO + 6H2O 1 mol NH3 1 mol NO Pada T dan P konstan 1 volume NH3 1 volume NO 5.3
- 16. 5.3
- 17. 5.3
- 18. 5.3
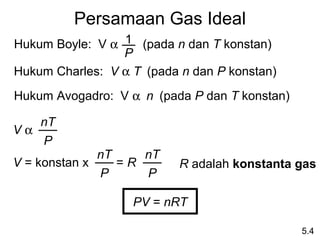
- 19. Persamaan Gas Ideal Hukum Boyle: V Îą 1 (pada n dan T konstan) P Hukum Charles: V Îą T (pada n dan P konstan) Hukum Avogadro: V Îą n (pada P dan T konstan) nT VÎą P nT nT V = konstan x =R R adalah konstanta gas P P PV = nRT 5.4
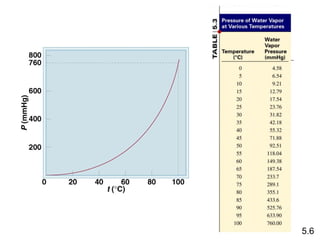
- 20. Kondisi 0 0C dan 1 atm disebut suhu dan tekanan standar (STP). Perbandingan volume molar pada STP (yaitu sekitar 22,4 L) dengan bola basket. PV = nRT PV (1 atm)(22,414L) R= = nT (1 mol)(273,15 K) R = 0,082057 L âĒ atm / (mol âĒ K) 5.4
- 21. Berapakah volume (dlm liter) dari 49,8 g HCl pd STP? T = 0 0C = 273,15 K P = 1 atm PV = nRT 1 mol HCl nRT n = 49,8 g x = 1,37 mol V= 36,45 g HCl P LâĒatm 1,37 mol x 0,0821 molâĒK x 273,15 K V= 1 atm V = 30,6 L 5.4
- 22. Argon merupakan gas inert yang digunakan pada bola lampu untuk menghindari penguapan dari filamen. Suatu bola lampu yang berisikan argon pd 1,20 atm dan 18 0C dipanaskan sampai 85 0C pada volume konstan. Berapakah tekanan akhir argon pada bola lampu tsb. (dlm atm)? PV = nRT n, V dan R konstan nR = P = konstan P1 = 1,20 atm P2 = ? V T T1 = 291 K T2 = 358 K P1 P2 = T1 T2 T2 P2 = P1 x = 1,20 atm x 358 K = 1,48 atm T1 291 K 5.4
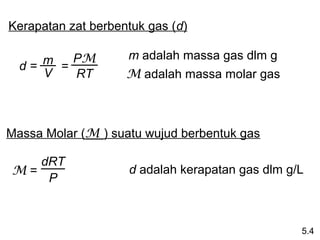
- 23. Kerapatan zat berbentuk gas (d) m = PM m adalah massa gas dlm g d= V RT M adalah massa molar gas Massa Molar (M ) suatu wujud berbentuk gas dRT M= d adalah kerapatan gas dlm g/L P 5.4
- 24. Suatu ruangan bervolume 2,10-L mempunyai suatu gas dengan berat 4,65 g pd 1,00 atm dan 27,00C. Berapa massa molar dari gas tsb.? dRT m = 4,65 g = 2,21 g M= d= P V 2,10 L L g LâĒatm 2,21 x 0,0821 molâĒK x 300,15 K L M= 1 atm M = 54,6 g/mol 5.3
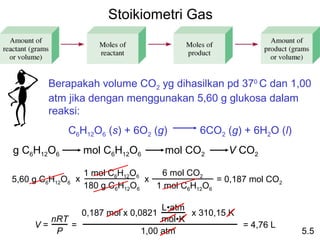
- 25. Stoikiometri Gas Berapakah volume CO2 yg dihasilkan pd 370 C dan 1,00 atm jika dengan menggunakan 5,60 g glukosa dalam reaksi: C6H12O6 (s) + 6O2 (g) 6CO2 (g) + 6H2O (l) g C6H12O6 mol C6H12O6 mol CO2 V CO2 1 mol C6H12O6 6 mol CO2 5,60 g C6H12O6 x x = 0,187 mol CO2 180 g C6H12O6 1 mol C6H12O6 LâĒatm 0,187 mol x 0,0821 x 310,15 K nRT molâĒK V= = = 4,76 L P 1,00 atm 5.5
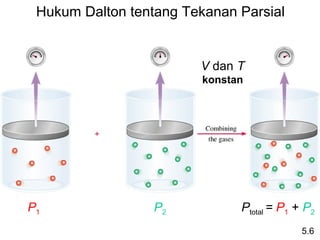
- 26. Hukum Dalton tentang Tekanan Parsial V dan T konstan P1 P2 Ptotal = P1 + P2 5.6
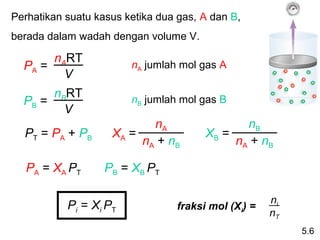
- 27. Perhatikan suatu kasus ketika dua gas, A dan B, berada dalam wadah dengan volume V. nART PA = nA jumlah mol gas A V nBRT nB jumlah mol gas B PB = V nA nB PT = PA + PB XA = XB = nA + nB nA + nB PA = XA PT PB = XB PT ni Pi = Xi PT fraksi mol (Xi) = nT 5.6
- 28. Suatu sampel gas alam memiliki 8,24 mol CH4, 0,421 mol C2H6, dan 0,116 mol C3H8. Jika tekanan total gas adalah 1,37 atm, Berapakah tekanan parsial dari propana (C3H8)? Pi = Xi PT PT = 1,37 atm 0,116 Xpropana = = 0,0132 8,24 + 0,421 + 0,116 Ppropana = 0,0132 x 1,37 atm = 0,0181 atm 5.6
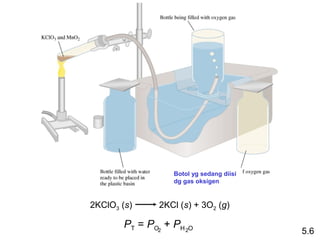
- 29. Botol yg sedang diisi dg gas oksigen 2KClO3 (s) 2KCl (s) + 3O2 (g) PT = PO2 + PH 2O 5.6
- 30. 5.6
- 31. Kimia Dalam Kehidupan: Scuba Diving dan Hukum Gas Kedlmn (ft) Tekanan (atm) 0 1 33 2 66 3 P V 5.6
- 32. Teori Kinetik Molekul Gas 1. Gas terdiri dari molekul2 yg satu sama lainnya dipisahkan oleh jarak yang lebih besar dari dimensinya sendiri. Molekul2 dapat dianggap âtitik2â yang memiliki massa, namun memiliki volume yg dapat diabaikan. 2. Molekul2 gas senantiasa bergerak secara tetap dengan arah yg acak. Tumbukan diantara molekul2 bersifat elastis sempurna. 3. Molekul2 gas tidak mengalami baik gaya tarik-menarik atau gaya tolak-menolak antara satu dengan yang lainnya. 4. Energi kinetik rata2 molekul sebanding dengan suhu gas dala kelvin. Dua gas apapun dalam suhu yang sama memiliki energi kinetik rata2 yang sama. 5.7
- 33. Penerapan Hukum-hukum Gas âĒ Ketermampatan Gas âĒ Hukum Boyle P Îą tumbukan molekul2 dg dinding wadah Laju tumbukan Îą besarnya kerapatan Besarnya kerapatan Îą 1/V P Îą 1/V âĒ Hukum Charles P Îą tumbukan molekul2 dg dinding wadah Laju tumbukan Îą energi kinetik rata2 dari molekul gas Energi kinetik rata2 Îą T PÎąT 5.7
- 34. Penerapan Hukum-hukum Gas âĒ Hukum Avogadro P Îą tumbukan molekul2 dg dinding wadah Laju tumbukan Îą besarnya kerapatan Besarnya kerapatan Îą n PÎąn âĒ Hukum Dalton tentang Tekanan Parsial Molekul tidak saling tarik-menarik atau tolak-menolak P yang ditimbulkan oleh satu jenis molekul tidak dipengaruhi oleh kehadiran gas lain Ptotal = ÎĢPi 5.7
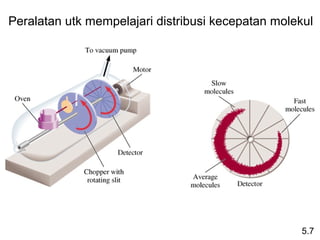
- 35. Peralatan utk mempelajari distribusi kecepatan molekul 5.7
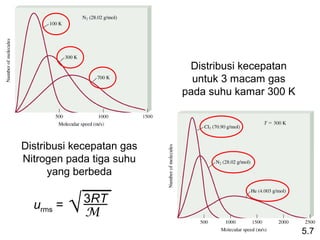
- 36. Distribusi kecepatan untuk 3 macam gas pada suhu kamar 300 K Distribusi kecepatan gas Nitrogen pada tiga suhu yang berbeda urms = â 3RT M 5.7
- 37. Kimia dalam Kehidupan: Atom Super Dingin Atom2 Gas Rb 1,7 x 10-7 K Kondensor Bose-Einstein 5.7
- 38. Difusi gas yakni campuran antara molekul satu gas dengan molekul gas lainnya yang terjadi secara sedikit demi sedikit berdasarkan sifat kinetiknya. NH4Cl NH3 HCl 17 g/mol 36 g/mol 5.7
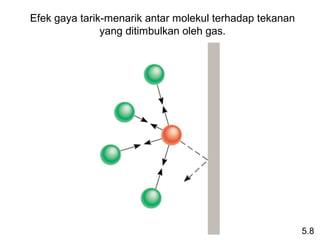
- 39. Penyimpangan Perilaku Ideal 1 mol gas ideal Gaya Tolak-menolak PV = nRT PV = 1,0 n= RT Gaya Tarik-menarik 5.8
- 40. Efek gaya tarik-menarik antar molekul terhadap tekanan yang ditimbulkan oleh gas. 5.8
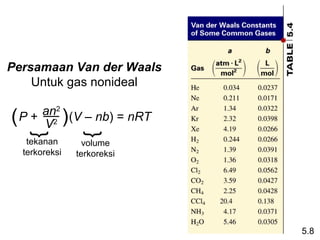
- 41. Persamaan Van der Waals Untuk gas nonideal an2 (V â nb) = nRT ( P + V2 ) } } tekanan volume terkoreksi terkoreksi 5.8