AROMATISITAS BENZENA & BENZENA TERSUBSTITUSI
- 1. BAB VI AROMATISITAS BENZENA & BENZENA TERSUBSTITUSI
- 2. • Benzen : Senyawa aromatik tersederhana. • Senyawa aromatik : molekulnya harus siklik dan datar, tiap atom dalam cincin harus memiliki orbital P tegak lurus pada bidang cincin delokalisasi penuh elektron II dan memenuhi aturan Huckel. harus memiliki elektron Pi sebanyak 4n + 2 bil.bulat bidang datar yang dikelilingi oleh awan elektron bersifat negatif terhadap luar mudah diserang oleh E+ Benzena 4n + 2 AROMATIK n=1 • Substitusi Aromatik Elektrofilik : • Aromatis benzen : menyajikan suatu kesetabilan yang unik pada sistem Pi. • Benzen tidak menjalai reaksi seperti pada Alkena. • Pada kondisi yang tepat : mudah bereaksi substitusi elekrofilik.
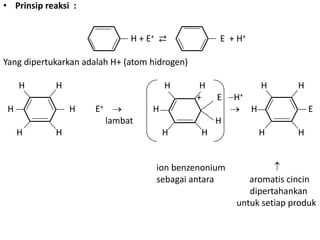
- 3. • Prinsip reaksi : H + E+ ⇄ E + H+ Yang dipertukarkan adalah H+ (atom hidrogen) H H H H H H + E H+ H H E+ H H E lambat H H H H H H H ion benzenonium sebagai antara aromatis cincin dipertahankan untuk setiap produk
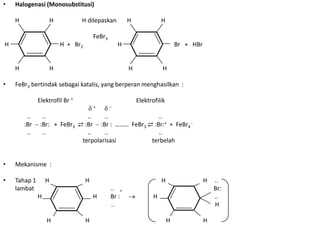
- 4. • Halogenasi (Monosubstitusi) H H H dilepaskan H H FeBr3 H H + Br2 H Br + HBr H H H H • FeBr3 bertindak sebagai katalis, yang berperan menghasilkan : Elektrofil Br + Elektrofilik + .. .. .. .. .. :Br :Br: + FeBr3 ⇄ :Br :Br : ……… FeBr3 ⇄ :Br:+ + FeBr4 .. .. .. .. .. terpolarisasi terbelah • Mekanisme : • Tahap 1 H H H H .. lambat .. + Br: H H Br : H .. .. H H H H H
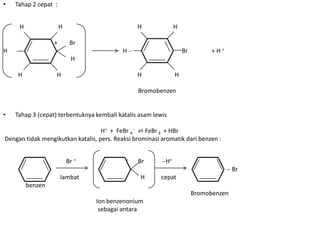
- 5. • Tahap 2 cepat : H H H H + Br H H Br +H+ H H H H H Bromobenzen • Tahap 3 (cepat) terbentuknya kembali katalis asam lewis H+ + FeBr 4 ⇌ FeBr 3 + HBr Dengan tidak mengikutkan katalis, pers. Reaksi brominasi aromatik dari benzen : Br + + Br H+ Br lambat H cepat benzen Bromobenzen Ion benzenonium sebagai antara
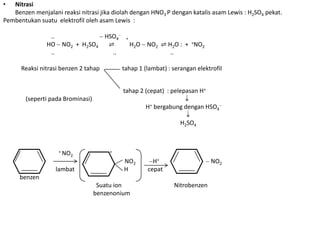
- 6. • Nitrasi Benzen menjalani reaksi nitrasi jika diolah dengan HNO3 P dengan katalis asam Lewis : H2SO4 pekat. Pembentukan suatu elektrofil oleh asam Lewis : .. HSO4 + HO NO2 + H2SO4 ⇌ H2O NO2 ⇌ H2O : + +NO2 .. .. .. Reaksi nitrasi benzen 2 tahap tahap 1 (lambat) : serangan elektrofil tahap 2 (cepat) : pelepasan H+ (seperti pada Brominasi) H+ bergabung dengan HSO4 H2SO4 + NO + 2 NO2 H+ NO2 lambat H cepat benzen Suatu ion Nitrobenzen benzenonium
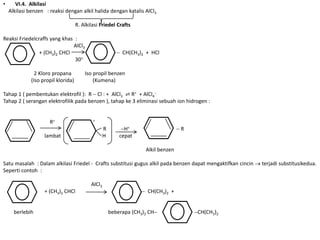
- 7. • VI.4. Alkilasi Alkilasi benzen : reaksi dengan alkil halida dengan katalis AlCl3 R. Alkilasi Friedel Crafts Reaksi Friedelcraffs yang khas : AlCl3 + (CH3)2 CHCl CH(CH3)2 + HCl 30 2 Kloro propana Iso propil benzen (Iso propil klorida) (Kumena) Tahap 1 ( pembentukan elektrofil ): R Cl : + AlCl3 ⇌ R+ + AlCl4 Tahap 2 ( serangan elektrofilik pada benzen ), tahap ke 3 eliminasi sebuah ion hidrogen : R+ + R H+ R lambat H cepat Alkil benzen Satu masalah : Dalam alkilasi Friedel - Crafts substitusi gugus alkil pada benzen dapat mengaktifkan cincin terjadi substitusikedua. Seperti contoh : AlCl3 + (CH3)2 CHCl CH(CH3)2 + berlebih beberapa (CH3)2 CH CH(CH3)2
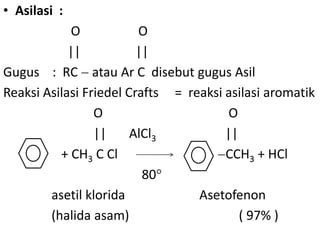
- 8. • Asilasi : O O || || Gugus : RC atau Ar C disebut gugus Asil Reaksi Asilasi Friedel Crafts = reaksi asilasi aromatik O O || AlCl3 || + CH3 C Cl CCH3 + HCl 80 asetil klorida Asetofenon (halida asam) ( 97% )
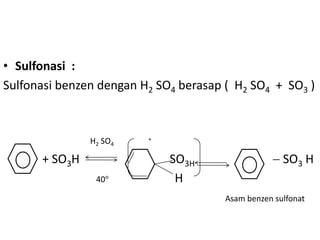
- 9. • Sulfonasi : Sulfonasi benzen dengan H2 SO4 berasap ( H2 SO4 + SO3 ) H2 SO4 + + SO3H SO3H SO3 H 40 H Asam benzen sulfonat
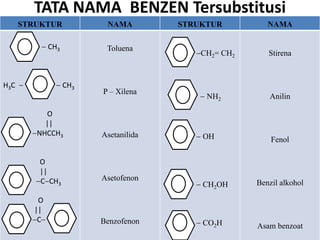
- 10. TATA NAMA BENZEN Tersubstitusi STRUKTUR NAMA STRUKTUR NAMA CH3 Toluena CH2= CH2 Stirena H3C CH3 P – Xilena NH2 Anilin O || NHCCH3 Asetanilida OH Fenol O || C CH3 Asetofenon CH2OH Benzil alkohol O || C Benzofenon CO2H Asam benzoat
- 11. • Benzen terdisubstitusi : diberi awalan : orto, meta, para Orto atau O meta, atau m Para, atau P Contoh : Cl Br Br Cl OH NH2 O – dibromo benzena m – Kloro anilin P– Kloro fenol
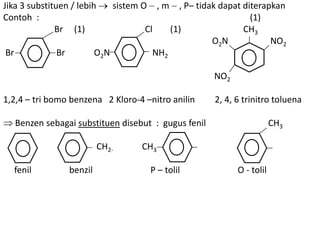
- 12. Jika 3 substituen / lebih sistem O ,m , P– tidak dapat diterapkan Contoh : (1) Br (1) Cl (1) CH3 O2N NO2 Br Br O2N NH2 NO2 1,2,4 – tri bomo benzena 2 Kloro-4 –nitro anilin 2, 4, 6 trinitro toluena Benzen sebagai substituen disebut : gugus fenil CH3 CH2- CH3 fenil benzil P – tolil O - tolil
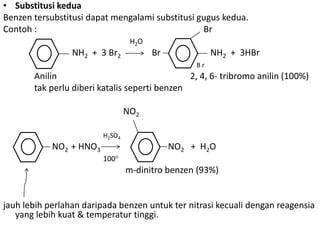
- 13. • Substitusi kedua Benzen tersubstitusi dapat mengalami substitusi gugus kedua. Contoh : Br H2O NH2 + 3 Br2 Br NH2 + 3HBr Br Anilin 2, 4, 6- tribromo anilin (100%) tak perlu diberi katalis seperti benzen NO2 H2SO4 NO2 + HNO3 NO2 + H2O 100 m-dinitro benzen (93%) jauh lebih perlahan daripada benzen untuk ter nitrasi kecuali dengan reagensia yang lebih kuat & temperatur tinggi.
- 14. Dalam contoh diatas : NH2 gugus aktivasi (gugus yang menyebabkan cincin lebih terbuka) terhadap substitusi lebih lanjut. Pengarah-Orto dan Para Sebaliknya gugus NO2 gugus deaktivasi (adanya gugus ini cincin lebih tertutup ) terhadap substitusi lanjut Pengarah meta
- 15. Efek Substituen pertama terhadap Substitusi Kedua : Pengarah Orto, para Pengarah meta (semua mendeaktivasi) .. .. .. O NH2, NHR, NR2 || CR .. OH CO2R bertamabahnya deaktivasi .. bertamabahnya aktivasi .. OR SO3H .. O .. || CHO NHCR CO2H CN C6H5 (aril) – R ( alkil) NO2 .. X : ( mendeaktivasi) NR3+ . Semua pengaruh O,P Semua pengarah - m aktivasi, kecuali bersifat deaktivasi .. halogen ( X : ) tak satupun mempunyai pasangan e menyendiri kecuali gugus aril, alkil pada atomnya yang terikat mempunyai pasangan e menyendiri pada cincin.
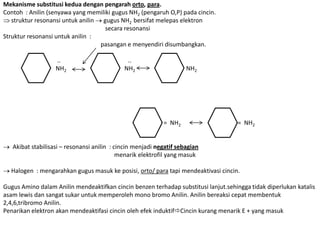
- 16. Mekanisme substitusi kedua dengan pengarah orto, para. Contoh : Anilin (senyawa yang memiliki gugus NH2 (pengaruh O,P) pada cincin. struktur resonansi untuk anilin gugus NH2 bersifat melepas elektron secara resonansi Struktur resonansi untuk anilin : pasangan e menyendiri disumbangkan. .. .. NH2 NH2 NH2 = NH2 = NH2 Akibat stabilisasi – resonansi anilin : cincin menjadi negatif sebagian menarik elektrofil yang masuk Halogen : mengarahkan gugus masuk ke posisi, orto/ para tapi mendeaktivasi cincin. Gugus Amino dalam Anilin mendeaktifkan cincin benzen terhadap substitusi lanjut.sehingga tidak diperlukan katalis asam lewis dan sangat sukar untuk memperoleh mono bromo Anilin. Anilin bereaksi cepat membentuk 2,4,6,tribromo Anilin. Penarikan elektron akan mendeaktifasi cincin oleh efek induktifCincin kurang menarik E + yang masuk
- 17. Mekanisme substitusi kedua dengan adanya pengarah Meta Gugus penarik elektron pengarah meta: bersifat mendeaktifasi Alkil Benzen Substituen alkil benzen mempunyai efek yang besar pada sifat2 kimia substituen2nya Contoh reaksi : Gugus Alkil dari alkil benzen dapat dioksidasi