Chimica 2
- 1. Si ha un legame chimico quando una forza di natura elettrostatica tiene uniti piÃđ atomi in una molecola o in un composto chimico (legami forti, o intramolecolari) o piÃđ molecole in una sostanza allo stato condensato (legami deboli, o intermolecolari ). ïŪ LEGAMI INTRAMOLECOLARI âĒGli atomi formano legami chimici per raggiungere una configurazione elettronica piÃđ stabile, generalmente la configurazione elettronica del gas nobile piÃđ vicino, quindi lâottetto. I gas nobili, che già hanno raggiunto lâottetto, non formano legami chimici. âĒQuando due atomi si legano la molecola risultante ÃĻ un sistema ad energia minore e quindi piÃđ stabile rispetto ai due atomi isolati, questo ÃĻ il motivo per cui in natura si trovano pochissimi atomi isolati. âĒNei legami chimici vengono interessati solo elettroni di valenza, cioÃĻ quelli degli orbitali piÃđ esterni. âĒLâenergia di legame ÃĻ la quantità di energia che bisogna fornire per rompere un legame e che ÃĻ uguale a quella che si libera quando lo stesso legame viene costituito. âĒIdentifichiamo tre tipi di legame che si ottengono combinando i due tipi di atomo: metallo con non metallo; non metallo con non metallo; metallo con metallo.
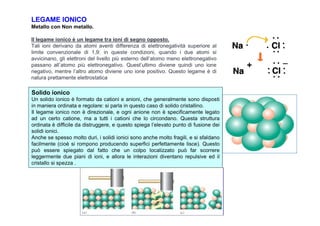
- 2. LEGAME IONICO Metallo con Non metallo. Il legame ionico ÃĻ un legame tra ioni di segno opposto. Tali ioni derivano da atomi aventi differenza di elettronegatività superiore al limite convenzionale di 1,9: in queste condizioni, quando i due atomi si avvicinano, gli elettroni del livello piÃđ esterno dellâatomo meno elettronegativo passano allâatomo piÃđ elettronegativo. Questâultimo diviene quindi uno ione negativo, mentre lâaltro atomo diviene uno ione positivo. Questo legame ÃĻ di natura prettamente elettrostatica Solido ionico Un solido ionico ÃĻ formato da cationi e anioni, che generalmente sono disposti in maniera ordinata e regolare: si parla in questo caso di solido cristallino. Il legame ionico non ÃĻ direzionale, e ogni anione non ÃĻ specificamente legato ad un certo catione, ma a tutti i cationi che lo circondano. Questa struttura ordinata ÃĻ difficile da distruggere, e questo spiega lâelevato punto di fusione dei solidi ionici. Anche se spesso molto duri, i solidi ionici sono anche molto fragili, e si sfaldano facilmente (cioÃĻ si rompono producendo superfici perfettamente lisce). Questo puÃē essere spiegato dal fatto che un colpo localizzato puÃē far scorrere leggermente due piani di ioni, e allora le interazioni diventano repulsive ed il cristallo si spezza .
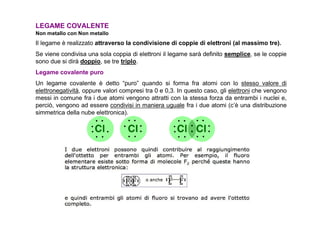
- 4. LEGAME COVALENTE Non metallo con Non metallo Il legame ÃĻ realizzato attraverso la condivisione di coppie di elettroni (al massimo tre). Se viene condivisa una sola coppia di elettroni il legame sarà definito semplice, se le coppie sono due si dirà doppio, se tre triplo. Legame covalente puro Un legame covalente ÃĻ detto âpuroâ quando si forma fra atomi con lo stesso valore di elettronegatività , oppure valori compresi tra 0 e 0,3. In questo caso, gli elettroni che vengono messi in comune fra i due atomi vengono attratti con la stessa forza da entrambi i nuclei e, perciÃē, vengono ad essere condivisi in maniera uguale fra i due atomi (câÃĻ una distribuzione simmetrica della nube elettronica).
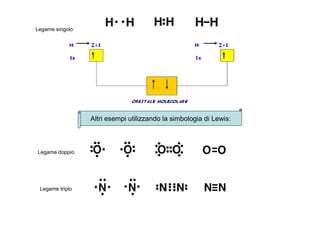
- 5. Legame singolo Altri esempi utilizzando la simbologia di Lewis: Legame doppio Legame triplo
- 6. Legame covalente polare Un legame covalente polare si forma tra atomi che hanno elettronegatività diversa, ma non tanto diversa da rendere possibile la formazione di un legame ionico (la differenza dei valori di elettronegatività ÃĻ sempre minore di 1,9). In questo caso, i due atomi mettono in comune i loro elettroni spaiati che perÃē saranno maggiormente attratti dallâatomo piÃđ elettronegativo. Il legame risulterà quindi polarizzato elettricamente, cioÃĻ ognuno degli atomi coinvolti nel legame presenterà una carica elettrica parziale, o negativa o positiva. PoichÃĐ si ha un parziale trasferimento di elettroni da un atomo ad un altro, questo tipo di legame ÃĻ intermedio tra il legame covalente e il legame ionico. Per esempio in HCl il cloro attrae la coppia di elettroni piÃđ fortemente, e questa quindi si trova piÃđ vicina al cloro che allâidrogeno. Si ha quindi una piccola carica negativa sul cloro, e una piccola carica positiva sullâidrogeno (indicate con i simboli Îī+ e Îīâ). Nel suo complesso, la molecola ÃĻ un dipolo elettrico.
- 8. Legame di coordinazione (o dativo) à un tipo particolare di legame covalente detto, in passato, dativo in quanto i due elettroni coinvolti nel legame provengono da uno solo dei due atomi detto datore (o agente nucleofilo), mentre l'altro viene detto accettore (o agente elettrofilo) e deve avere un orbitale vuoto nel quale poter âalloggiareâ questa coppia. Il caso piÃđ comune ÃĻ quello in cui l'ammoniaca, che possiede un doppietto elettronico non condiviso, lega un protone H+ dando cosÃŽ luogo allo ione ammonio. Solidi covalenti Nel reticolo cristallino * sono posti atomi legati tra loro da legami covalenti quindi da forze intense e di tipo direzionale. Lâesempio tipico ÃĻ quello del diamante, in cui ogni atomo di carbonio ha una in comune una coppia di elettroni con altri atomi di carbonio. Altro esempio ÃĻ il quarzo (SiO2). Tali solidi hanno punti di fusione e durezza elevati, sono in genere cattivi conduttori di elettricità e insolubili. * Reticolo cristallino: schema che riproduce la disposizione spaziale delle particelle (atomi/molecole/ioni) in un solido cristallino.
- 9. Legame metallico Metallo con metallo Nel piÃđ semplice modello del legame metallico, tutti gli atomi mettono in comune i loro elettroni di valenza in un âmareâ di elettroni uniformemente distribuito. Secondo questo modello un metallo puÃē essere rappresentato come un reticolo cristallino di ioni positivi tenuti uniti da una nube di elettroni condivisi estesa a tutto il reticolo. A differenza del legame covalente, gli elettroni sono âdelocalizzatiâ, cioÃĻ non sono legati a nessun atomo particolare e quindi risultano essere estremamente . Tale mobilità ÃĻ responsabile delle proprietà dei metalli come lâelevata conducibilità elettrica. Solidi metallici Il legame metallico, che tiene insieme il reticolo dei solidi metallici, ÃĻ determinato dallâattrazione tra ioni positivi e gli elettroni delocalizzati. Esso non ÃĻ direzionale e i reticoli cristallini sono caratterizzati da un impacchettamento compatto di ioni. La non direzionalità dei legami spiega alcune proprietà dei metalli, quali la tenacità , la plasticità , la duttilità (si riducono facilmente in fili sottili) e la malleabilità (si riducono facilmente in fogli sottili) .
- 10. DUE TEORIE DEL LEGAME COVALENTE Si basano sulla meccanica quantistica: âĒ TEORIA DEL LEGAME DI VALENZA (VB) che spiega le interazioni degli orbitali atomici nella formazione di un legame covalente. âĒ TEORIA DEGLI ORBITALI MOLECOLARI (MO) che ipotizza lâesistenza di orbitali che si estendono sullâintera molecola. Le due teorie si integrano lâuna con lâaltra e sono indispensabili per la comprensione del legame covalente.
- 11. TEORIA DEL LEGAME DI VALENZA (VB) 1. Un legame chimico si forma spontaneamente tra due atomi che presentino orbitali semivuoti al fine di conseguirne la saturazione. Di conseguenza non ÃĻ necessario che venga realizzato lâottetto elettronico 2. un legame chimico ÃĻ dato dalla sovrapposizione degli orbitali degli atomi che partecipano al legame. 3. La sovrapposizione puÃē avvenire in due modi diversi e generare due tipi di legami covalente: Ï e Ï 4. gli elettroni di legame sono, con molta probabilità , localizzati nella regione di legame. 5. Gli orbitali atomici che danno luogo alla formazione del legame possono essere di tipi differenti. 6. Gli orbitali atomici che danno luogo alla formazione del legame, possono anche non essere orbitali atomici âpuriâ (cioÃĻ derivanti direttamente dalla soluzione dellâequazione di Schroedinger), ma di carattere diverso. Viene introdotto il concetto di ibridazione.
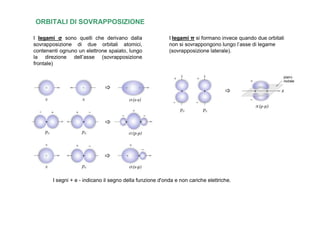
- 12. ORBITALI DI SOVRAPPOSIZIONE I legami Ï sono quelli che derivano dalla I legami Ï si formano invece quando due orbitali sovrapposizione di due orbitali atomici, non si sovrappongono lungo lâasse di legame contenenti ognuno un elettrone spaiato, lungo (sovrapposizione laterale). la direzione dellâasse (sovrapposizione frontale) I segni + e - indicano il segno della funzione d'onda e non cariche elettriche.
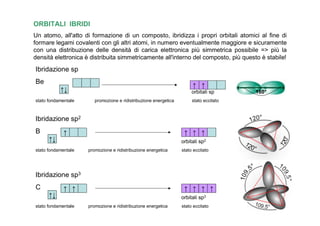
- 13. ORBITALI IBRIDI Un atomo, all'atto di formazione di un composto, ibridizza i propri orbitali atomici al fine di formare legami covalenti con gli altri atomi, in numero eventualmente maggiore e sicuramente con una distribuzione delle densità di carica elettronica piÃđ simmetrica possibile => piÃđ la densità elettronica ÃĻ distribuita simmetricamente all'interno del composto, piÃđ questo ÃĻ stabile! Ibridazione sp Be â â ââ orbitali sp 180° stato fondamentale promozione e ridistribuzione energetica stato eccitato Ibridazione sp2 B â â â â ââ orbitali sp2 stato fondamentale promozione e ridistribuzione energetica stato eccitato Ibridazione sp3 C â â â â â â ââ orbitali sp3 stato fondamentale promozione e ridistribuzione energetica stato eccitato
- 14. TEORIA DEGLI ORBITALI MOLECOLARI (MO) âĒ Una molecola ÃĻ visualizzata come un insieme di nuclei aventi orbitali elettronici delocalizzati sullâintera molecola. âĒ Come un atomo ha orbitali atomici che hanno una data energia, una forma definita e sono occupati da elettroni, cosÃŽ una molecola ha orbitali molecolari che hanno una data energia ed una forma definita e sono occupati dagli elettroni della molecola. âĒ Funzioni dâonda di orbitali atomici di energia simile possono essere addizionati o sottratti per ottenere, rispettivamente, orbitali molecolari leganti ed orbitali molecolari antileganti. âĒL'orbitale legante ÃĻ a minor energia rispetto a quella degli orbitali atomici e per questo motivo si forma prima. Ha la maggior densità elettronica tra i nuclei. âĒ L'orbitale antilegante ha una maggiore energia e per questo motivo, in sequenza, ÃĻ il secondo a formarsi. La maggior densità elettronica non si trova tra i nuclei ed ÃĻ quindi ad energia maggiore. âĒ Il numero di orbitali molecolari ÃĻ uguale al numero di orbitali atomici che sono stati combinati. âĒ Lâordine di legame ÃĻ un numero ottenuto dalla seguente formula: ordine di legame = (n° elettroni leganti â n° elettroni antileganti) / 2 Visto che il numero di elettroni antileganti (a maggior energia) ÃĻ, secondo la teoria, minore o uguale al numero di elettroni leganti il valore puÃē essere soltanto positivo o pari a zero. In quest'ultimo caso perÃē la molecola non esiste (vedi il caso dei gas nobili).
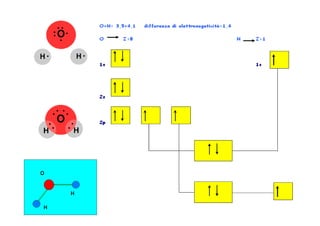
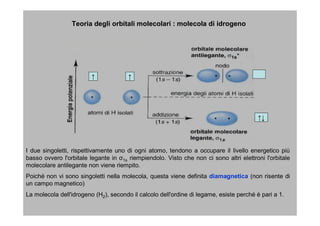
- 15. Teoria degli orbitali molecolari : molecola di idrogeno â â ââ I due singoletti, rispettivamente uno di ogni atomo, tendono a occupare il livello energetico piÃđ basso ovvero l'orbitale legante in Ï1s riempiendolo. Visto che non ci sono altri elettroni l'orbitale molecolare antilegante non viene riempito. PoichÃĐ non vi sono singoletti nella molecola, questa viene definita diamagnetica (non risente di un campo magnetico) La molecola dell'idrogeno (H2), secondo il calcolo dell'ordine di legame, esiste perchÃĐ ÃĻ pari a 1.
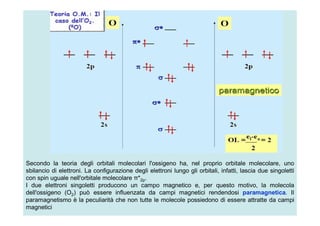
- 16. Secondo la teoria degli orbitali molecolari l'ossigeno ha, nel proprio orbitale molecolare, uno sbilancio di elettroni. La configurazione degli elettroni lungo gli orbitali, infatti, lascia due singoletti con spin uguale nell'orbitale molecolare Ï*2p. I due elettroni singoletti producono un campo magnetico e, per questo motivo, la molecola dell'ossigeno (O2) puÃē essere influenzata da campi magnetici rendendosi paramagnetica. Il paramagnetismo ÃĻ la peculiarità che non tutte le molecole possiedono di essere attratte da campi magnetici
- 17. ïŪ LEGAMI INTERMOLECOLARI âĒ Forze di van der Waals Gli atomi di una molecola - ad es. quelli di una molecola di metano (CH4) - sono tenuti insieme da forti legami covalenti. Quando il metano si trova allo stato liquido o solido, i legami che tengono vicine le molecole sono le forze di van der Waals. Ci sono diversi tipi di forze di van der Waals: 1. dipolo spontaneo - dipolo indotto 2. dipolo - dipolo
- 18. 1. Attrazioni dipolo spontaneo - dipolo indotto (Forze di London) Le attrazioni dipolo spontaneo - dipolo indotto sono sorprendentemente forti a distanza brevissima. Lo iodio (I2) nonostante sia una molecola apolare si trova allo stato solido. Questo significa che anche fra le sue molecole c'ÃĻ una forza di attrazione piuttosto elevata, nota come "forza di London". Questa attrazione ÃĻ dovuta allo spostamento casuale - e per tempi brevissimi - degli elettroni di una molecola verso una zona della molecola stessa. PoichÃĐ gli elettroni hanno carica negativa, questa zona diventa negativa; l'altra parte della molecola - piÃđ povera di elettroni - diventa positiva perchÃĐ la carica dei protoni (positiva) non ÃĻ neutralizzata del tutto dagli elettroni. CiÃē dà luogo alla formazione di un dipolo istantaneo. Questa molecola che si ÃĻ polarizzata induce la polarizzazione di una molecola vicina (la parte positiva della prima molecola attrae gli elettroni della molecola vicina). La molecola che si ÃĻ appena polarizzata induce la polarizzazione di un'altra molecola vicina. E cosÃŽ via. La "catena" di molecole che si ÃĻ formata ha una vita brevissima, perchÃĐ rapidamente le molecole tornano allo stato normale di non-polarizzazione. Ma ci sarà qualche altra molecola che si polarizzerà casualmente, e provocherà la polarizzazione di una molecola vicina, ... Lâintensità di tali forze cresce all'aumentare della superficie della molecola. Si spiega cosÃŽ l'aumento della temperatura di ebollizione degli alogeni F2 < Cl2 < Br2 < I2.
- 19. 2. Attrazioni dipolo - dipolo Le molecole possono avere un'interazione attrattiva dipolo-dipolo se sono molecole polari: Legame a idrogeno Un legame a idrogeno si forma quando un atomo di idrogeno legato con legame covalente ad un elemento molto elettronegativo (fluoro, ossigeno, cloro, azoto) si lega anche - con un "legame a idrogeno" - ad un elemento ugualmente molto elettronegativo. Il legame a idrogeno ÃĻ il legame responsabile degli alti punti di ebollizione di alcuni composti, tra cui l'acqua. Solidi molecolari Le molecole, disposte secondo un determinato ordine geometrico (reticolo cristallino) sono tenute insieme da deboli legami quali le forze di van der Waals. Un esempio sono il ghiaccio, lo iodio, la naftalina. Questi solidi hanno un basso punto di fusione e talvolta tendono a sublimare. La loro solubilità dipende dalla capacità di stabilire legami con le molecole con il solvente.