Chimica 4
- 1. REAZIONI DI SINTESIâĶâĶâĶâĶâĶâĶâĶâĶâĶâĶâĶâĶâĶ.A + B ïŪ AB REAZIONI DI DECOMPOSIZIONEâĶâĶâĶâĶâĶâĶâĶâĶAB ïŪ A + B REAZIONI DI SCAMBIO (o SPOSTAMENTO)âĶâĶâĶAX + B ïŪ A + BX REAZIONI DI DOPPIO SCAMBIOâĶâĶâĶâĶâĶâĶâĶâĶ.AB + CD ïŪ AD + CB Regola importante Per bilanciare le reazioni ÃĻ necessario seguire queste istruzioni in modo molto preciso: 1. Si scrivono le formule dei reagenti e dei prodotti (attenzione a non inventarle!) 2. Si antepongono alle formule dei reagenti e dei prodotti opportuni coefficienti in modo che il numero di atomi di ciascun elemento sia il medesimo nei reagenti e nei prodotti
- 2. REAZIONI DI SINTESI : due composti reagiscono per formare un singolo prodotto A + B âAB 1. Metallo + H2 ïŪ idruroâĶâĶâĶâĶâĶâĶâĶâĶâĶâĶ... 2 Li + H2 ïŪ 2 LiH 2. Alogeno + H2 ïŪ idracidoâĶâĶâĶâĶâĶâĶâĶâĶâĶ.. Cl2 + H2 ïŪ 2 HCl 3. Metallo + non metallo ïŪ sale binarioâĶâĶâĶâĶ. 2 Al + 3I2 ïŪ 2 AlI3 4. Metallo + O2 ïŪ ossido basicoâĶâĶâĶâĶâĶâĶâĶ. 4 Na + O2 ïŪ 2 Na2O 5. Non metallo + O2 ïŪ ossido acido (anidride)âĶ. 2 N2(III)+ 3 O2 ïŪ 2 N2O3 6. Ossido acido + acqua ïŪ ossoacidoâĶâĶâĶâĶ... SO2 + H2O ïŪ H2SO3 7. Ossido basico + acqua ïŪ idrossidoâĶâĶâĶâĶ... K2O + H2O ïŪ 2 KOH (per lo piÃđ di metalli del I o II gruppo) REAZIONI DI DECOMPOSIZIONE : una sostanza si decompone in due o piÃđ prodotti AB âA + B Tutte le decomposizioni sono favorite dal riscaldamento a temperature elevate (reazioni esotermiche). 1. Decomposizione per formare ossigenoâĶâĶâĶ. 2 H2O2 ïŪ 2 H2O + O2 2. Decomposizione dei carbonati Carbonato ïŪ ossido del metallo + CO2âĶâĶ. CaCO3 ïŪ CaO + CO2 (reazione possibile per tutti i carbonati, esclusi quelli dei metalli alcalini) 3. Decomposizione degli idrossidi Idrossido ïŪ ossido del metallo + H2OâĶâĶ.. 2 Al(OH)3 ïŪ Al2O3 + 3 H2O (reazione possibile per tutti gli idrossidi, esclusi quelli dei metalli alcalini)
- 3. SCALA DELLE REATTIVITAâ REAZIONI DI SCAMBIO (o SPOSTAMENTO) Li+ Un elemento (B) reagisce con un composto (AX) per formarne uno nuovo (BX) e liberare K+ un elemento (A) . Ca++ Na+ AX + B ïŪ A + BX Mg++ Al+++ Elemento Mn++ meno Elemento Elemento piÃđ Zn++ reattivo conteso reattivo Cr+++ Fe++ âĒ Ossido di elemento + elemento ïŪ elemento + ossido dellâelemento H2 meno reattivo piÃđ reattivo meno reattivo piÃđ reattivo Cd++ Co++ Fe2O3 + 6 K ïŪ 2 Fe + 3 K2O Ni++ Sn++ Pb++ âĒ Metallo piÃđ reattivo + acqua ïŪ idrogeno + idrossido Fe+++ (I e II gruppo) Sn++++ Cu++ O2 2 Na + 2 H2O ïŪ H2 + 2 NaOH Cu+ I2 Hg+ âĒ Metallo piÃđ reattivo + acido ïŪ idrogeno + sale Ag+ (Al, Zn, Sn, Fe, Ni) Hg++ Br2 Cl2 2 Al + 6 HNO3 ïŪ 3 H2 + 2 Al(NO3)3 Au+++ F2 âĒ Metallo piÃđ reattivo + sale1 di metallo ïŪ metallo del + sale del metallo meno reattivo sale 1 piÃđ reattivo 2 Mg + SnCl4 ïŪ Sn + 2 MgCl2
- 4. REAZIONI DI DOPPIO SCAMBIO Frequentemente i composti ionici disciolti in H2O scambiano fra loro ioni positivi e negativi. AB + CD ïŪ AD + CB âĒ Formazione di un precipitato (= sale insolubile) La formazione di un precipitato si realizza se durante la reazione si forma un sale insolubile. 1. Sale1 + acido1 ïŪ sale2 + acido2 âĶâĶâĶ. BaCl2 + H2SO4 ïŪ BaSO4â + 2 HCl 2. Sale1 + sale2 ïŪ sale3 + sale4 âĶâĶâĶâĶ. CaCl2 + Na2SO4 ïŪ CaSO4â + 2 NaCl âĒ Formazione di un gas 1. Carbonato + acido ïŪ sale dellâacido + CO2 + H2O âĶâĶâĶ. CaCO3 + 2 HCl ïŪ CaCl2 + CO2 + H2O 2. Solfito + acido ïŪ sale dellâacido + SO2 + H2O âĶâĶâĶâĶâĶ 3 Li2SO3 + 2 H3PO4 ïŪ 2 Li3PO4 + 3 SO2 + 3 H2O 3. Solfuro + acido ïŪ sale dellâacido + H2S ............................ FeS + 2 HCl ïŪ FeCl2 + H2S 4. Sale di ammonio + idrossido ïŪ NH3 + sale + H2O + calore âĶ NH4Cl + KOH ïŪ NH3 + KCl + H2O + calore âĒ Formazione di acqua (= reazioni di neutralizzazione) 1. Idrossido + acido ïŪ sale dellâacido + H2O + calore âĶâĶâĶ. NaOH + HCl ïŪ NaCl + H2O + calore 2. Ossido basico + acido ïŪ sale dellâacido + H2O âĶâĶâĶâĶâĶ NiO + 2 HNO3 ïŪ Ni(NO3)2 + H2O 3. Ossido acido + idrossido ïŪ sale + H2O âĶâĶâĶâĶâĶâĶâĶâĶ SO3 + 2 NaOH ïŪ Na2SO4 + 2 H2O
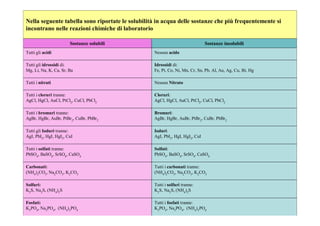
- 5. Nella seguente tabella sono riportate le solubilità in acqua delle sostanze che piÃđ frequentemente si incontrano nelle reazioni chimiche di laboratorio Sostanze solubili Sostanze insolubili Tutti gli acidi Nessun acido Tutti gli idrossidi di: Idrossidi di: Mg, Li, Na, K, Ca, Sr, Ba Fe, Pt, Co, Ni, Mn, Cr, Sn, Pb, Al, Au, Ag, Cu, Bi, Hg Tutti i nitrati Nessun Nitrato Tutti i cloruri tranne: Cloruri: AgCl, HgCl, AuCl, PtCl2, CuCl, PbCl2 AgCl, HgCl, AuCl, PtCl2, CuCl, PbCl2 Tutti i bromuri tranne: Bromuri: AgBr, HgBr, AuBr, PtBr2, CuBr, PbBr2 AgBr, HgBr, AuBr, PtBr2, CuBr, PbBr2 Tutti gli Ioduri tranne: Ioduri: AgI, PbI2, HgI, HgI2, CuI AgI, PbI2, HgI, HgI2, CuI Tutti i solfati tranne: Solfati: PbSO4, BaSO4, SrSO4, CaSO4 PbSO4, BaSO4, SrSO4, CaSO4 Carbonati: Tutti i carbonati tranne: (NH4)2CO3, Na2CO3, K2CO3 (NH4)2CO3, Na2CO3, K2CO3 Solfuri: Tutti i solfuri tranne: K2S, Na2S, (NH4)2S K2S, Na2S, (NH4)2S Fosfati: Tutti i fosfati tranne: K3PO4, Na3PO4, (NH4)3PO4 K3PO4, Na3PO4, (NH4)3PO4
- 6. NaCl Na2CO3 BaCl2 Na2SO4 CuSO4 NiSO4 AgNO3 Pb(NO3)2 KI CaCl2 NaCl non soluzione non soluzione soluzione precipitato precipitato non non precipitato opaca precipitato azzurro verde bianco bianco precipitato precipitato incolore incolore trasparente trasparente incolore incolore non non precipitato precipitato Na2CO3 precipitato precipitato precipitato precipitato precipitato precipitato non precipitato bianco bianco azzurro/blu verde marrone bianco precipitato bianco incolore BaCl2 precipitato precipitato precipitato precipitato precipitato non non bianco azzurro verde bianco bianco precipitato precipitato incolore leggermente opaco Na2SO4 soluzione soluzione non precipitato soluzione non azzurro verde precipitato bianco giallo precipitato trasparente trasparente incolore trasparente incolore non non non precipitato precipitato precipitato CuSO4 soluzione soluzione precipitato precipitato soluzione verde azzurro bianco marrone azzurro trasparente trasparente trasparente non non non precipitato precipitato precipitato NiSO4 soluzione precipitato soluzione soluzione verde verde verde verde trasparente trasparente trasparente non non non precipitato precipitato precipitato AgNO3 non precipitato precipitato precipitato giallo bianco incolore Pb(NO3)2 precipitato precipitato giallo/arancio bianco KI non precipitato incolore CaCl2