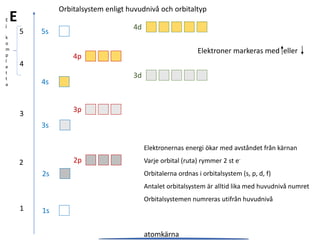
Grundämnenas uppbyggnad orbitaler
- 1. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d Elektronernas energi ökar med avståndet från kärnan Varje orbital (ruta) rymmer 2 st e- Orbitalerna ordnas i orbitalsystem (s, p, d, f) Antalet orbitalsystem är alltid lika med huvudnivå numret Orbitalsystemen numreras utifrån huvudnivå 5 4 3 2 1 atomkärna E j k o m p l e t t a Elektroner markeras med eller Orbitalsystem enligt huvudnivå och orbitaltyp
- 2. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Väte 1s1 (1 elektron) Väte 1s1
- 3. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Helium 1s2 (2 elektroner) Helium 1s2 är en ädelgas eftersom 1s är helt fylld och det inte finns ytterligare elektroner utanför
- 4. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Litium 1s22s1 (3 elektroner) Litium 1s22s1 Litium är en alkalimetall eftersom den har sin enda valenselektron i en s orbital, jämför med natrium
- 5. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Beryllium 1s22s2 (4 elektroner) Beryllium 1s22s2
- 6. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Bor 1s22s22p1 (5 elektroner) Bor 1s22s22p1
- 7. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Neon 1s22s22p6 (10 elektroner) Neon 1s22s22p6 är en ädelgas eftersom både 2s och 2p är helt fyllda och det inte finns ytterligare elektroner utanför
- 8. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Natrium 1s22s22p63s1 (11 elektroner) Natrium 1s22s22p63s1 Natrium är en alkalimetall eftersom den har sin enda valenselektron i en s orbital, jämför med litium Natrium har 1 st valenselektron Dessa elektroner finns i de helt fyllda s och p orbitalerna och är därför inte valenselektroner
- 9. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Klor 1s22s22p6 3s23p5 (17 elektroner) Klor 1s22s22p6 3s23p5 Klor har 7 st valenselektroner samtliga i den 3:e huvudnivån
- 10. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Kalcium 1s22s22p6 3s23p64s2 (20 elektroner) Kalcium 1s22s22p6 3s23p64s2 Dessa elektroner finns i de helt fyllda s och p orbitalerna och är därför inte valenselektroner Kalcium har 2 st valenselektroner Obs vi ser här att 4s kommer före 3d i energinivå
- 11. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Nickel 1s22s22p6 3s23p64s23d8 (28 elektroner) Ni 1s22s22p6 3s23p64s23d8 Nickel har 10 st valenselektroner i den tredje och fjärde huvudnivån
- 12. 2s 1s 3s 4s 5s 2p 3p 4p 3d E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Zink 1s22s22p6 3s23p63d104s2 (30 elektroner) När vi fyllt i den 10:e elektronen i 3d sänks detta orbitalsystem till en energi som är under 4s. Den tredje huvudnivån är nu helt fylld (18e-) och elektronerna i 3d ingår inte längre bland zinks valenselektroner Zink har 2 st valenselektroner i 4s
- 13. 3d 2s 1s 3s 4s 5s 2p 3p 4p E 4d 5 4 3 2 1 atomkärna E j k o m p l e t t a Krypton 1s22s22p6 3s23p63d104s24p6 (36 elektroner) Krypton 1s22s22p6 3s23p63d104s24p6 är en ädelgas eftersom både 4s och 4p är helt fyllda och det inte finns ytterligare elektroner utanför. Ädelgasstruktur