Kimia anorganik 2 unsur transisi golongan viii b
- 2. Pertama kali, besi digunakan oleh bangsa Sumeria dan Mesir, sekitar tahun 4000 SM, benda kecil, seperti mata lembing dan perhiasan, yang didapati dari meteor.
- 3. – Alam semesta : 1100 ppm – Matahari : 1000 ppm – Batu meteor : 2,2 x 105 ppm – Kerak bumi : 63000 ppm – Air laut •Permukaan Atlantik : 1 x 10-4 ppm •Bagian dalam Atlantik : 4 x 10-4 ppm •Permukaan Pasifik : 1 x 10-5 ppm •Bagian dalam Pasifik : 1 x 10-4 ppm
- 4. • Nama, Lambang, Nomor atom : Besi, Fe, 26 • Deret kimia : logam transisi • Golongan, Periode, Blok : 8, 4, d • Massa atom : 55,845 g/mol • Konfigurasi elektron : [Ar] 3d6 4s2 • Jumlah elektron tiap kulit : 2, 8, 14, 2 • Bilangan oksidasi : 2, 3, 4, 6 (oksida amfoter) • Elektronegativitas : 1,83 (skala Pauling) • Jari-jari atom : 140 pm • Jari-jari kovalen : 125 pm • Struktur kristal : Body centred cubic
- 5. • Hemoglobin C2952H4664N812O832S8Fe4 • Besi (II) Sulfat (FeSO4.H2O) • Besi (III) Klorida (FeCl3) • Besi(II) FeCl2 • Besi(III) Fe2Cl6 Oksida • FeO [besi(II)oksida, ferro oksida]; • Fe2O3 [besi(III)oksida; ferri oksida]; • Fe3O4 [ferrosoferrioksida];
- 6. • [FeCl6]3- • [Fe(NH3)6]3+ • Fe(CN)6]3- • [Fe(CO)5]
- 7. • Rel kereta • Perabotan rumah tangga • Alat-alat pertukangan • peralatan mesin • tiang listrik • tiang-tiang penahan gedung • Badan kapal untuk kapal besar.
- 8. • Reaksi dengan Udara 4Fe(s) + 3O2(g) 2Fe2O3(s) • Reaksi dengan halogen 2Fe(s) + 3F2(g) 2FeF3(s)
- 9. • Reaksi dengan Asam Fe(s) + H2SO4(aq) Fe2+ (aq) + SO4 2- (aq) + H2(g)
- 11. Pada tahun 1827, Berzelius dan Osann menguji residu yang tersisa setelah melarutkan platina kasar dari pegunungan Ural dalam aqua regia. Osann menduga bahwa ia telah menemukan tiga logam baru, yang salah-satunya ia namakan rutenium.
- 12. • Rutenium terdapat di alam di dalam bijih yang yang berasal dari pegunungan Ural, Amerika Utara dan Amerika Selatan. • Rutenium dihasilkan secara komersial dalam mineral pentlandit (mineral besi-nikel sulfida, (Fe,Ni)9S8) di daerah Sudbury, Afrika Selatan.
- 13. Sifat fisika dari rutenium adalah sebagai berikut: • Massa jenis (sekitar suhu kamar) 12.45 g/cm³ • Massa jenis cair pada titik lebur 10.65 g/cm³ • Titik lebur 2607 K (2334 °C, 4233 °F) • Titik didih 4423 K (4150 °C, 7502 °F) • Kalor peleburan 38.59 kJ/mol • Kalor penguapan 591.6 kJ/mol • Kapasitas kalor (25 °C) 24.06 J/(mol·K)
- 14. Sifat kimia dari ruthenium adalah sebagai berikut: • Struktur kristal hexagonal • Bilangan oksidasi 2, 3, 4, 6, 8 • Elektronegativitas 2.2 (skala Pauling) • Energi ionisasi pertama: 710.2 kJ/mol • Energi ionisasi ke-2: 1620 kJ/mol • Energi ionisasi ke-3: 2747 kJ/mol • Jari-jari atom 130 pm • Jari-jari kovalen 126 pm
- 15. • [Ru(CO)5] • [Ru(NH3)5(NO2)]+ • [Ru(NH3)5(ONO)]+,
- 16. • Reaksi dengan Udara Ru(s) + O2(g) RuO2(s) • Reaksi dengan halogen Ru(s) + 3F2(g) RuF6(s)
- 17. • Paduan logam • Kontak listrik • Instrumen medis • Katalis
- 18. • Uap Ruthenium tetraoksida (RuO 4 ) menyebabkan iritasi pada kulit, mata, dan sistem pencernaan (mulut, tenggorokan dan paru-paru).
- 19. Pada tahun 1803 osmium ditemukan oleh ahli kimia Inggris Smithson Tennant. Osmium diidentifikasi dalam residu hitam yang tersisa setelah melarutkan bijih platinum dengan aqua regia, campuran 25% asam nitrat (HNO3) dan 75% asam klorida (HCl).
- 20. • Osmium terdapat dalam mineral iridosule dan dalam pasir sungai yang menghasilkan platinum di daerah Ural, Amerika Utara dan Amerika Selatan. • Juga ditemukan dalam bijih mineral yang mengandung nikel di Sudbury
- 21. Sifat-sifat fisika pada osmium ini adalah : • Massa jenis (sekitar suhu kamar) 22.61 g/cm³ • Massa jenis cair pada titik lebur 20 g/cm³ • Titik lebur 3306 K (3033 °C, 5491 °F) • Titik didih 5285 K (5012 °C, 9054 °F) • Kalor peleburan 57.85 kJ/mol • Kalor penguapan 738 kJ/mol • Kapasitas kalor (25 °C) 24.7 J/(mol·K)
- 22. Sifat-sifat kimia pada osmium ini adalah: • Struktur kristal : Hexagonal • Konfigurasi electron : [Xe]5d6 6s2 • Jari-jari ion : 0,63 Å • Bilangan Oksidasi : 2,3, 4, 6,8 • Massa Jenis : 22.6 g/cm3 • Konduktivitas Listrik : 12.3 x 106 ohm-1cm-1 • Elektronegativitas : 2.2 (Skala pauling) • Potensial Ionisasi : 8.7 V • Jari-jari atom : 1,92 Å • Volume Atom : 8.49cm 3 / mol
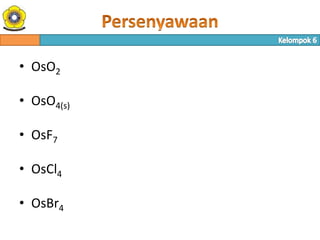
- 23. • OsO2 • OsO4(s) • OsF7 • OsCl4 • OsBr4
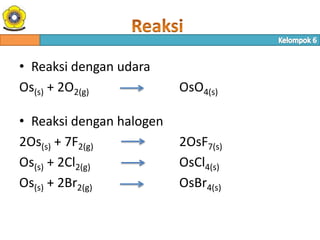
- 24. • Reaksi dengan udara Os(s) + 2O2(g) OsO4(s) • Reaksi dengan halogen 2Os(s) + 7F2(g) 2OsF7(s) Os(s) + 2Cl2(g) OsCl4(s) Os(s) + 2Br2(g) OsBr4(s)
- 25. • Paduan logam • Katalis
- 26. • (OsO 4 ) dapat menyebabkan iritasi pada saluran pernapasan, kulit dan mata.
- 27. Hasium ditemukan oleh Peter Armbruster pada tahun 1984. Nama hasium digunakan untuk mengabdikan nama daerah di Jerman, Hassia yang merupakan tempat penelitian sehingga ditemukan beberapa unsur, yaitu unsur 107,108,109,111,dan 112.
- 28. • Hasium merupakan salah satu unsur logam transisi yang dibuat melalui reaksi fusi nuklir
- 29. • massa atom : (263) sma [277] g/mol • nomor atom : 108 • konfigurasi elektron : 2 8 18 32 32 14 2 • Konfigurasi elektron [Rn] 5f14 6d6 7s2 • Golongan, Periode : VIII b, 7 • Ciri-ciri fisik Fase diduga berbentuk padatan
- 30. • Digunakan dalam penelitian
- 31. • Cotton dan Wilkison. 1989. Kimia Anorganik Dasar. Jakarta : UI-Press • Effendy. 2007. Perspektif Baru Kimia Koordinasi Jilid I. Malang : Bayumedia Publishing • Effendy. 2008. Ikatan Ionik dan Cacat-cacat Pada Kristal Ionik. Malang : Bayumedia Publishing
- 33. Sejarah Penemuan dan Pembuatan Sifat kimia dan fisika Reksi kimia dan persenyawaan Penggunaan dan dampaknya Daftar pustaka Hal-hal penting lainnya



![• Nama, Lambang, Nomor atom : Besi, Fe, 26
• Deret kimia : logam transisi
• Golongan, Periode, Blok : 8, 4, d
• Massa atom : 55,845 g/mol
• Konfigurasi elektron : [Ar] 3d6 4s2
• Jumlah elektron tiap kulit : 2, 8, 14, 2
• Bilangan oksidasi : 2, 3, 4, 6 (oksida amfoter)
• Elektronegativitas : 1,83 (skala Pauling)
• Jari-jari atom : 140 pm
• Jari-jari kovalen : 125 pm
• Struktur kristal : Body centred cubic](https://image.slidesharecdn.com/kimiaanorganik2unsurtransisigolonganviiib-151029183638-lva1-app6891/85/Kimia-anorganik-2-unsur-transisi-golongan-viii-b-4-320.jpg)
![• Hemoglobin C2952H4664N812O832S8Fe4
• Besi (II) Sulfat (FeSO4.H2O)
• Besi (III) Klorida (FeCl3)
• Besi(II) FeCl2
• Besi(III) Fe2Cl6
Oksida
• FeO [besi(II)oksida, ferro oksida];
• Fe2O3 [besi(III)oksida; ferri oksida];
• Fe3O4 [ferrosoferrioksida];](https://image.slidesharecdn.com/kimiaanorganik2unsurtransisigolonganviiib-151029183638-lva1-app6891/85/Kimia-anorganik-2-unsur-transisi-golongan-viii-b-5-320.jpg)
![• [FeCl6]3-
• [Fe(NH3)6]3+
• Fe(CN)6]3-
• [Fe(CO)5]](https://image.slidesharecdn.com/kimiaanorganik2unsurtransisigolonganviiib-151029183638-lva1-app6891/85/Kimia-anorganik-2-unsur-transisi-golongan-viii-b-6-320.jpg)








![• [Ru(CO)5]
• [Ru(NH3)5(NO2)]+
• [Ru(NH3)5(ONO)]+,](https://image.slidesharecdn.com/kimiaanorganik2unsurtransisigolonganviiib-151029183638-lva1-app6891/85/Kimia-anorganik-2-unsur-transisi-golongan-viii-b-15-320.jpg)






![Sifat-sifat kimia pada osmium ini adalah:
• Struktur kristal : Hexagonal
• Konfigurasi electron : [Xe]5d6 6s2
• Jari-jari ion : 0,63 Å
• Bilangan Oksidasi : 2,3, 4, 6,8
• Massa Jenis : 22.6 g/cm3
• Konduktivitas Listrik : 12.3 x 106 ohm-1cm-1
• Elektronegativitas : 2.2 (Skala pauling)
• Potensial Ionisasi : 8.7 V
• Jari-jari atom : 1,92 Å
• Volume Atom : 8.49cm 3 / mol](https://image.slidesharecdn.com/kimiaanorganik2unsurtransisigolonganviiib-151029183638-lva1-app6891/85/Kimia-anorganik-2-unsur-transisi-golongan-viii-b-22-320.jpg)




![• massa atom : (263) sma
[277] g/mol
• nomor atom : 108
• konfigurasi elektron : 2 8 18 32 32 14 2
• Konfigurasi elektron [Rn] 5f14 6d6 7s2
• Golongan, Periode : VIII b, 7
• Ciri-ciri fisik Fase diduga berbentuk padatan](https://image.slidesharecdn.com/kimiaanorganik2unsurtransisigolonganviiib-151029183638-lva1-app6891/85/Kimia-anorganik-2-unsur-transisi-golongan-viii-b-29-320.jpg)



