Kimia XI IPA Laju Reaksi
- 1. Laju Reaksi ANTING SAFITRI (07) MAULIDA IRTAMAZATI H. (20) NABILA SHAFIRA (22) UBAIDILLAH AL RIFQI (31) VESSA RAMADHANI (32)
- 2. LAJU REAKSI DEFINISI Laju berkurangnya konsentrasi zat-zat reaktan atau Laju bertambahnya konsentrasi zat-zat produk persatuan waktu. Bertambah : produk, Berkurang : reaktan
- 3. pA + qB rC + sD ŌĆóA, B adalah reaktan maka terjadi pengurangan ŌĆóC, D adalah produk maka terjadi pertambahan VA = ŌłÆ ╬ö [ĒÉ┤] ╬öĒæĪ VC = + VA : VB : VC : VD = p : q : r : s ╬ö [ĒÉČ] ╬öĒæĪ VB = ŌłÆ ╬ö [ĒÉĄ] ╬öĒæĪ VD = + ╬ö [ĒÉĘ] ╬öĒæĪ Misal Reaksi:
- 4. TEORI TUMBUKAN Teori Tumbukan Tumbukan antar partikel pereaksi, yang memiliki energi yang cukup dan arah yang tepat. Tumbukan Pereaksi Energi cukup Arah tepat
- 5. Tumbukan Tumbukan efektif Yang menghasilkan reaksi Energi Aktifasi (Ea) Energi minimum untuk melewati pembentukan zat antara yang di sebut kompleks teraktifasi Energi penghalang (barier) antara pereaksi dan produk
- 6. A2 + B2 2 AB A B + A B A --- B A --- B A B A B Kompleks teraktifasi Misal: Mekanisme:
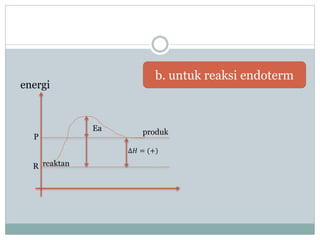
- 7. Berdasarkan energi aktifasi sebagai rintangan yang harus dilewati oleh partikel-partikel pereaksi energi R reaktan P digambarkan pada kurva berikut: Ea ╬öĒÉ╗ = (ŌłÆ) produk Jalan reaksi a. untuk reaksi eksoterm
- 8. energi P R reaktan b. untuk reaksi endoterm Ea produk ╬öĒÉ╗ = (+)
- 9. Faktor Faktor Yang mempengaruhi Laju Reaksi 1. Luas Permukaan/luas bidang sentuh ’āś Syarat: pada benda padat, dan massa harus sama. ’āś Semakin besar luas permukaan, semakin luas bidang sentuh zat padat maka semakin besar peluang terjadi tumbukan, semakin cepat reaksi berlangsung. Luas Permukaan semakin besar Luas bidang sentuh zat padat semakin besar Peluang terjadi tumbukan semakin besar Semakin cepat reaksi berlangsung
- 10. Faktor Faktor Yang mempengaruhi Laju Reaksi ’āś Makin halus ukuran zat padat, makin besar permukaan, makin cepat reaksi berlangsung. Ukuran zat padat halus Permukaan semakin besar Makin cepat reaksi berlangsung
- 11. Faktor Faktor Yang mempengaruhi Laju Reaksi 2. Konsentrasi pereaksi ’āś Semakin besar konsentrasi pereaksi, semakin banyak partikel, tumbukan makin sering terjadi, laju reaksi semakin cepat. Konsentrasi pereaksi semakin besar Semakin banyak partikel Tumbukan sering tejadi Laju reaksi semakin cepat
- 12. Faktor Faktor Yang mempengaruhi Laju Reaksi 3. Tekanan ’āś Syarat: pada benda gas, ’āś Untuk reaksi gas, laju reaksi dipengaruhi oleh tekanan, jika tekanan diperbesar (dimampatkan) berarti volume diperkecil , berarti memperbesar konsentrasi, laju reaksi makin cepat. Tekanan diperbesar Volume diperkecil Memperbesar konsentrasi Laju reaksi semakin besar
- 13. Faktor Faktor Yang mempengaruhi Laju Reaksi 4. Suhu ’āś Jika suhu diperbesar, energi kinetik partikel-partikel zat pereaksi diperbesar, sehingga makin cepat gerakkan partikel mengakibatkan tumbukan sering terjadi, laju reaksi makin cepat. Suhu diperbesar Energi kinetik zat pereaksi dipereaksi diperbesar Makin cepat gerakan partikel Tumbukan sering terjadi Laju reaksi semakin cepat
- 14. Faktor Faktor Yang mempengaruhi Laju Reaksi ’éŚ Semakin besar suhu, semakin besar energi partikel pereaksi, semakin banyak partikel melampaui Ea, reaksi semakin cepat. Suhu semakin besar Energi partikel pereaksi semakin besar Partikel yang melampaui Ea semakin banyak Reaksi semakin cepat
- 15. T2 ŌĆō T1 V ╬öĒæĪ 2 = (╬öV) ├Ś V1 V1 = laju reaksi awal pd T1 V2 = laju reaksi akhir pds T2 T1 = suhu awal T2 = suhu akhir
- 16. Faktor Faktor Yang mempengaruhi Laju Reaksi 5. Katalisator ’āś Katalisator adalah zat yang dapat mempercepat laju reaksi, tetapi zat itu sendiri tidak mengalami perubahan permanen, pada akhir reaksi akan didapatkan kembali. ’āś Katalisator dapat mempercepat reaksi dengan cara menurunkan energi aktifasi dengan menampilkan reaksi alternatif.
- 17. Faktor Faktor Yang mempengaruhi Laju Reaksi ’āś Tahap Reaksi pada reaksi alternatif karena penambahan katalisator disebut mekanisme reaksi. Reaksi yang berlangsung satu tahap disebut reaksi sederhana.



![pA + qB rC + sD
ŌĆóA, B adalah reaktan maka
terjadi pengurangan
ŌĆóC, D adalah produk maka
terjadi pertambahan
VA = ŌłÆ
╬ö [ĒÉ┤]
╬öĒæĪ
VC = +
VA : VB : VC : VD = p : q : r : s
╬ö [ĒÉČ]
╬öĒæĪ
VB = ŌłÆ
╬ö [ĒÉĄ]
╬öĒæĪ
VD = +
╬ö [ĒÉĘ]
╬öĒæĪ
Misal Reaksi:](https://image.slidesharecdn.com/lajureaksi-141010091933-conversion-gate01/85/Kimia-XI-IPA-Laju-Reaksi-3-320.jpg)