LAPORAN PEMURNIAN PROTEIN-NURFITRA AMALIA-178.pdf
- 1. NURFITRA AMALIA ANIL ARYANDI 15020210178 LABORATORIUM KIMIA FARMASI FAKULTAS FARMASI UNIVERSITAS MUSLIM INDONESIA LAPORAN PRAKTIKUM ŌĆ£PEMURNIAN PROTEINŌĆØ NAMA : NURFITRA AMALIA STAMBUK : 15020210178 KELAS/KELOMPOK : C8/4 (EMPAT) ASISTEN : ANIL ARYANDI PROGRAM STUDI SARJANAFARMASI FAKULTAS FARMASI UNIVERSITAS MUSLIM INDONESIA MAKASSAR 2022
- 2. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 BAB 1 PENDAHULUAN 1.1 Latar belakang Secara umum pemurnian protein selalu diawali dengan tahap isolasi protein (pemisahan sel) hingga dihasilkan ekstrak kasar yang mengandung protein. Hal yang membedakan pada protein intraseluler terdapat tahap perusakan sel terlebih dahulu sebelum dilakukan isolasi protein. Perusakkan sel dapat dilakukan secara kimia, fisika, dan enzimatik. Metode pemurnian dapat ditentukan berdasarkan jenis protein yang akan diisolasi serta tingkat kemurnian protein yang diinginkan. Tahap-tahap pemurnian yang akan dilakukan harus disesuaikan dengan jenis protein, maksudnya apakah protein tersebut merupakan protein ekstraseluler atau protein intraseluler. Isolasi protein dapat dilakukan dengan cara sentrifugasi pada kecepatan yang tinggi (5000-10000 rpm) atau presipitasi menggunakan garam seperti ammonium sulfat. Kedua metode tersebut bertujuan menghilangkan molekul atau partikel pengotor dari sel seperti organel sel, karbohidrat atau lipid yang tidak diinginkan agar didapat isolat protein yang murni. Tahap yang selanjutnya adalah memisahkan protein dari senyawa yang berbobot molekul rendah yang berada dalam ekstrak sel dengan proses dialisis. Isolasi protein atau pemurnian protein pada prinsipnya didasarkan atas dua proses utama, yaitu ekstraksi dan pengendapan. Proses terpenting dalam isolasi protein sorgum yaitu proses koagulasi atau pengendapan protein dengan menurunkan pH larutan protein menggunakan asam sampai pH 4,6. Pemurnian protein adalah suatu proses memisahkan protein yang diinginkan dari senyawa lain yang mengganggu dan pemurnianberarti membebaskan suatu bahan dari bahan-bahan lain yang tidak diinginkan atau sering disebut pengotor. Protein harus dipurifikasi
- 3. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 terlebih dahulu agar struktur dan mekanisme kerja suatu protein dapat dipelajari. Hal tersebut karena setiap protein memilikikelarutan dan ukuran massa yang berbeda-beda. Semakin besar ukuran suatu protein, semakin mudah dan efisien pemisahannya. Purifikasi bertujuan untuk menghilangkan kontaminan, mendapatkan konsentrasi protein murni dari suatu suspensi dan dapat memindahkan protein yang diinginkan ke lingkungan stabil agar protein tersebut siap digunakan. SDS-PAGE merupakan metode yang dilakukan untuk memisahkan dan menganalisis protein. Prinsip dari SDS-PAGE adalah protein yang berukuran kecil akan bermigrasi lebih cepat dibanding protein berukuran besar dalam gel yang dialiri muatan listrik. Sodium dodecylsulfate yang digunakan dalam metode SDS-PAGE adalah sejenis detergen bermuatan negatif yang dapat mengikat protein sehingga protein tersebut dapat bermigrasi ke ujung muatan listrik positif pada gel. Ada dua jenis gel yang digunakan dalam SDS-PAGE yaituseparating gel dan stacking gel. Stacking gel berfungsi membentuk well atau sumur yang menjadi tempat loading sampel, sedangkan separating gel berfungsi sebagai tempat migrasi protein. 1.2 Maksud praktikum Adapun maksud dari percobaan ini agar mahasiswa atau mahasiswi dapat mengetahui dan memahami cara pemisahan protein yang diinginkan dalam suatu campuran protein atau pemurnian protein dengan metode elektroforeses gel poliakrilamid (metode SDS-PAGE) 1.3 Tujuan praktikum Adapun tujuan dari percobaan yaitu: 1. Mahasiswa mampu mengetahui dan memahami cara pemisahan protein yang diinginkan dalam suatu campuran protein atau pemurnian protein dengan metode elektroforesis
- 4. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 BAB 2 TINJAUAN PUSTAKA 2.1 Teori umum Istilah biokimia dikemukakan oleh Karl Neuberg, seorang ahli kimia jerman tahun 1903 dan biokimia memperoleh bentuk yang Protein merupakan polimer yang panjang dari gabungan asamasam amino yang bergabung melalui ikatan peptida. Komposisi rata-rata unsur kimia yang terdapat dalam protein adalah karbon 55%, hidrogen 7%, oksigen 23%, nitrogen 16%, sulfur 1%, dan kurang dari 1% fosfor. Molekul protein tersusun dari satuan-satuan dasar kimia yaitu asam amino. Dalam molekul protein, asam-asam amino ini saling berhubungan dengan suatu ikatan yang disebut ikatan peptida (CONH). Satu molekul protein dapat terdiri dari 12 sampai 18 macam asam amino dan dapat mencapai jumlah ratusan asamamino (Aung Sumbono, 2021 : 1). Pemurnian protein terjadi dimana protein yang memiliki residu non polar yang tinggi akan mengendap terlebih dahulu. Protein hidrofobisitas yang tinggi akan mengendap terlebih dahulu dan protein yang mengandung sedikit residu non polar akan larut dalam permurnian dengan garam amonium sulfat (Elvina Maitri Pratantie, dkk., 2021 : 33). Umumnya, pemisahan atau pemurnian dengan kromatografi filtrasi gel merupakan pemurnian akhir setelah pemurnian dengan beberapa langkah sebelumnya. Metode ini tidak bisa digunakanuntuk pemurnian protein setelah tahap pemecahan sel karena terdapat banyak protein dengan ukuran yang sama. Untuk mendapatkan hasil pemurnian protein yang lebih baik, sebaiknya pemurnian tingkat pertama menggunakan kromatografi afinitas atau kromatografi penukar ion sebelum menggunakan kromatografi filtrasi gel. Jika dilakukan pemisahan terhadap sampel oligomerik, sampel yang diinjeksikan harus sangat pekat, untuk mencegah overlapping dari 2
- 5. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 fraksi yang berbeda atau cara lain adalah denganmenggunakan kolom yang lebih panjang (Lale Budi Kusuma Dewi dan Agrijanti, 2021 : 58). Pemurnian protein memiliki dua tujuan utama, yakni tujuan preparatif dan analitis. Tujuan preparatif adalah untuk menghasilkan protein yang cukup murni dengan kuantitas yang besar untuk penggunaan protein, sedangkan tujuan analitis adalah untuk mendapatkan protein yang sangat murni walaupun dalam kadar yang sedikit, biasanya untuk tujuan riset dan analitis. Protein umumnya dapat dipisahkan satu dengan yang lainnya. Pemisahakan tersebut dapat dilakukan dengan beberapa metode yang memanfaatkan sifat-sifat protein. Beberapa sifat protein yang dapat digunakan adalah kelarutan, interaksi ikatan, residu hidrofobik permukaan yang terekspos, residu permukaan bermuatan, titik isoelektrik, serta ukuran dan bentuk (Muhammad Sahlan, 2022 : 24). Penggunaan gel poliakrilamida memiliki kelebihan dibandingkan dengan gel lainnya, karena tidak bereaksi dengan sampel dan tidak membentuk matriks dengan sampel sehingga tidak menghambat pergerakan sampel yang memungkinkan pemisahan protein secara sempurna. Metode SDS-PAGE (Sodium Dodecyl Sulfate Polyacrilamide Gel Electrophoretic) merupakan teknik elektroforesis gel poliakrilamida yang memiliki daya pemisahan fragmen-fragmen molekul cukup tinggi. Penggunaan SDS berfungsi untuk mendenaturasi protein karena SDS bersifat sebagai deterjen yang mengakibatkan ikatan dalam protein terputus membentuk protein yang dapat terelusi (Ibnu Dwi Buwono, dkk., 2018 : 131). Protein merupakan kelompok biomakromolekul yang sangat heterogen. Ketika berada di luar makhluk hidup atau sel, protein sangat tidak stabil. Untuk mempertahankan fungsinya, setiap jenis protein membutuhkan kondisi tertentu ketika diekstraksi. Protein
- 6. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 yang diekstraksi hendaknya dihindarkan dari proteolysis atau dipertahankan aktivitas enzimatiknya. Teknik analisis protein membutuhkan prosedur isolasi, yaitu memisahkan protein dari makromolekul yang lain atau memisahkan protein dengan sifat tertentu dari makromolekul yang lain atau memisahkan protein dengan sifat tertentu dari protein lain yang tidak diinginkan dalam analisis. Isolasi protein harus mempertimbangkan sifat fisik, kimiawi, dan kelistrikan protein, sehingga konformasi dan aktivitasnya tidak berubah. Analisis kuantitatif protein biasanya menggunakan spektrofotometer dengan panjang gelombang tergantung pada jenis protein dan pereaksi yang dipakai (Endik Deni Nugroho dan Dwi Anggorowati Rahayu, 2018 : 118). 2.2 Uraian bahan a. Air Murni / H2O (Ditjen POM, 2020 : 69-70) Nama Resmi : Purified Water Nama Lain : Air murni, Aquadest Rumus Molekul : H2O Rumus Struktur : Berat Molekul : 18,02 g/mol Pemerian : Cairan jernih, tidak berwarna, tidak berbau Penyimpanan : Jika dikemas, gunakan kemasan wadah non reaktif yang dirancang untuk mencegah masuknya mikroba b. Amonium Sulfat / (NH4)2SO4 (Ditjen POM, 1979 : 654) Nama Resmi : Amonium Sulfat Rumus Molekul : (NH4)2SO4
- 7. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 Rumus Struktur : Berat Molekul : 132,14 g/mol Pemerian : Habur tidak berwarna atau butiran putih. Kelarutan : Sangat mudah larut dalam air; praktis tidak larut dalam etanol (95%) P. Penyimpanan : Dalam wadah tertutup rapat. Kegunaan : Zat tambahan. c. Asam Asetat / CH3COOH (Ditjen POM, 2020 : 169) Nama Resmi : Acetic Acid Nama Lain : Asam Asetat Rumus Molekul : CH3COOH Berat Molekul : 60,05 g/mol Rumus Struktur : Pemerian : Cairan jernih, tidak berwarna; bau khas, menusuk; rasa asam yang tajam. Kelarutan : Dapat bercampur dengan air, dengan etanol dan dengan gliserol. Penyimpanan : Dalam wadah tertutup rapat.
- 8. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 d. Asam Klorida (Ditjen POM, 1979: 53) Nama Resmi : ACIDIUM HYDROCHLORIDUM Rumus Molekul : HCl Rumus Struktur : Berat Molekul : 34,46 g/mol Pemerian : Cairan tidak berwarna; berasap; bau merangsang. Jika diencerkan dengan 2 bagian air, asap dan bau hilang. Penyimpanan : Dalam wadah tertutup rapat. Kegunaan : Zat tambahan. e. Metanol / CH3OH (Ditjen POM, 1979 : 706) Nama Resmi : Metanol Rumus Molekul : CH3OH Berat Molekul : 34,00 g/mol Rumus Molekul : Pemerian : Cairan tidak berwarna, jernih, bau khas. Kelarutan : Dapat bercampur dengan air, membentuk cairan jernih tidak berwarna. Penyimpanan : Dalam wadah tertutup rapat. f. Gliserol / C3H8O3 (Ditjen POM, 2020 : 680-682) Nama Resmi : Glycerin
- 9. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 Nama Lain : Gliserin Rumus Molekul : C3H8O3 Berat Molekul : 92,09 g/mol Rumus Struktur : Pemerian : Cairan jernih seperti sirup, tidak berwarna, rasa manis; hanya boleh berbau khaslemah (tajam atau tidak enak). Higroskopik; larutan netral terhadap lakmus. Kelarutan : Dapat bercampur dengan air dan etanol, tidak dapat larut dalam kloroform, dalam eter, dalam minyak lemak, dan dalam minyak menguap. Penyimpanan : Dalam wadah tertutup rapat. g. Gelatin (Ditjen POM, 1979 : 265) Nama Resmi : Gelatinum Pemerian : Lembaran, kepingan, serbuk atau butiran; tidak berwarna atau kekuningan pucat; bau dan rasa lemah. Kelarutan : Jika direndam dalam air mengembang dan menjadi lunak, angsur angsur 5 sampai 10 kali bobotnya; larut dalam air panas dan jika didinginkan terbentuk gudir; praktis tidak larut dalam etanol (95%) P,
- 10. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 dalam kloroform P dan dalam eter P; larut dalam campuran gliserol P dan air, jika dipanaskan lebih mudah larut; larut dalam asam asetat P. Mudah larut dalam air, lebih mudah larut dalam air mendidih. Penyimpanan : Dalam wadah tertutup baik. Kegunaan : Zat tambahan. 2.3 Prosedur kerja(Anonim, 2022) A. Persiapan Gel 1) Dicampurkan semua larutan untuk separating gel. 2) Dituangkan (dengan menggunakan pipet) larutan kedalam gel sandwich sampai kira-kira 1,5 cm dari bagian atas plate. 3) Ditambahkan air sampai ketinggian kira-kira 1 - 5 mm. 4) Didiamkan sampai terjadi polimerisasi (30 menit). 5) Dicampurkan semua larutan untuk stacking gel dengan urutan penambahan sesuai dengan tabel diatas. 6) Dibuang air yang terdapat pada bagian atas separating gel. 7) Dituangkan campuran stacking gel di atas separating gel dan sisipkan comb. 8) Didiamkan sampai terjadi polimerisasi (30 menit). B. Persiapan Sampel 1) Disiapkan larutan protein standar dan sampel protein. 2) Ditambahkan 5 larutan x sample buffer. 3) Dididihkan selama 5 menit. 4) Didinginkan dalam es selama 5 menit. C. Elektroforesis Gel 1) Dipasangkan gel sandwich yang telah disiapkan ke
- 11. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 alatelektroforesis. 2) Dituangkan running buffer ke dalam tank elektroforesis. 3) Dimasukkan sampel protein (10-20 ╬╝g) ke dalam tiap-tiap lubang gel dengan pipet mikro (eppendorf). 4) Dipasang penutup alat elektroforesis. 5) Disambungkan ke power supply dan lakukan elektroforesis pada voltase 200 v. D. Staining dan Destaining 1) Dipasangkan gel sandwich yang telah disiapkan ke alatelektroforesis. 2) Dituangkan running buffer ke dalam tank elektroforesis. 3) Dimasukkan sampel protein (10-20 ╬╝g) ke dalam tiap-tiap lubang gel dengan pipet mikro (eppendorf). 4) Dipasang penutup alat elektroforesis. 5) Disambungkan ke power supply dan lakukan elektroforesis pada voltase 200 v. 6) Dimatikan alat setelah blue dye tepat keluar dari gel(kira- kira 60 menit). Staining dan Destaining 7) Dikeluarkan gel dari plate (gunakan sarung tangan). 8) Dimasukkan ke dalam larutan staining (20 mL). 9) Dibiarkan selama 15 menit. 10) Dipindahkan ke dalam larutan destaining (50 mL). 11) Dibiarkan sampai gel menjadi bersih (30 menit-semalam). 12) Pembacaan data pita protein (berdasarkan berat molekul) menggunakan alat Gel documentation.
- 12. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 BAB 3 METODE KERJA 3.1 Alat Praktikum Adapun alat-alat yang digunakan dalam praktikum ini antara Bio Rad Mini Radian, power supply, tabung eppendorf dan gel loading tips 3.2 Bahan Praktikum Adapun bahan-bahan yang digunakan dalam praktikum, antara lain yaitu Akrilamid : bis-akrilamid (39 :1), Tris-HCl pH 6,8 lM, Tris-HCl pH 8,7 lM, SDS 20%, N,N,NŌĆØ ,NŌĆØ - tetrametiletilendiamin (TEMED), Amonium persulfat 10 %, Running buffer (1 gr SDS 3,03 gr Tris, 14,4 gr glisin, ditambahkan air sampai dengan 100 mL), Larutan stanning 940 mL metanol, 15mL asam asetat, 0,1 gr Coomasie blue, ditambahkan air sampai dengan 100 mL), Larutan destaining (10 mL metanol, 7,5 mL asam asetat, ditambahkan air sampai dengan 100 mL), 5 x Sample buffer (12,5 mL 1 M tris pH 6,8 20 ml, gliserol, 10 mL - merkaptoethanol, 40 mL 10 % SDS, 15 mg Bromophenol Blue. 3.3 Cara Kerja 1. Persiapan Gel Dicampurkan semua larutan untuk separating gel. Tuangkan (dengan menggunakan pipet) larutan kedalam gel sandwich sampai kira-kira 1,5 cm dari bagian atas plate. Tambahkan air sampai ketinggian kira-kira 1 ŌĆō 5 mm. Diamkan sampai terjadi polimerisasi (30 menit). Campurkan semua larutan untuk stacking gel dengan urutan penambahan sesuai dengan tabel diatas. Buang air yang terdapat pada bagian atas separating gel. Tuangkan campuran stacking gel di atas separating gel dan sisipkan comb. Diamkan sampai terjadi polimerisasi (30 menit).
- 13. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 2. Persiapan Sampel Disiapkan larutan protein standar dan sampel protein. Tambahkan larutan 5 x sample buffer. Didihkan selama 5menit. Dinginkan dalam es selama 5 menit. 3. Elektroforesis Gel Dipasangkan gel sandwich yang telah disiapkan kealat elektroforesis. Tuangkan running buffer kedalam tank elektrofresis. Masukan sampel protein (10-20 ╬╝g) kedalam tiap- tiap lubang gel dengan pipet mikro (eppendorf). Pasang penutup alat elektroforesis. Sambungkan ke power supply dan lakukan elektroforesis pada voltase tetap 200 v. Matikan alat setelah blue dye tepat keluar dari gel (kira-kira 60 menit). 4. Uji Barfoed Dikeluarkan gel dari plate (gunakan sarung tangan). Masukkan kedalam larutan staining (20 mL) Biarkan selama 15 menit Pindahkan kedalam larutan destaining (50 mL) Biarkan sampai gel menjadi bersih (30 menit- semalam) Pembacaan data Pita protein (berdasarkan berat molekul) menggunakan alat Gel documentation.
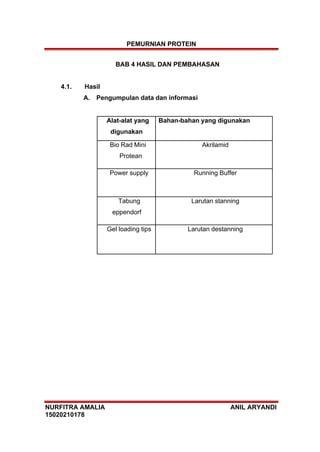
- 14. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 BAB 4 HASIL DAN PEMBAHASAN 4.1. Hasil A. Pengumpulan data dan informasi Alat-alat yang digunakan Bahan-bahan yang digunakan Bio Rad Mini Protean Akrilamid Power supply Running Buffer Tabung eppendorf Larutan stanning Gel loading tips Larutan destanning
- 15. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178
- 16. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 B. Pencatatan dan Pelaporan Pengamatan data Berat molekul Marker protein 200 kDa, 159 kDa, 112 kDa, 89 kDa, 48kDa, 35 kDa, 24 kDa. Sampel 1-9 200 kDa Sampel 1-9 159 kDa ŌĆō 112 kDa Sampel 1-9 24 kDa 4.2. Pembahasan Pada cara kerja teknik yang digunakan untuk percobaan kali ini ialah menyiapkan tube atau tabung yang berisi sampel protein dan siapkan juga loading buffer yang berisi SDS, bromophenol blue, Bmercaptoethanol dan gliserol. Kemudian larutan yang berada dalam loading buffer dipipet masuk ke dalam tabung yang berisi sampel protein. Setelah itu dilakukan pemanasan dengan suhu 95 . Pada saat pemanasan, terjadi perubahan struktur protein yang terdapat pada tabung tersebut. Setelah itu disiapkan gel yaitu separating gel dengan pH 8.8 dan stacking gel dengan pH 6.8. Untuk kedua gel berisi acrylamide, bis- acrylamide, ammonium persulphate dan TEMED. Gel acrylamide dimasukkan ke antara dua plat kaca. Masukkan separating gel dibagian bawah karena berfungsi sebagai gel pemisah. Selanjutnya masukkan stacking gel pada bagian atas separating gel yang berfungsi sebagai gel penahan.
- 17. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 Kemudian dibuat sumur-sumur dengan tujuan sebagai tempat memasukkan sampel. Setelah itu,gel yang telah dicetak dimasukkan pada separangkat alat elektroforesis dan dimasukkan kedalam chamber. Sebelum pemisahan (running), terlebih dahulu dimasukkan larutan running buffer pH 8.3, running buffer tersebut harus merendam seluruh gel yang telah dibuat. Proses pemisahan (running) dilakukan dengan cara gel dialiri arus listrik. Kemudian terjadinya proses migrasi yaitu sampel protein akan bergerak dari kutub negatif ke kutub positif karena protein itu sendiri memiliki muatan negatif. Jika suatu protein memiliki bobot molekul yang kecil maka akan lebih cepat bergerak ke kutub positif, sedangkan jika suatu protein memiliki bobot molekul yang besar maka akan lebih lambat bergerak ke kutub positif. pH stacking dan separating sangat berpengaruh karena untuk mendapatkan proses migrasi yang sempurna. Jika telah selesai proses pemisahan atau migrasi, maka dilakukan proses visualisasi dengan melihat berat molekul atau pitanya. Pada proses ini ditambahkan pewarna yaitu coomasie blue. Coomasie blue dimasukkan dalam suatu wadah dan gel elektroforesisnya direndam. Setelah itu hasilnya akanterlihat. Pada percobaan ini, marker proteinnya memiliki beratmolekul yaitu 200 kDa, 159 kDa, 112 kDa, 89 kDa, 48kDa, 35 kDa, 24 kDa. Pada sampel 1-9 (1) didapatkan hasil = 220 kDa dan hal ini berarti sampel 1 -9 berat molekul yang terbesar ialah 220 m Pada sampel 1-9 (2) didapatkan data yaitu Sampel 2 = 159-112 kDa pada berat molekul tersebut hasil yang diperoleh sangat terang dan terletak pada (ß╝Ć1) dan (ß╝Ć2) Pada Sampel 1-9 (3) didapatkan data Sampel 1-9 = 24 kDa pada berat molekul tersebut hasilnya terlihat pada semua sampel.
- 18. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 BAB 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan Sodium Dodecyl Sulphate Polyacrilamide Gel Elektroforesis (SDS- PAGE) adalah teknik untuk memisahkan rantai polipeptida pada protein berdasarkan kemampuannya untuk bergerak dalam arus listrik, yang merupakan fungsi dari panjang rantai polipeptida atau berat molekulnya. Proses pemisahan (running) dilakukan dengan cara gel dialiri arus listrik. Pada percobaan ini, marker proteinnya memiliki berat molekul yaitu 200 kDa, 159 kDa, 112 kDa, 89 kDa, 48kDa, 35 kDa, 24 kDa.Pada sampel 1-9 (1) didapatkan hasil = 220 kDa dan hal ini berarti sampel 1 -9 berat molekul yang terbesar ialah 220 m Pada sampel 1-9 (2) didapatkan data yaitu Sampel 2 = 159-112 kDa pada berat molekul tersebut hasil yang diperoleh sangat terang dan terletak pada (ß╝Ć1) dan (ß╝Ć2) Pada Sampel 1-9 (3) didapatkan data Sampel 1-9 = 24 kDa pada berat molekul tersebut hasilnya terlihat pada semua sampel. 5.2 Saran Saran yang dapat diambil dari percobaan pemurnian protein yaitu praktikan harus memahami lebih banyak materi mengenai pemurnian protein serta cara kerja dan mekanismereaksi pada setiap uji dalam melakukan suatu percobaan. Praktikan juga harus berhati hati dan teliti dalam melihat reaksi perubahan yang terjadi agar terhindar dari kesalahan yang tidak diinginkan dan mendapatkan hasil yang lebih akurat.
- 19. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 DAFTAR PUSTAKA Anonim. 2022. Penuntun Praktikum Biokimia. Makassar: Fakultas Farmasi UMI. Buwono, Ibnu Dwi Buwono., dkk. 2018. Buku Ajar Aplikasi Teknologi DNA Rekombinan Untuk Perakitan Konstruksi Vektor Ekspresi Ikan Lele Transgenik. Yogyakarta: Deepublish Publisher. Dewi, Lale Budi Kusuma dan Agrijanti. 2021. Pemisahan dan Penentuan Karakter Fraksi Protein ESA Toxoplasma gondii Secara Immunologik Untuk Pengembangan Diagnosa. Jurnal Analis Medika Biosains (JAMBS), 8(1), 53-59. Ditjen POM. 1979. Farmakope Indonesia edisi III 1979. Depkes RI, Jakarta. Ditjen POM. 2020. Farmakope Indonesia edisi VI 2020. Depkes RI, Jakarta. Nugroho, Endik Deni dan Dwi Anggorowati Rahayu. 2018. Penuntun Praktikum Bioteknologi. Yogyakarta: Deepublish Publisher. Pratantie, Elvina Maitri., V. Priyo Bintoro, dan Bambang Dwiloka. 2021. Isolasi Enzim Amilase Dari Kecambah Kacang Tunggal (Vigna unguiculata). Jurnal Ilmiah Teknosains, 7(1/Mei), 29-35. Sahlan, Muhammad. 2022. Rekayasa Protein. Bogor: Guepedia. Sumbono, Aung. 2021. Protein Seri Biokimia Pangan Dasar. Yogyakarta: Deepublish Publisher.
- 20. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 LAMPIRAN a. Data hasil pengamatan praktikum
- 21. PEMURNIAN PROTEIN NURFITRA AMALIA ANIL ARYANDI 15020210178 b. Dokumentasi praktikum