Larutan asam basa
- 1. LARUTAN ASAM BASA Kelas XI semester 2 By. Andriyani, S.Pd
- 2. SK/KD Standar Kompetensi: 4. Memahami sifat-sifat larutan asam-basa, metode pengukuran, dan terapannya Kompetensi Dasar: 4.1 . Mendeskripsikan teori-teori asam basa dengan menentukan sifat larutan dan menghitung pH larutan . chemistry
- 3. Indikator Pembelajaran Menjelaskan pengertian asam dan basa menurut Arrhenius Menjelaskan pengertian asam dan basa menurut Bronsted dan Lowry Menuliskan persamaan reaksi asam dan basa menurut Bronsted dan Lowry dan menunjukkan pasangan asam dan basa konjugasinya Menjelaskan pengertian asam dan basa menurut Lewis chemistry
- 4. Larutan Asam Basa A. Konsep Asam Basa Teori Asam Basa Arhennius Asam : Zat yang dalam air menghasilkan ion H + Cth : HCl H + + Cl - (Asam Valensi 1) H 2 SO 4 2H + + SO 4 2- ( Asam Valensi 2) chemistry
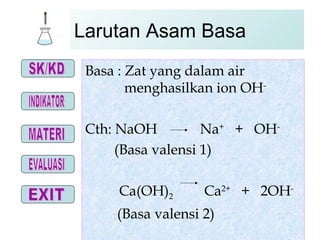
- 5. Larutan Asam Basa Basa : Zat yang dalam air menghasilkan ion OH - Cth: NaOH Na + + OH - (Basa valensi 1) Ca(OH) 2 Ca 2+ + 2OH - (Basa valensi 2) chemistry
- 6. Larutan Asam Basa chemistry
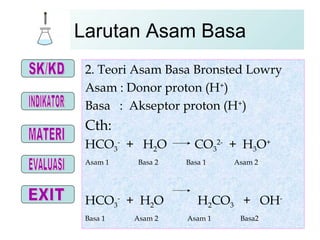
- 7. Larutan Asam Basa 2. Teori Asam Basa Bronsted Lowry Asam : Donor proton (H + ) Basa : Akseptor proton (H + ) Cth: HCO 3 - + H 2 O CO 3 2- + H 3 O + Asam 1 Basa 2 Basa 1 Asam 2 HCO 3 - + H 2 O H 2 CO 3 + OH - Basa 1 Asam 2 Asam 1 Basa2 chemistry
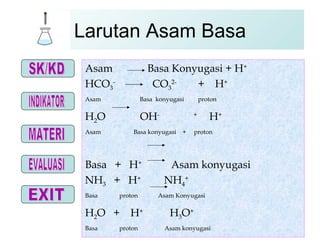
- 8. Larutan Asam Basa Asam Basa Konyugasi + H + HCO 3 - CO 3 2- + H + Asam Basa konyugasi proton H 2 O OH - + H + Asam Basa konyugasi + proton Basa + H + Asam konyugasi NH 3 + H + NH 4 + Basa proton Asam Konyugasi H 2 O + H + H 3 O + Basa proton Asam konyugasi chemistry
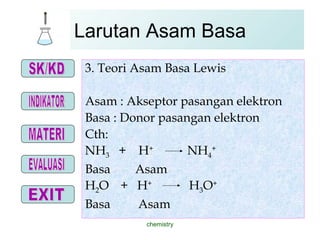
- 9. Larutan Asam Basa 3. Teori Asam Basa Lewis Asam : Akseptor pasangan elektron Basa : Donor pasangan elektron Cth: NH 3 + H + NH 4 + Basa Asam H 2 O + H + H 3 O + Basa Asam chemistry
- 10. Diskusikan dalam kelompokmu No.7 a dan b hal 174, 36 a dan b, 37,38,39 dan 41. chemistry
- 11. LARUTAN ASAM BASA Terima Kasih...