Larutan penyangga SMA
- 1. LARUTAN PENYANGGA KELAS XII Ipa Oleh: Syahriani
- 2. • Menyelidiki sifat larutan penyangga dan menerapkannya untuk menjelaskan peranan larutan penyangga dalam tubuh makhluk hidup dan kehidupan sehari-hari
- 3. • Mengukur pH larutan penyangga dan bukan larutan penyangga setelah ditambah sedikit asam, sedikit basa, atau pengenceran • Menurunkan persamaan untuk menentukan H+ atau OH- suatu larutan penyangga • Menghitung pH atau pOH larutan penyangga dengan menggunakan prinsip kesetimbangan. • Menghitung pH larutan penyangga pada penambahan sedikit asam , basa , atau pengenceran
- 4. • Menyimpulkan pengertian dan peranan larutan penyangga berdasarkan hasil pengukuran • Menjelaskan fungsi larutan penyangga dalam tubuh makhluk hidup dan kehidupan sehari-hari
- 5. Materi Pokok - Larutan Penyangga
- 6. Sebagian besar reaksi kimia dalam industri maupun dalam tubuh manusia memerlukan pH stabil . Agar kondisi pH tidak berubah biasanya digunakan larutan penyangga
- 7. • Larutan penyangga adala
- 8. Komponen pembentuk larutan penyangga ? A. Campuran Asam Lemah dengan basa Konjugasinya. CH3COOH dan CH3COO- dengan garam pembentuk basa konjugasi CH3COONa , CH3COOK dll.
- 9. B.Campuran Basa Lemah dengan Asam Konjugasinya. NH4OH dan NH4+ dengan garam pembentuk basa konjugasi NH4Cl , (NH4)2SO4
- 10. Sifat larutan Penyangga Apakah yang terjadi jika kedalam larutan penyangga ditambah sedikit asam,basa maupun pengenceran ?
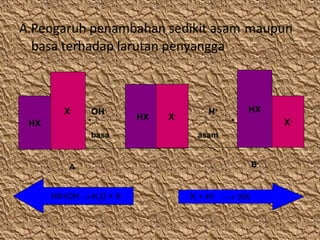
- 11. A.Pengaruh penambahan sedikit asam maupun basa terhadap larutan penyangga X- OH- HX basa HX X - H+ HX X- asam B A HX+OH- H2O + X- X- + H+ HX
- 12. Jadi pengaruh penambahan sedikit asam atau sedikit basa pada campuran asam lemah dengan basa konjugasinya tidak mengubah harga pH
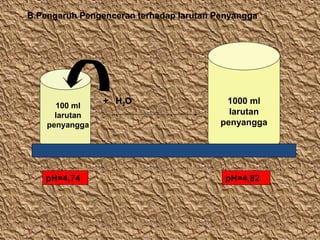
- 13. B.Pengaruh Pengenceran terhadap larutan Penyangga 100 ml larutan penyangga pH=4,74 + H2O 1000 ml larutan penyangga pH=4,82
- 14. Jadi untuk pengenceran , pH larutan dianggap tidak mengalami perubahan.
- 16. 1.Larutan Penyangga dari asam lemah dan basa konjugasinya CH3COONa(aq) CH3COOH(aq) CH3COO-(aq) + Na+(aq) CH3COO-(aq) + H+(aq)
- 17. − + [CH 3 COO ][ H ] Ka = [CH 3 COOH ] [CH 3COOH ]mol / ltr [ H ] = Ka. − [CH 3COO ]mol / ltr + Berasal dari garam
- 18. [ na ] [ H ] = Ka. [ ng ] + Untuk basa konjugasi yang memiliki 2 anion maka : [na ] [ H ] = Ka. [2ng ] +
- 19. 2.Larutan penyangga dari basa lemah dan asam konjugasi • NH4Cl(aq) NH4OH(aq) NH4+(aq) + Cl-(aq) NH4+(aq)+OH-(aq)
- 20. + − [ NH 4 ][OH ] Kb = [ NH 4OH ] [ NH 4OH ]mol / ltr [OH ] = Kb. + [ NH 4 ]mol / ltr − Berasal dari garam
- 21. [nb] [OH ] = Kb. [ng ] − Untuk basa konjugasi yang memiliki 2 anion maka : [nb] [OH ] = Kb. [2ng ] −
- 22. Apa fungsi larutan penyangga dalm tubuh makhluk hidup serta apa kegunaannya dalam kehidupan sehari-hari ?
- 23. a. Dalam bidang kesehatan Contoh obat suntik , obat tetes mata b. Dalam tubuh manusia Sistem larutan penyangga dalam sel Sistem larutan penyangga dalam cairan antar sel Sistem larutan penyangga dalam darah














![−
+
[CH 3 COO ][ H ]
Ka =
[CH 3 COOH ]
[CH 3COOH ]mol / ltr
[ H ] = Ka.
−
[CH 3COO ]mol / ltr
+
Berasal dari garam](https://image.slidesharecdn.com/larutanpenyangga-140213214132-phpapp01/85/Larutan-penyangga-SMA-17-320.jpg)
![[ na ]
[ H ] = Ka.
[ ng ]
+
Untuk basa konjugasi yang memiliki 2 anion maka :
[na ]
[ H ] = Ka.
[2ng ]
+](https://image.slidesharecdn.com/larutanpenyangga-140213214132-phpapp01/85/Larutan-penyangga-SMA-18-320.jpg)

![+
−
[ NH 4 ][OH ]
Kb =
[ NH 4OH ]
[ NH 4OH ]mol / ltr
[OH ] = Kb.
+
[ NH 4 ]mol / ltr
−
Berasal dari garam](https://image.slidesharecdn.com/larutanpenyangga-140213214132-phpapp01/85/Larutan-penyangga-SMA-20-320.jpg)
![[nb]
[OH ] = Kb.
[ng ]
−
Untuk basa konjugasi yang memiliki 2 anion maka :
[nb]
[OH ] = Kb.
[2ng ]
−](https://image.slidesharecdn.com/larutanpenyangga-140213214132-phpapp01/85/Larutan-penyangga-SMA-21-320.jpg)

