CHE 03: Nazvoslovi, stechiometrie, chemicke rovnice
- 1. Imagecreatedathttp://wordle.net/ Anorganick├® n├Īzvoslov├Ł. V├Įpo─Źty slo┼Šen├Ł. Stechiometrie. Rovnice. Jan Gr├®gr & Martin Slav├Łk CHE 03 Katedra chemie FP TUL: http://www.kch.tul.cz
- 2. Pro─Ź n├Īzvoslov├Ł? ’é¦ Z├Īkladn├Ł jazyk pro dorozum─øn├Ł mezi chemiky ’é¦ V├Įpo─Źet slo┼Šen├Ł slou─Źenin v % ’é¦ V├Įpo─Źet hmotnosti l├Ītek v reakci ’é¦ Odhad vlastnost├Ł ze vzorce ’é¦ Bude v testu :-) Nejd┼»le┼Šit─øj┼Ī├Ł pom┼»cky ’é¦ Periodick├Ī tabulka ’é¦ Mozek
- 3. Mol Mol: po─Źet ─Ź├Īstic (atom┼», molekul, iont┼») rovn├Į po─Źtu atom┼» uhl├Łku ve 12,00 g 12C. 1 mol = 6,022├Ś1023 ─Ź├Īstic (Avogadrovo ─Ź├Łslo). Objem 1 molu ide├Īln├Łho plynu za norm├Īln├Łch podm├Łnek (pŌłÖV=nŌłÖRŌłÖT; p = 101325 Pa, R = 8,314 J┬ĘK- 1mol- 1, T = 273,15 K) Vm = 22,41 dm3.mol-1 Mol├Īrn├Ł hmotnost, M = hmotnost 1 molu ─Ź├Īstic [g.mol-1]. prvky = atomov├Ī hmotnost ŌåÆ periodick├Ī tabulka ’é¦ 1 mol vody H2O zauj├Łm├Ī objem asi 18 ml a je v n─øm obsa┼Šeno 6,022├Ś1023 molekul. ’é¦ 1 mol zlata Au zauj├Łm├Ī objem asi 10 ml a je v n─øm obsa┼Šeno 6,022├Ś1023 atom┼». ’é¦ 1 mol vod├Łku H2 zauj├Łm├Ī objem asi 22,4 l a je v n─øm obsa┼Šeno 6,022├Ś1023 molekul.
- 4. L├Ītkov├® mno┼Šstv├Ł L├Ītkov├® mno┼Šstv├Ł, n je po─Źet ─Ź├Īstic v molech. ’é¦ Jak├Ī je hmotnost 5,0 mol┼» NaCl ’é¦ Kolik mol┼» NaCl je v 15 g NaCl ’é¦ Kolik molekul je ve 3 molech NaCl Mol├Īrn├Ł hmotnost slou─Źeniny = ╬Ż mol├Īrn├Ł hmotnost prvku ├Ś po─Źet atom┼» prvku ’Ć© ’Ć® ’Ć© ’Ć® ’Ć© ’Ć® ’Ć© ’Ć® ...... ’Ć½’āŚ’Ć½’āŚ’Ć½’āŚ’ĆĮ CMzBMyAMxCBAM zyx z tabulky M(NaCl)=22,99+35,45=58,44 g/mol 5 mol ├Ś 58,44 g/mol = 292,2 g n(NaCl)=15 g/58,44 g/mol = 0,257 mol N(NaCl)= 3 mol ├Ś 6,022├Ś1023 mol-1
- 5. Borax Tetraboritan disodn├Į CAS: 1303-96-4 EINECS: 215-540-4 Na2B407 ŌłÖ10H2O Chemick├® identifik├Ītory http://www.chemspider.com/ InChI=1S/B4O7.2Na.10H2O/c5-1-7-3-9-2(6)10-4(8-1)11-3; ;;;;;;;;;;;/h;;;10*1H2/q-2;2*+1;;;;;;;;;; IUPAC International Chemical Identifier (InChI) Standardized InChIKey (otisk, hash, fingerprint InChi): CDMADVZSLOHIFP-UHFFFAOYSA-N ’é¦ voln─ø pou┼Šiteln├Į ’é¦ odvoditeln├Į ze struktury ’é¦ srozumiteln├Į 25 znakov├Į k├│d vznikl├Į hashov├Īn├Łm
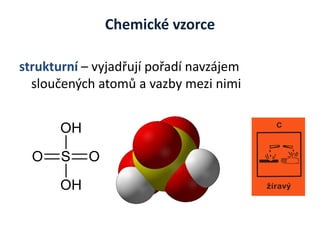
- 6. Chemick├® vzorce strukturn├Ł ŌĆō vyjad┼Öuj├Ł po┼Öad├Ł navz├Ījem slou─Źen├Įch atom┼» a vazby mezi nimi O OH S OH O
- 7. Chemick├® vzorce Elektronov├® ’é¦ vyzna─Źuj├Ł elektrony NN O O O OC Cl Cl H H N H I I II I I I II II I I III I Vaznost = po─Źet kovalentn├Łch vazeb vych├Īzej├Łc├Łch z atomu ’é¦ charakteristick├Ī pro prvky vazebn├® nevazebn├® N-3 O-2 C-4 Cl-1 H-1 Atomy (mimo H) sd├Łl├Ł 8 elektron┼» H sd├Łl├Ł __ elektron/y Kter├Į plyn je t─ø┼Š┼Ī├Ł ne┼Š vzduch?
- 8. Oxida─Źn├Ł ─Ź├Łslo ’é¦ Ud├Īv├Ī stupe┼ł oxidace atomu ve slou─Źenin─ø. P┼Öedstavuje n├Īboj v rozmez├Ł: -4 a┼Š +8 (-IV a┼Š +VIII). ’é¦ Voln├® atomy a atomy v molekul├Īch prvk┼»: 0 ’é¦ Oxida─Źn├Ł ─Ź├Łslo vod├Łku ve v─øt┼Īin─ø slou─Źenin: +I V├Įjimka ŌĆō slou─Źeniny vod├Łku s kovy (hydridy): -I ’é¦ Oxida─Źn├Ł ─Ź├Łslo kysl├Łku ve v─øt┼Īin─ø slou─Źenin: -II V├Įjimka ŌĆō peroxidy: -I Sou─Źet oxida─Źn├Łch ─Ź├Łsel v┼Īech atom┼» v molekule je roven 0, v iontu n├Īboji iontu z tabulky
- 9. Oxida─Źn├Ł ─Ź├Łslo ŌĆó Fluor m├Ī oxida─Źn├Ł ─Ź├Łslo -I , hlin├Łk +III ŌĆó Alkalick├® kovy (IA. skupina, Li, Na, K) maj├Ł oxida─Źn├Ł ─Ź├Łslo +I ŌĆó Kovy alkalick├Įch zemin (IIA. skupina, Be, Mg, Ca, Sr, Ba) maj├Ł oxida─Źn├Ł ─Ź├Łslo +II ŌĆó Kovy maj├Ł ve slou─Źenin├Īch jen kladn├Ī oxida─Źn├Ł ─Ź├Łsla (s v├Įjimkou n─økter├Įch komplexn├Łch slou─Źenin)
- 10. ABA
- 11. Pro zapamatov├Īn├Ł po┼Öad├Ł prvk┼» I. Helenu L├Łbal Na Kolena Robustn├Ł Cest├Ī┼Ö Franta II.A B─ø┼Šela Magda Ca┼łonem, Sr├Ī┼Šela Ban├Īny R├Īdiem VI.A O Sle─Źno, Sejm─øte T├®┼Š Podprsenku VII.A Fousat├Į Chlap Brousil Ivan─ø Ant├®nu R├Īno Lanthanoidy: Lacin├® Ceny Prasat Nedovolily Prom├®theovi Sm├®sti Europu, Gdy┼Š Th├®by D├Įchaly Horkou Erotickou Tmou Ybi┼Īku Lu─Źn├Łho v├ŁceŌĆ”
- 12. P┼Öedpov─ø─Å oxida─Źn├Łch ─Ź├Łsel ’é¦ A ŌĆō maxim├Īln├Ł oxida─Źn├Ł ─Ź├Łslo = ─Ź├Łslo skupiny ’é¦ B ŌĆō maxim├Īln├Ł oxida─Źn├Ł ─Ź├Łslo = v─øt┼Īinou ─Ź├Łslo skupiny A B Kovy = kationty Nekovy ŌĆō anionty minim├Īln├Ł oxida─Źn├Ł ─Ź├Łslo = ─Ź├Łslo skupiny - 8
- 13. 2.5 A
- 14. B
- 15. Ca v CaO +2 Ca2+ +2 Cl’ĆŁ ’ĆŁ1 Cr v Cr2O3 +3 Fe v Fe2O3 +3 Cr v K2Cr2O7 +6 Na 11 proton┼» 11 elektron┼» Na+ 11 proton┼» 10 elektron┼» Cl 17 proton┼» 17 elektron┼» Cl- 17 proton┼» 18 elektron┼» D┼»le┼Šitost oxida─Źn├Łho ─Ź├Łsla Stejn├® atomy maj├Ł r┼»zn├® vlastnosti podle oxida─Źn├Łch ─Ź├Łsel reaktivn├Ł nereaktivn├Ł Konfigurace vz├Īcn├®ho plynu Video BRAINIAC
- 16. Stejn├® atomy maj├Ł r┼»zn├® vlastnosti podle oxida─Źn├Łch ─Ź├Łsel Video BRAINIAC
- 17. 17 Pokus ’é¦ Stoup├Ī/kles├Ī reaktivita ve skupin─ø? ’é¦ Pro─Ź? ’é¦ Co vznikne reakc├Ł s vodou? ’é¦ Jak├Ī vazba je mezi atomy Na? ’é¦ Vlastnosti Na? ’é¦ P┼Ö├Łprava Na? ’é¦ Slou─Źeniny Na? ’é¦ Vlastnosti slou─Źenin Na? ’é¦ N├Īzvy slou─Źenin? ’é¦ ŌĆ”
- 18. Bin├Īrn├Ł slou─Źeniny Z├Īporn├Ī oxida─Źn├Ł ─Ź├Łsla nekovov├Įch prvk┼» se pohybuj├Ł v rozmez├Ł ŌĆōI a┼Š ŌĆōIV. Podstatn├® jm├®no je potom odvozeno od z├Īkladu mezin├Īrodn├Łho n├Īzvu prvku zakon─Źen├Łm ŌĆōid, nap┼Ö. halogenid (fluorid, chlorid atd.) FŌĆōI, ClŌĆōI oxid, sulfid, selenid OŌĆōII, SŌĆōII, SeŌĆōII borid, nitrid, fosfid, arsenid BŌĆōIII, NŌĆōIII, PŌĆōIII, AsŌĆōIII karbid, silicid CŌĆōIV, SiŌĆōIV CrCl3 Fe2O3CrO3 M+X-
- 19. Karbidy U karbid┼» nen├Ł n├Īzvoslov├Ł zcela jednozna─Źn├®. U mnoha technick├Įch karbid┼» nelze oxida─Źn├Ł ─Ź├Łslo kovu ur─Źit a pou┼Š├Łv├Ī se obecn├Į n├Īzev karbid kovu, karbid ┼Šeleza Fe3C (cementit) Pozn├Īmka: CaC2 karbid v├Īpenat├Į trivi├Īln├Ł n├Īzev, ve skute─Źnosti acetylid (ethynid) v├Īpenat├Į (v├Īpenat├Ī s┼»l odvozen├Ī od acetyl├®nu)
- 20. Oxida─Źn├Ł ─Ź├Łslo zakon─Źen├Ł n├Īzvu Bin├Īrn├Ł slou─Źeniny, Kationty (+) Kyseliny Soli Anionty (-) I ŌĆō n├Į ŌĆō n├Ī ŌĆō nan ŌĆō nanov├Į II ŌĆō nat├Į ŌĆō nat├Ī ŌĆō natan ŌĆō natanov├Į III ŌĆō it├Į ŌĆō it├Ī ŌĆō itan ŌĆō itanov├Į IV ŌĆō i─Źit├Į ŌĆō i─Źit├Ī ŌĆō i─Źitan ŌĆō i─Źitanov├Į V ŌĆō i─Źn├Į, ŌĆō e─Źn├Į ŌĆō i─Źn├Ī, ŌĆō e─Źn├Ī ŌĆō i─Źnan, ŌĆō e─Źnan ŌĆō i─Źnanov├Į, ŌĆō e─Źnanov├Į VI ŌĆō ov├Į ŌĆō ov├Ī ŌĆō an ŌĆō anov├Į VII ŌĆō ist├Į ŌĆō ist├Ī ŌĆō istan ŌĆō istanov├Į VIII ŌĆō i─Źel├Į ŌĆō i─Źel├Ī ŌĆō i─Źelan ŌĆō i─Źelanov├Į Pojmenov├Īv├Īn├Ł slou─Źenin Oxida─Źn├Ł ─Ź├Łslo ur─Źuje n├Īzev slou─Źeniny!
- 21. N├Īzvoslov├Ł ’é¦ N├Īzvoslov├Ł hydroxid┼» a oxokyselin hydroxid v├Īpenat├Į CaII(OH)2 ŌĆōI kyselina s├Łrov├Ī H2SO4 ’é¦ N├Īzvoslov├Ł iont┼» kationt sodn├Į Na+ kationt amonn├Į NH4 + kation oxoniov├Į H3O+
- 22. N├Īzvoslov├Ł ’é¦ N├Īzvoslov├Ł sol├Ł chlorid hlinit├Į AlCl3 kyanid draseln├Į KCN uhli─Źitan v├Īpenat├Į CaCO3 hydrogenuhli─Źitan v├Īpenat├Į Ca(HCO3)2 ’é¦ Soli polykyselin tetraboritan disodn├Į Na2B4O7
- 23. ─ī├Łslovkov├® p┼Öedpony ┬Į hemi 1) mono 2) di 3) tri 4) tetra 5) penta 6) hexa 7) hepta 8) okta 9) nona 10) deka N├Īsobn├® ─Ź├Łslovkov├® p┼Öedpony vyj├Īd┼Öen├Ł po─Źtu v├Łceatomov├Įch ─Ź├Īstic dvakr├Īt bis t┼Öikr├Īt tris ─Źty┼Öikr├Īt tetrakis p─øtkr├Īt pentakis CuSO4.5 H2O Na2SO4.10 H2O pentahydr├Īt dekahydr├Īt
- 24. N├Īzvoslov├Ł ’é¦ Hydr├Īty sol├Ł hydr├Īt s├Łranu m─ø─Ånat├®ho CuSO4.5 H2O hydr├Īt s├Łranu v├Īpenat├®ho CaSO4.┬Į H2O hydr├Īt hydrogenfosfore─Źnanu v├Īpenat├®ho CaHPO4.2 H2O ’é¦ Komplexn├Ł slou─Źeniny CuSO4 ne K2[HgI4] penta di hemi
- 25. Polyatomov├® ionty NH4 + amonn├Į SO4 2- s├Łranov├Į CO3 2- uhli─Źitanov├Į SO3 2- si┼Öi─Źitanov├Į HCO3 - hydrogenuhli─Źitanov├Į NO3 - dusi─Źnanov├Į ClO3 - chlore─Źnanov├Į NO2 - dusitanov├Į Cr2O7 2 - dichromanov├Į SCN- thiokyanatanov├Į CrO4 2- chromanov├Į OH- hydroxidov├Į H2SO4 ŌåÆ SO4 2- + 2H+ ...
- 26. Prof. Vojt─øch ┼Āafa┼Ö├Łk (1829ŌĆō1902) na┼Īatec (NH4Cl) m┼Öedev = smrtvodka (HCN) poddusec (NO2), dusec (N2O5) ─Äas├Łk (Co) Chason├Łk (I) ŌĆō podchaluzec; chaluzec; nadchaluzec sirev = smradavka (H2S), podsolec, solec, nadsolec, p┼Öesolec ŌĆ” O co jsme p┼Öi┼Īli? D─økujemev├Łce
- 27. Cvi─Źen├Ł ’ü╗ ’üĮ ’ü╗ ’üĮ ’āŠ ’āĮ ’ā╝ ’ā« ’āŁ ’ā¼ ’ĆĮ mol g g mol AN N M m n ’ĆĮ’ĆĮ Rozm─ørov├Ī kontrola Jak├Ī je mol├Īrn├Ł hmotnost Fe2O3? M(Fe) = 55,85 g/mol M(O) = 16 g/mol M(Fe2O3) = 2├Ś55,85 + 3├Ś16,00 = 159,70 g/mol Kolik mol┼» p┼Öedstavuje 80 g Fe2O3? n=80 g /160 g/mol = 0,5 mol Jak├Ī je mol├Īrn├Ł hmotnost FeO? M(FeO) = 55,85 +16,00 = 71,85 g/mol Jak├Ī je mol├Īrn├Ł hmotnost FeCO3? M(FeCO3) = 55,85 + 12,00 + 3├Ś16,00 = 115,85 g/mol
- 28. V├Įpo─Źet slo┼Šen├Ł Kolik ┼Šeleza obsahuj├Ł n├Īsleduj├Łc├Ł slou─Źeniny? M(Fe2O3) = 2├Ś55,85 + 3├Ś16,00 = 159,70 g/mol M(FeO) = 55,85 +16,00 = 71,85 g/mol M(FeCO3) = 55,85 + 12,00 + 3├Ś16,00 = 115,85 g/mol M(FeO. Fe2O3) = 71,85 + 159,70 = 231,55 g/mol 1 mol Fe2O3 (159,70 g) obsahuje 2 moly Fe (2├Ś55,85 = 111,70 g) 111,7 g/159,70 g = 0,699; 69,9 % 1 mol FeO obsahuje 1 mol Fe ŌåÆ 55,85 g/71,85 g = 0,777 1 mol FeCO3 obsahuje 1 mol Fe ŌåÆ 55,85 g/115,85 g = 0,482 1 mol FeO. Fe2O3 = Fe3O4 obsahuje 3 moly Fe ŌåÆ 0,724 Chemick├® kalkula─Źky
- 29. Chemick├Ī reakce aA + b B cC + dD NaN3 Na + N2 Z├Īkon zachov├Īn├Ł hmotnosti po─Źet atom┼» vpravo = po─Źet atom┼» vlevo n├Īboj vpravo = n├Īboj vlevo Kolik jsou 2 moly azidu sodn├®ho? Jak├Į objem dus├Łku se uvoln├Ł p┼Öi reakci s t├Łmto mno┼Šstv├Łm l├Ītky? Chemie airbagu I2 32
- 30. H2SO4 + 2 NaOH ’é« Na2SO4 + 2 H2O 1 ├Ś 98 + 2 ├Ś 40 142 + 2 ├Ś 18 98 g + 80 g 142 g + 36 g Vy─Ź├Łslov├Īn├Ł reakc├Ł a stechiometrie 1 mol H2SO4 = 2 moly NaOH = 1 mol Na2SO4 = 2 moly H2O. 2 4 2 4 2 4 2 4 10 mol H SO 1 mol H SO 10 mol NaOHx 2 mol H SO ; x 20 mol NaOH x mol NaOH 2 mol NaOH 1 mol H SO ’ĆĮ ’ā× ’ĆĮ ’āŚ ’ĆĮ Vypo─Źt─øte kolik mol┼» NaOH bude reagovat s 10 moly H2SO4. Jak├® mno┼Šstv├Ł Na2SO4 vznikne? 2 42 4 2 4 2 4 2 4 2 4 2 4 2 4 10 mol H SO 1 mol H SO 10 mol H SOx mol Na SO 10 mol Na SO x mol Na SO 1 mol Na SO 1 mol H SO ’ĆĮ ’ā× ’ĆĮ ’ĆĮ ’āŚ
- 31. H2SO4 + 2 NaOH ’é« Na2SO4 + 2 H2O 1 ├Ś 98 + 2 ├Ś 40 1 ├Ś 142 + 2 mol ├Ś 18 g/mol 98 g + 80 g 142 g + 36 g Vy─Ź├Łslov├Īn├Ł reakc├Ł a stechiometrie Vypo─Źt─øte kolik mol┼» NaOH bude reagovat s 10 moly H2SO4. Jak├® mno┼Šstv├Ł Na2SO4 vznikne? V├Įpo─Źet pomoc├Ł ├║m─øry 2 4 (NaOH) 80 10 9880; 800 g NaOH 98(H SO ) 10 98 98 m x x m ’é┤ ’é┤’ĆĮ ’ā× ’ĆĮ ’ĆĮ ’é┤ mol20 40 800 )NaOH( )NaOH( )(NaOHg800 ’ĆĮ’ĆĮ’ĆĮ’ā× M m NaOHn 2 4 2 4 (Na SO ) 142 10 98142; 1420 g NaOH 10 mol NaOH 98(H SO ) 10 98 98 m x x m ’é┤ ’é┤’ĆĮ ’ā× ’ĆĮ ’ĆĮ ’ā× ’é┤
- 32. Stechiometrie ŌĆō p┼Ö├Łklady ’é¦ Vypo─Źt─øte mno┼Šstv├Ł Na kter├® bude reagovat s 35,45 g Cl2 a maxim├Īln├Ł mo┼Šn├Į v├Įt─ø┼Šek NaCl. ’é¦ Vypo─Źt─øte jak├® mno┼Šstv├Ł kysl├Łku se spot┼Öebuje reakc├Ł se 100 g Al na Al2O3. ’é¦ Dal┼Ī├Ł ┼Öe┼Īen├® p┼Ö├Łklady na webu Obecn─ø: pro reakci aA + bB ’é« cC plat├Ł: a cCmolAmol b aBmolAmol ’āŚ’ĆĮ’āÖ’āŚ’ĆĮ
- 33. Vy─Ź├Łslov├Īn├Ł redoxn├Łch reakc├Ł Redoxn├Ł reakce = doch├Īz├Ł ke zm─øn─ø oxida─Źn├Łch ─Ź├Łsel prvk┼» 1. Ur─Źit oxida─Źn├Ł ─Ź├Łslo ka┼Šd├®ho atomu na stran─ø reaktant┼» i produkt┼». 2. Ur─Źit zm─ønu oxida─Źn├Łho stavu ka┼Šd├®ho atomu. 3. Bilancovat prvky kter├® m─øn├Ł oxida─Źn├Ł ─Ź├Łslo ŌĆō na obou stran├Īch mus├Ł b├Įt stejn├Į n├Īboj. 4. Doplnit koeficienty u atom┼» kter├® nem─øn├Ł oxida─Źn├Ł stav. 5. Zkontrolovat po─Źty atom┼» a n├Īboje na obou stran├Īch Oxidace Redukce Sni┼Šov├Īn├Ł oxida─Źn├Łho ─Ź├Łsla prvku Zvy┼Īov├Īn├Ł oxida─Źn├Łho ─Ź├Łsla prvku
- 34. Vy─Ź├Łslov├Īn├Ł redoxn├Łch reakc├Ł Na + KNO3 Na2O + K2O + N2 V 00 I Na0 ŌåÆ Na2 I 2├Ś0 - 2├Ś1 = -2 elektrony NV ŌåÆ N2 0+ 2├Ś5 - 2├Ś0 = 10 elektron┼» 2 2 2 10 10 2 5 1 1 Chemie airbagu II Oxidace Redukce Kontrola po─Źt┼» atom┼» a n├Īboj┼» FeS(s)+ CaC2(s) + CaO(s) Fe(s)+ CO(g)+ CaS(s) I
- 35. Opakov├Īn├Ł 35 Oxida─Źn├Ł ─Źinidlo = l├Ītka, kter├Ī dok├Ī┼Še jin├® l├Ītce odebrat elektrony a t├Łm ji oxidovat (samo oxida─Źn├Ł ─Źinidlo se redukuje). Reduk─Źn├Ł ─Źinidlo = dod├Īv├Ī do syst├®mu elektrony, kter├Įmi se n─økter├Ī z p┼Ö├Łtomn├Įch l├Ītek redukuje (samo reduk─Źn├Ł ─Źinidlo se oxiduje) Redukce = Sni┼Šov├Īn├Ł oxida─Źn├Łho ─Ź├Łsla prvku. Oxidace = Zvy┼Īov├Īn├Ł oxida─Źn├Łho ─Ź├Łsla prvku.
- 39. Periodick├® tabulky http://www.piskac.cz/PT/ http://periodictable.en.softonic.com/java ’é¦ ─Źesky ’é¦ WIN program ’é¦ Anglicky ’é¦ Pro mobily s Javou
- 40. ┼śe┼Īen├® p┼Ö├Łklady CuO + NH3 Cu + N2 + H2O Br - + Cr2O7 2- + H+ Br2 + Cr3+ + H2O Pb + HNO3 Pb(NO3)2 + NO2 + H2O FeCl2 + H2O2 + HCl FeCl3 + H2O As2S3 + HNO3 H3AsO4 + S + NO2 + H2O H2O2 + KMnO4 + H2SO4 O2 + MnSO4 + K2SO4 + H2O
- 41. ┼śe┼Īen├® p┼Ö├Łklady As2S3 + 10HNO3 2H3AsO4 + 3S + 10NO2 + 2H2O 5H2O2 + 2KMnO4 + 3H2SO4 5O2 + 2MnSO4 + K2SO4 + 8H2O 2FeCl2 + H2O2 + 2HCl 2FeCl3 + 2H2O 3CuO + 2NH3 3Cu + N2 + 3H2O 6Br - + Cr2O7 2- + 14H+ 3Br2 + 2Cr3+ + 7H2O Pb + 4HNO3 Pb(NO3)2 + 2NO2 + 2H2O
- 42. P┼Ö├Łklady 1 Dopl┼łte koeficienty do sch├®matu chemick├® reakce: CaSO4 + C CaO + SO2 + CO2 Vyj├Īd┼Öete chemickou rovnic├Ł vznik m├Īlo rozpustn├®ho fosfore─Źnanu v├Īpenat├®ho z chloridu v├Īpenat├®ho a fosfore─Źnanu sodn├®ho. Vyj├Īd┼Öete chemickou rovnic├Ł vznik fluoridu borit├®ho z oxidu borit├®ho, fluoridu v├Īpenat├®ho a kyseliny s├Łrov├®. Reakc├Ł s├Łranu zine─Źnat├®ho s hydrogenfosfore─Źnanem disodn├Įm vznik├Ī fosfore─Źnan zine─Źnat├Į, s├Łran sodn├Į a dihydrogenfosfore─Źnan sodn├Į. Sestavte rovnici.
- 43. P┼Ö├Łklady 2 Dopl┼łte koeficienty u t─øchto chemick├Įch rovnic: K2Cr2O7 + NaCl + H2SO4 CrO2Cl2 + K2SO4 + Na2SO4 + H2O (UO2)(NO3)2 + KOH K2U2O7 + KNO3 + H2O NaNO2 + KI + H2SO4 NO + I2 + K2SO4 + Na2SO4 + H2O MnSO4 + PbO2 + HNO3 HMnO4 + PbSO4 + Pb(NO3)2 + H2O
- 44. P┼Ö├Ł┼Īt├Ł p┼Öen├Ī┼Īka: Chemick├® reakce Kinetika a rovnov├Īha D─økuji za pozornost time Katedra chemie FP TUL: http://www.kch.tul.cz
- 45. Pou┼Šit├® zdroje ’é¦ Molloy Gary (ChemEdLinks@gmail.com), image created using Wordle. ’é¦ Canov, M.: Chemie, http://www.jergym.hiedu.cz/~canovm/ ’é¦ Winter, Mark J. Periodick├Ī tabulka Webelements, http://webelements.com ’é¦ Piska─Ź, Pavel. Periodick├Ī tabulka 2.85, http://www.piskac.cz/PT ’é¦ Monroe, Matthew. Molecular Weight Calculator for Windows, Version 6.38. 3.1 MB. http://www.alchemistmatt.com/mwtwin.html ’é¦ MIT Open CourseWare; http://ocw.mit.edu/OcwWeb/web/home/home/index.htm ’é¦ Wikipedia; http://www.wikipedia.org/ ’é¦ Periodick├Ī tabulka MERCK. www.merck.cz ’é¦ Malijevsk├Ī Ivona, Malijevsk├Į Anatol, Nov├Īk Josef. Z├Īhady, kl├Ł─Źe, zaj├Łmavosti - O─Źima fyzik├Īln├Ł chemie. V┼ĀCHT Praha. 1. vyd├Īn├Ł , 2004. http://vydavatelstvi.vscht.cz/knihy/uid_isbn-80-7080-535-8/pages-img/ ’é¦ ACD/ChemSketch. http://www.acdlabs.com/download/chemsketch/ Katedra chemie FP TUL: http://www.kch.tul.cz



![Mol
Mol: po─Źet ─Ź├Īstic (atom┼», molekul, iont┼») rovn├Į po─Źtu atom┼»
uhl├Łku ve 12,00 g 12C.
1 mol = 6,022├Ś1023 ─Ź├Īstic (Avogadrovo ─Ź├Łslo).
Objem 1 molu ide├Īln├Łho plynu za norm├Īln├Łch podm├Łnek
(pŌłÖV=nŌłÖRŌłÖT; p = 101325 Pa, R = 8,314 J┬ĘK- 1mol- 1, T = 273,15 K)
Vm = 22,41 dm3.mol-1
Mol├Īrn├Ł hmotnost, M
= hmotnost 1 molu ─Ź├Īstic [g.mol-1].
prvky = atomov├Ī hmotnost ŌåÆ periodick├Ī tabulka
’é¦ 1 mol vody H2O zauj├Łm├Ī objem asi 18 ml a je v n─øm obsa┼Šeno 6,022├Ś1023 molekul.
’é¦ 1 mol zlata Au zauj├Łm├Ī objem asi 10 ml a je v n─øm obsa┼Šeno 6,022├Ś1023 atom┼».
’é¦ 1 mol vod├Łku H2 zauj├Łm├Ī objem asi 22,4 l a je v n─øm obsa┼Šeno 6,022├Ś1023 molekul.](https://image.slidesharecdn.com/03-nazvoslovi-stechiometrie-rovnice-091015084523-phpapp02/85/CHE-03-Nazvoslovi-stechiometrie-chemicke-rovnice-3-320.jpg)



















![N├Īzvoslov├Ł
’é¦ Hydr├Īty sol├Ł
hydr├Īt s├Łranu m─ø─Ånat├®ho
CuSO4.5 H2O
hydr├Īt s├Łranu v├Īpenat├®ho
CaSO4.┬Į H2O
hydr├Īt hydrogenfosfore─Źnanu v├Īpenat├®ho
CaHPO4.2 H2O
’é¦ Komplexn├Ł slou─Źeniny
CuSO4
ne
K2[HgI4]
penta
di
hemi](https://image.slidesharecdn.com/03-nazvoslovi-stechiometrie-rovnice-091015084523-phpapp02/85/CHE-03-Nazvoslovi-stechiometrie-chemicke-rovnice-24-320.jpg)




















