有機ホウ素化合物の?新しい合成方法と?発光性メカノクロミズム材料Part I
- 2. 本日の講演内容 1. 銅触媒によるホウ素化反応:? 光学活性アルキルホウ素化合物の合成方法 3. メカノ応答性をもつ発光性金錯体 2. BBSホウ素化反応:? 遷移金属フリーでかつ官能基共存性のある? 芳香族ホウ素化合物の合成方法
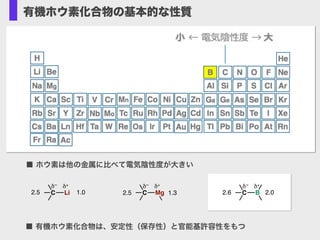
- 3. 有機ホウ素化合物の基本的な性質 有機ホウ素反応剤は高い安定性(保存性)官 能基許容性をもつ ■ ホウ素は他の金属に比べて電気陰性度が大きい ■ 有機ホウ素化合物は、安定性(保存性)と官能基許容性をもつ C B δ+δ– 2.6 2.0C Mg δ+δ– 2.5 1.3C Li δ+δ– 2.5 1.0
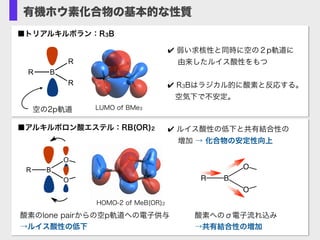
- 4. 有機ホウ素化合物の基本的な性質 LUMO of BMe3 R B R R ? 弱い求核性と同時に空の2p軌道に ? 由来したルイス酸性をもつ ? R3Bはラジカル的に酸素と反応する。 空気下で不安定。 空の2p軌道 ■トリアルキルボラン:R3B R B O O ■アルキルボロン酸エステル:RB(OR)2 酸素のlone pairからの空p軌道への電子供与 →ルイス酸性の低下 ? ルイス酸性の低下と共有結合性の? ? 増加 → 化合物の安定性向上 HOMO-2 of MeB(OR)2 酸素へのσ電子流れ込み? →共有結合性の増加 B O O R
- 5. 有機ホウ素化合物の基本的な性質 ■ RB(OR)2 は塩基の添加により活性化される。 B OR OR R OR ORB OR OR R B OR OR R OR ■ 様々なボロン酸エステル O O BR O O BR O O BR O O BR R R R B(pin) R Bpin OH OH BR O B O B O B R R R boroxine –H2O ■ ボロン酸は縮合に注意 ■ ボロン酸の保護基 R BF3 -K+ B N O O O O MeR N B N R H H Burke, 2008 Suginome, 2007 R B(dan)MIDA boronate B O O OR M+ Miyaura, 2008 BAr ■ その他の安定化 Hc and Hd in Figu and 7.76 and 9.02 p of 1a in [D2]tetr relatively downfie are attributed to t the neighboring b deshielded singlet atom, which reflec (see the Supporti 1 H NMR measure significant change a large energy ga Scheme 1. Stepwise boron doping of an extended polyaromatic hydro- carbon. Scheme 2. Synthesis of B-doped nanographene 1a. Reagents and Figure 1. 1 H NMR sp 平面化: Yamaguchi, 2012 立体障害導入
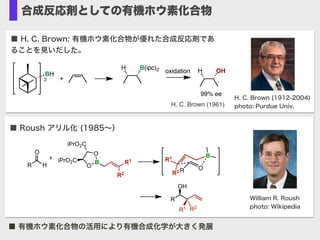
- 6. 合成反応剤としての有機ホウ素化合物 ■ Roush アリル化 (1985~) William R. Roush photo: Wikipedia B R1 R2 O O iPrO2C iPrO2C R H O R OH R1 R2 O B R R1 R2 + ■ H. C. Brown: 有機ホウ素化合物が優れた合成反応剤であ ることを見いだした。 H. C. Brown (1912-2004) photo: Purdue Univ.H. C. Brown (1961) BH 2 + H B(ipc)2 H OHoxidation 99% ee ■ 有機ホウ素化合物の活用により有機合成化学が大きく発展
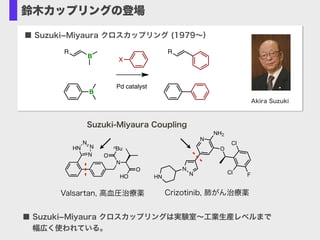
- 7. N O HO O nBu N N N HN Suzuki-Miyaura Coupling ■ Suzuki?Miyaura クロスカップリング (1979~) Akira Suzuki R B B X R Pd catalyst 鈴木カップリングの登場 N N HN N NH2 O Cl Cl F Crizotinib, 肺がん治療薬Valsartan, 高血圧治療薬 ■ Suzuki?Miyaura クロスカップリングは実験室~工業生産レベルまで? ? 幅広く使われている。
- 8. of 1a in [D2]tetrachloroethane at 353 K (F relatively downfield chemical shifts of the Hb are attributed to the deshielding effect by the the neighboring benzene rings in the cove reg deshielded singlet signal at 10.85 ppm corresp atom, which reflects the close contact with the (see the Supporting Information).[13] Variabl 1 H NMR measurements from 193 to 353 K did significant change. This temperature independ a large energy gap between the singlet close state and a triplet excited state. The gap w theoretically to be 34.9 kcalmol?1 for 1a at 31G* level, which is far larger than that of the p doping of an extended polyaromatic hydro- oped nanographene 1a. Reagents and O, from 08C to 258C, then 5, toluene, from NO2 and CH2Cl2. Figure 1. 1 H NMR spectrum of 1a in [D2]tetrachloroeth Yamaguchi, 2012 Fig. 9 Left: the structure of compound 17. Middle: A green OLED based on 2C Fig. 9 Left: the structure of compound 17. Middle: A green OLED based on compound 15. Right: An orange OLED based on 4. Devices incorporating 8 wt.% of this material doped into CBP (4,4?-bis(9-carbazolyl)biphenyl) showed remarkably high ef?ciency red phosphorescence, with maximum current, power and external quantum ef?ciencies (EQEs) of 10.31 cd A-1 , 5.04 lm W-1 and 9.36%, respectively. It should be noted that, while much higher ef?ciencies have been achieved with the parent green phosphor Ir(ppy)2(acac) using a similar device structure,8a,b the performance of 4 is still very impressive as it is a red emitter and is expected to improving electron mobility in the emissive layer is that can be used to achieve better carrier balance i To con?rm that the BMes2 group indeed impro transport in the device, we fabricated single-carri capable of transporting electrons only from thin or Pt(ppy)(acac). Remarkably, the ?lm of 15 was supporting a current density 3–4 orders of magnitude that of Pt(ppy)(acac), indicative of markedly impro 11a 19November2012 sc.org|doi:10.1039/C1DT10292C Wang, 2010 ■有機ホウ素化合物の高効率合成法の開発はますます重要になっている ●官能基許容性 ●光学活性隊の不斉合成 ●遷移金属フリー ●立体障害克服 ●低コスト ■ 有機ホウ素化合物そのものを医薬品としたもの 有機ホウ素化合物のニーズの高まり N H H N B O N N Ph O OH OH O B F OH Bortezomib, 悪性リンパ腫治療薬 Tavaborole, 抗真菌剤 カルボン酸 の拮抗作用 糖鎖認識 ■ 有機電子材料を志向した化合物 有機EL
- 9. 本日の講演内容 1. 銅触媒によるホウ素化反応:? 光学活性アルキルホウ素化合物の合成方法 3. メカノ応答性をもつ発光性金錯体 2. BBSホウ素化反応:? 遷移金属フリーでかつ官能基共存性のある? 芳香族ホウ素化合物の合成方法
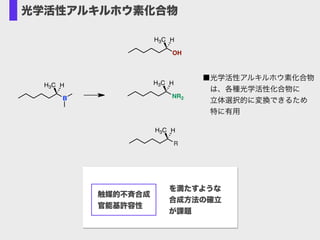
- 10. B H3C H OH H3C H NR2 H3C H R H3C H ■光学活性アルキルホウ素化合物? ?は、各種光学活性化合物に? ?立体選択的に変換できるため? ?特に有用 光学活性アルキルホウ素化合物 触媒的不斉合成 官能基許容性 を満たすような 合成方法の確立 が課題
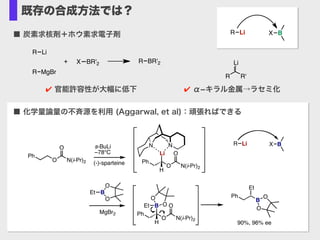
- 11. 既存の合成方法では? ■ 触媒的不斉ホウ素化: 限定的(実は二三例しかない) Ph [Rh(cod)2]BF4 (1 mol %) (R)-BINAP (1 mol %) –78°C, 6 h O HB O + Ph B(cat) 91%, 96.2 % ee Hayashi, T.; Matsumoto, Y.; Ito, Y. J. Am. Chem. Soc. 1989, 111, 3426.! ■ 不斉ホウ素化合物を用いるヒドロホウ素化: 化学量論量の不斉源 BH 2 + H B(ipc)2 H OHoxidation 99% ee OH + 2 H B+ H B ■ ヒドロホウ素化:代表的な有機ホウ素化合物の合成方法の一つ
- 12. 既存の合成方法では? ■ 炭素求核剤+ホウ素求電子剤 R Li R MgBr + R BR'2X BR'2 R R' Li ? 官能許容性が大幅に低下 ? α?キラル金属→ラセミ化 N Ph O N(i-Pr)2 O (-)-sparteine s-BuLi –78°C Ph O N(i-Pr)2 OLi H N Ph O N(i-Pr)2 OB H O O Et Et B O O MgBr2 Ph B O O Et 90%, 96% ee R Li BX ■ 化学量論量の不斉源を利用 (Aggarwal, et al):頑張ればできる R Li BX
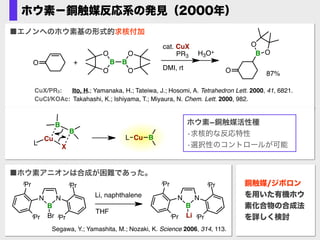
- 13. ホウ素?銅触媒反応系の発見(2000年) Segawa, Y.; Yamashita, M.; Nozaki, K. Science 2006, 314, 113. NN B Br iPr iPr iPr iPr NN B Li iPr iPr iPr iPr Li, naphthalene THF ■ホウ素アニオンは合成が困難であった。 CuCl/KOAc: Takahashi, K.; Ishiyama, T.; Miyaura, N. Chem. Lett. 2000, 982. CuX/PR3: Ito, H.; Yamanaka, H.; Tateiwa, J.; Hosomi, A. Tetrahedron Lett. 2000, 41, 6821. + cat. CuX PR3 DMI, rt H3O+ O O B B B O OO O O O 87% ■エノンへのホウ素基の形式的求核付加 Cu X B B Cu B L L ホウ素?銅触媒活性種? ?求核的な反応特性? ?選択性のコントロールが可能 銅触媒/ジボロン を用いた有機ホウ 素化合物の合成法 を詳しく検討
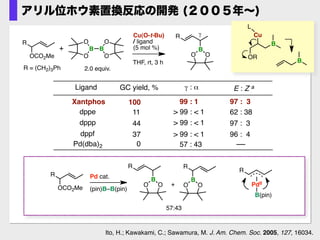
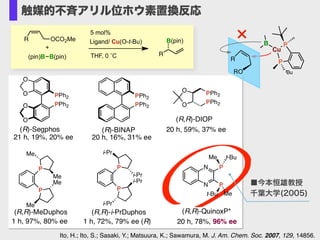
- 14. ?Xantphosがベストの配位子 ?高いγ-選択性 ?E体が生成 Ito, H.; Kawakami, C.; Sawamura, M. J. Am. Chem. Soc. 2005, 127, 16034. Cu(O-t-Bu) / ligand (5 mol %) GC yield, % dppf 100 37 44 Xantphos Ligand E : Z a 97 : 399 : 1 96 : 4> 99 : < 1 97 : 3> 99 : < 1 11 62 : 38> 99 : < 1 γ : α dppe dppp O PPh2Ph2P + 2.0 equiv. O B O O B O Xantphos: Pd(dba)2 0 57 : 43 R OCO2Me R B R = (CH2)3Ph O O γ THF, rt, 3 h B Cu OR L B R OCO2Me R B O O R B OO+ 57:43 Pd cat. (pin)B–B(pin) R PdII B(pin) アリル位ホウ素置換反応の開発 (2005年~)
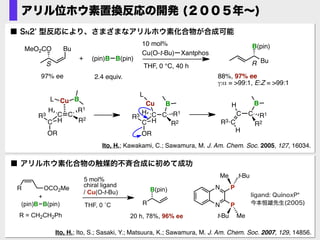
- 15. S R 2.4 equiv. Bu B(pin)MeO2CO Bu (pin)B B(pin)+ THF, 0 °C, 40 h 10 mol% Cu(O-t-Bu)ーXantphos 88%, 97% ee γ:α = >99:1, E:Z = >99:1 97% ee Ito, H.; Kawakami, C.; Sawamura, M. J. Am. Chem. Soc. 2005, 127, 16034. C C R2 C H R1 R3 OR H C C B R1 R2 H CR3 H C C R2C H R1 R3 OR H Cu B L L Cu B ■ SN2' 型反応により、さまざまなアリルホウ素化合物が合成可能 アリル位ホウ素置換反応の開発 (2005年~) ■ アリルホウ素化合物の触媒的不斉合成に初めて成功 Ito, H.; Ito, S.; Sasaki, Y.; Matsuura, K.; Sawamura, M. J. Am. Chem. Soc. 2007, 129, 14856. ligand: QuinoxP* 今本恒雄先生(2005)THF, 0 ?C R B(pin) (pin)B B(pin) + R OCO2Me chiral ligand / Cu(O-t-Bu) 5 mol% 20 h, 78%, 96% ee N N P P t-BuMe t-Bu MeR = CH2CH2Ph
- 16. Ito, H.; Ito, S.; Sasaki, Y.; Matsuura, K.; Sawamura, M. J. Am. Chem. Soc. 2007, 129, 14856. THF, 0 ?C R B(pin) (pin)B B(pin) + R OCO2Me Ligand/ Cu(O-t-Bu) 5 mol% ■今本恒雄教授 千葉大学(2005) R RO B Cu P P tBu × 触媒的不斉アリル位ホウ素置換反応
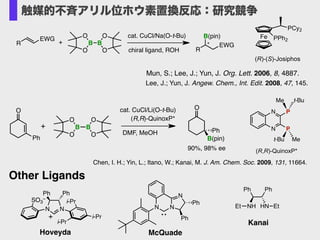
- 17. Mun, S.; Lee, J.; Yun, J. Org. Lett. 2006, 8, 4887.! Lee, J.; Yun, J. Angew. Chem., Int. Edit. 2008, 47, 145. R EWG O B O B O O + cat. CuCl/Na(O-t-Bu) chiral ligand, ROH R ?? EWG B(pin) Fe PPh2 PCy2 (R)-(S)-Josiphos O Ph cat. CuCl/Li(O-t-Bu) O B O O B O + (R,R)-QuinoxP* DMF, MeOH O B(pin) Ph 90%, 98% ee N N P P t-BuMe t-Bu Me (R,R)-QuinoxP* Chen, I. H.; Yin, L.; Itano, W.; Kanai, M. J. Am. Chem. Soc. 2009, 131, 11664. N N Ph Ph i-Pr i-Pr i-Pr SO3 – + Other Ligands Hoveyda N N N Ph Ph McQuade PhPh NH HN EtEt Kanai 触媒的不斉アリル位ホウ素置換反応:研究競争
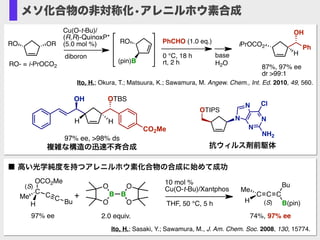
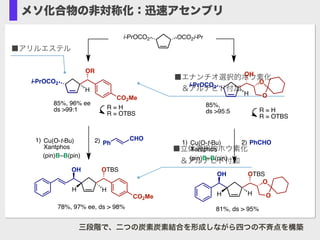
- 18. Ito, H.; Okura, T.; Matsuura, K.; Sawamura, M. Angew. Chem., Int. Ed. 2010, 49, 560. RO (pin)B diboron Cu(O-t-Bu)/ (R,R)-QuinoxP* (5.0 mol %) base H2O iPrOCO2 H Ph OH PhCHO (1.0 eq.) 0 °C, 18 h rt, 2 hRO- = i-PrOCO2 87%, 97% ee dr >99:1 ORRO CCC Bu B(pin) Me H 74%, 97% ee 10 mol % Cu(O-t-Bu)/Xantphos THF, 50 °C, 5 h 97% ee Me C C C Bu OCO2Me H (S) (S) 2.0 equiv. O B O O B O + ■ 高い光学純度を持つアレニルホウ素化合物の合成に始めて成功 Ito, H.; Sasaki, Y.; Sawamura, M., J. Am. Chem. Soc. 2008, 130, 15774. メソ化合物の非対称化?アレニルホウ素合成 OTIPS N N N N NH2 Cl 抗ウィルス剤前駆体 H OTBS CO2Me OH H 97% ee, >98% ds 複雑な構造の迅速不斉合成
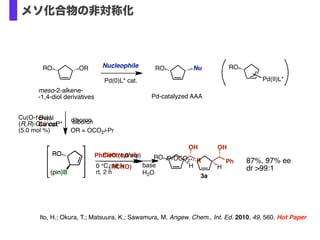
- 19. Ito, H.; Okura, T.; Matsuura, K.; Sawamura, M. Angew. Chem., Int. Ed. 2010, 49, 560. Hot Paper chiral Cu cat. RO H OH R Electrophile (RCHO) RO (pin)B diboron RO (pin)B diboronCu(O-t-Bu)/ (R,R)-QuinoxP* (5.0 mol %) base H2O iPrOCO2 H Ph OH PhCHO (1.0 eq.) 3a 0 °C, 18 h rt, 2 h OR = OCO2i-Pr 87%, 97% ee dr >99:1 ORRO NuRONucleophile meso-2-alkene- -1,4-diol derivatives Pd-catalyzed AAA RO Pd(II)L*Pd(0)L* cat. メソ化合物の非対称化
- 20. ■アリルエステル ■エナンチオ選択的ホウ素化 ?&アルデヒド付加 ■立体選択的ホウ素化 ?&アルデヒド付加 三段階で、二つの炭素炭素結合を形成しながら四つの不斉点を構築 OCO2i-Pri-PrOCO2 i-PrOCO2 H OR CO2Me 85%, 96% ee ds >99:1 Cu(O-t-Bu) Xantphos (pin)B–B(pin) H OTBS CO2Me OH H 78%, 97% ee, ds > 98% 1) 2) CHO Ph R = H R = OTBS 81%, ds > 95% i-PrOCO2 H OH O O H OTBS O O OH H Cu(O-t-Bu) Xantphos (pin)B–B(pin) 1) 2) PhCHO R = H R = OTBS 85%, ds >95:5 メソ化合物の非対称化:迅速アセンブリ
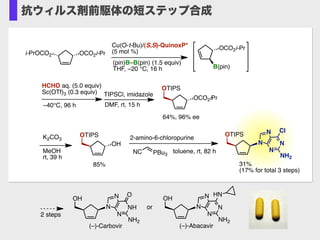
- 21. Cu(O-t-Bu)/(S,S)-QuinoxP* (5 mol %) OTIPS N N N N NH2 31% (17% for total 3 steps) HCHO aq. (5.0 equiv) Sc(OTf)3 (0.3 equiv) Cl (pin)B–B(pin) (1.5 equiv) THF, –20 °C, 16 h –40°C, 96 h NC PBu3 toluene, rt, 82 h 2-amino-6-chloropurine MeOH rt, 39 h OH OTIPS OCO2i-Pr B(pin) K2CO3 85% OCO2i-Pri-PrOCO2 OCO2iPr OTIPS TIPSCl, imidazole DMF, rt, 15 h 64%, 96% ee OH N N N N NH2 (–)-Abacavir HN OH NH N N N NH2 (–)-Carbovir O or 2 steps 抗ウィルス剤前駆体の短ステップ合成
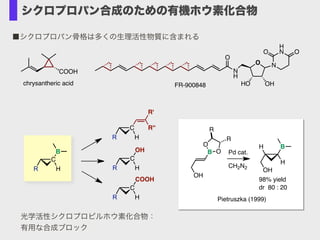
- 22. COOH N H O O N H NO O HO OHFR-900848chrysantheric acid ■シクロプロパン骨格は多くの生理活性物質に含まれる C B R H C R H C OH R H R'' R' C COOH R H 光学活性シクロプロピルホウ素化合物: 有用な合成ブロック 98% yield dr 80 : 20 H B H OH B OH O O R R Pd cat. CH2N2 Pietruszka (1999) シクロプロパン合成のための有機ホウ素化合物
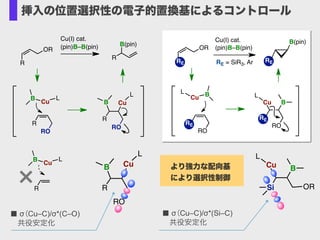
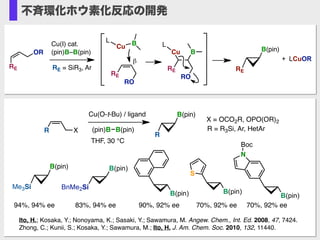
- 23. Cu(I) cat. (pin)B–B(pin) Cu BL OR RO RE RE RO RE Cu B L B(pin) RERE = SiR3, Ar CuB RO L R Cu B L R× ■ σ(Cu–C)/σ*(C–O) ?共役安定化 OR R B(pin) Cu(I) cat. (pin)B–B(pin) CuB RO L RO Cu B L R R R ORSi Cu B L ■ σ(Cu–C)/σ*(Si–C) ?共役安定化 より強力な配向基 により選択性制御 挿入の位置選択性の電子的置換基によるコントロール
- 24. Cu(I) cat. (pin)B–B(pin) Cu BL OR RO RE RE RO RE Cu B L B(pin) RE RE = SiR3, Ar β LCuOR+ (pin)B B(pin) Cu(O-t-Bu) / ligand R X THF, 30 °C B(pin) R R = R3Si, Ar, HetAr B(pin) N Boc B(pin) S B(pin) 70%, 92% ee90%, 92% ee 70%, 92% ee X = OCO2R, OPO(OR)2 B(pin) Me3Si 94%, 94% ee B(pin) BnMe2Si 83%, 94% ee Ito, H.; Kosaka, Y.; Nonoyama, K.; Sasaki, Y.; Sawamura, M. Angew. Chem., Int. Ed. 2008, 47, 7424. Zhong, C.; Kunii, S.; Kosaka, Y.; Sawamura, M.; Ito, H. J. Am. Chem. Soc. 2010, 132, 11440. 不斉環化ホウ素化反応の開発
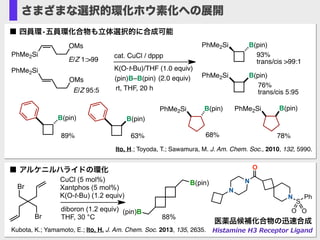
- 25. Ito, H.; Toyoda, T.; Sawamura, M. J. Am. Chem. Soc., 2010, 132, 5990. (pin)B–B(pin) PhMe2Si OMs cat. CuCl / dppp K(O-t-Bu)/THF (1.0 equiv) (2.0 equiv) rt, THF, 20 h 93% trans/cis >99:1E/Z 1:>99 PhMe2Si OMs PhMe2Si B(pin) 76% trans/cis 5:95E/Z 95:5 PhMe2Si B(pin) B(pin) B(pin) PhMe2Si B(pin)PhMe2Si B(pin) 89% 63% 68% 78% ■ 四員環?五員環化合物も立体選択的に合成可能 さまざまな選択的環化ホウ素化への展開 O N S O O Ph N N Kubota, K.; Yamamoto, E.; Ito, H. J. Am. Chem. Soc. 2013, 135, 2635. Histamine ?H3 ?Receptor ?Ligand ■ アルケニルハライドの環化 B(pin) (pin)B Br Br CuCl (5 mol%) Xantphos (5 mol%) K(O-t-Bu) (1.2 equiv) diboron (1.2 equiv) THF, 30 °C 88% 医薬品候補化合物の迅速合成
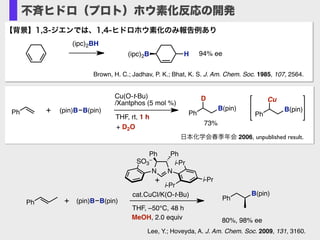
- 26. v Brown, H. C.; Jadhav, P. K.; Bhat, K. S. J. Am. Chem. Soc. 1985, 107, 2564. (ipc)2B 94% eeH (ipc)2BH 【背景】1,3-ジエンでは、1,4-ヒドロホウ素化のみ報告例あり 不斉ヒドロ(プロト)ホウ素化反応の開発 Ph (pin)B B(pin) Cu(O-t-Bu) /Xantphos (5 mol %) THF, rt, 26 h + Ph B(pin) B(pin) 73% Ph (pin)B B(pin) Cu(O-t-Bu) /Xantphos (5 mol %) THF, rt, 1 h + Ph D B(pin) 73% + D2O Ph Cu B(pin) 日本化学会春季年会 2006, unpublished result. N N Ph Ph i-Pr i-Pr i-Pr SO3 – Ph (pin)B B(pin)+ cat.CuCl/K(O-t-Bu) THF, –50°C, 48 h MeOH, 2.0 equiv + Ph B(pin) 80%, 98% ee Lee, Y.; Hoveyda, A. J. Am. Chem. Soc. 2009, 131, 3160.
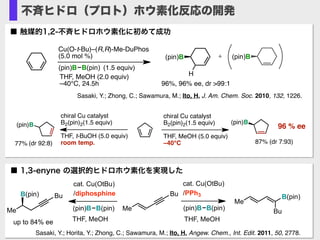
- 27. v ■ 触媒的1,2-不斉ヒドロホウ素化に初めて成功 Sasaki, Y.; Zhong, C.; Sawamura, M.; Ito, H. J. Am. Chem. Soc. 2010, 132, 1226. (pin)B (pin)B+ THF, MeOH (2.0 equiv) –40°C, 24.5h Cu(O-t-Bu)–(R,R)-Me-DuPhos (5.0 mol %) (pin)B B(pin) (1.5 equiv) 96%, 96% ee, dr >99:1 H v Me Me BuB(pin) B(pin) BuMe Bu cat. Cu(OtBu) /diphosphine (pin)B B(pin) THF, MeOH cat. Cu(OtBu) /PPh3 (pin)B B(pin) THF, MeOHup to 84% ee ■ 1,3-enyne の選択的ヒドロホウ素化を実現した Sasaki, Y.; Horita, Y.; Zhong, C.; Sawamura, M.; Ito, H. Angew. Chem., Int. Edit. 2011, 50, 2778. 不斉ヒドロ(プロト)ホウ素化反応の開発 (pin)B (pin)B 96 % ee chiral Cu catalyst B2(pin)2(1.5 equiv) THF, t-BuOH (5.0 equiv) room temp.77% (dr 92:8) chiral Cu catalyst B2(pin)2(1.5 equiv) THF, MeOH (5.0 equiv) –40°C 87% (dr 7:93)
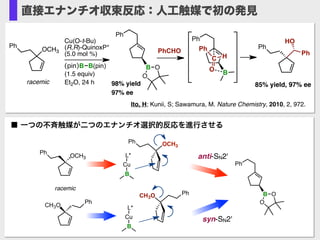
- 28. Ito, H; Kunii, S; Sawamura, M. Nature Chemistry, 2010, 2, 972. Cu(O-t-Bu) (R,R)-QuinoxP* (5.0 mol %) (pin)B B(pin) (1.5 equiv) Et2O, 24 h OCH3 Ph racemic 98% yield 97% ee Ph B O O PhCHO Ph B C O H Ph Ph HO Ph 85% yield, 97% ee 直接エナンチオ収束反応:人工触媒で初の発見 OCH3 Ph CH3O Ph OCH3 Ph CH3O Ph racemic Cu B L* Cu B L* Ph B O O anti-SN2' syn-SN2' ■ 一つの不斉触媒が二つのエナンチオ選択的反応を進行させる
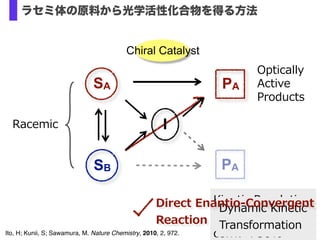
- 29. Racemic Kinetic ?Resolution ? ? conv.< ?50% Optically ? Active ? Products Chiral Catalyst Dynamic ?Kinetic ? Resolution SA SB PA PA I Dynamic ?Kinetic ? Transformation Direct ?Enantio-‐??Convergent ? Reaction Ito, H; Kunii, S; Sawamura, M. Nature Chemistry, 2010, 2, 972. ラセミ体の原料から光学活性化合物を得る方法
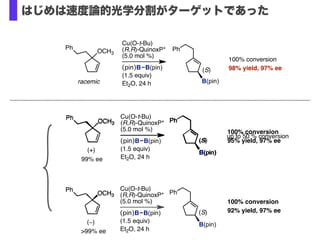
- 30. Cu(O-t-Bu) (R,R)-QuinoxP* (5.0 mol %) (pin)B B(pin) (1.5 equiv) Et2O, 24 h OCH3 Ph racemic 100% conversion 98% yield, 97% ee Ph B(pin) (S) (+) OCH3 Ph Cu(O-t-Bu) (R,R)-QuinoxP* (5.0 mol %) (pin)B B(pin) (1.5 equiv) Et2O, 24 h Ph B(pin) (S) 100% conversion 95% yield, 97% ee 99% ee (?) OCH3 Ph Cu(O-t-Bu) (R,R)-QuinoxP* (5.0 mol %) (pin)B B(pin) (1.5 equiv) Et2O, 24 h Ph B(pin) (S) 100% conversion 92% yield, 97% ee >99% ee OCH3 Ph Ph B(pin) (S) up to 50 % conversion OCH3 Ph はじめは速度論的光学分割がターゲットであった
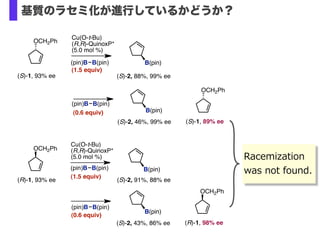
- 31. Cu(O-t-Bu) (R,R)-QuinoxP* (5.0 mol %) (1.5 equiv) OCH2Ph B(pin) (S)-1, 93% ee (S)-2, 88%, 99% ee (pin)B B(pin) B(pin) (S)-2, 46%, 99% ee OCH2Ph (S)-1, 89% ee (0.6 equiv) (pin)B B(pin) (0.6 equiv) B(pin) (S)-2, 43%, 86% ee OCH2Ph (R)-1, 98% ee (pin)B B(pin) Cu(O-t-Bu) (R,R)-QuinoxP* (5.0 mol %) (1.5 equiv) OCH2Ph B(pin) (R)-1, 93% ee (S)-2, 91%, 88% ee (pin)B B(pin) Racemization ? was ?not ?found. 基質のラセミ化が進行しているかどうか?
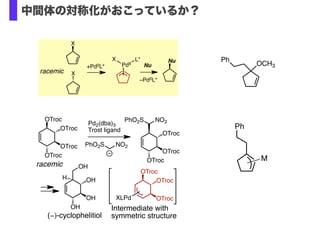
- 32. Nu –Pd0L* +Pd0L* X X PdII X L* Nu racemic OTroc OTroc OTroc OTroc OTroc OTroc OTroc XLPd Pd2(dba)3 Trost ligand H NO2PhO2S OH OTroc OTroc OTroc racemic NO2PhO2S OH OH OH (?)-cyclophelitiol Intermediate with symmetric structure OCH3 Ph Ph M 中間体の対称化がおこっているか?
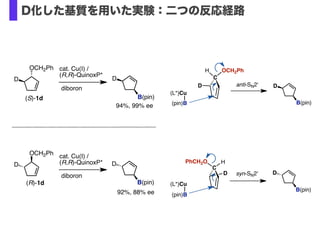
- 33. C H B(pin) (L*)Cu (pin)B anti-SN2' OCH2Ph D D C PhCH2O (L*)Cu (pin)B syn-SN2'D H B(pin) D OCH2Ph (S)-1d D B(pin) D cat. Cu(I) / (R,R)-QuinoxP* diboron 94%, 99% ee OCH2Ph (R)-1d D B(pin) D cat. Cu(I) / (R,R)-QuinoxP* diboron 92%, 88% ee D化した基質を用いた実験:二つの反応経路
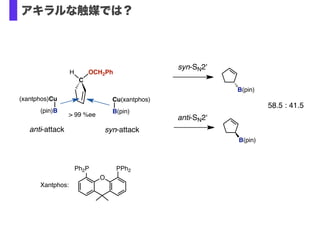
- 34. C H OCH2Ph (xantphos)Cu (pin)B anti-attack Cu(xantphos) B(pin) syn-attack > 99 %ee O Ph2P PPh2 Xantphos: syn-SN2' B(pin) B(pin) anti-SN2' 58.5 : 41.5 アキラルな触媒では?
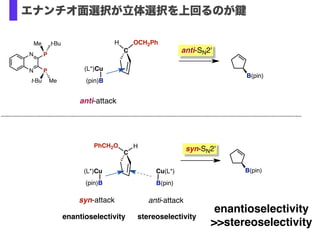
- 35. C PhCH2O H C H OCH2Ph (L*)Cu (pin)B anti-attack B(pin) anti-SN2' syn-SN2' B(pin) enantioselectivity >>stereoselectivity Cu(L*) B(pin) anti-attack stereoselectivity (L*)Cu (pin)B syn-attack enantioselectivity N N P P t-BuMe t-Bu Me エナンチオ面選択が立体選択を上回るのが
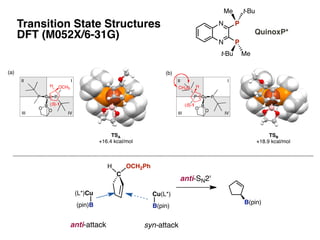
- 36. TSA ! +16.4 kcal/mol (a) TSB ! +18.9 kcal/mol (b) (c) TSC! TSD! (d) Cu PP B O O (S)-1 OCH3 H III III IV Cu PP B O O (R)-1 III III IV H OCH3 Cu PP B O O (R)-1 H3CO H III III IV Cu PP B O O HCH3O (S)-1 III III IV C H B(pin) anti-SN2' OCH2Ph (L*)Cu (pin)B anti-attack Cu(L*) B(pin) syn-attack Transition State Structures? DFT (M052X/6-31G) N N P P t-BuMe t-Bu Me QuinoxP*
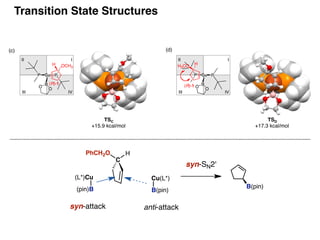
- 37. TSA ! +16.4 kcal/mol TSB ! +18.9 kcal/mol (c) TSC! +15.9 kcal/mol TSD! +17.3 kcal/mol (d) III IV Cu PP B O O (R)-1 III III IV H OCH3 Cu PP B O O (R)-1 H3CO H III III IV III IV C PhCH2O Cu(L*) B(pin) syn-SN2' H B(pin) anti-attack (L*)Cu (pin)B syn-attack Transition State Structures
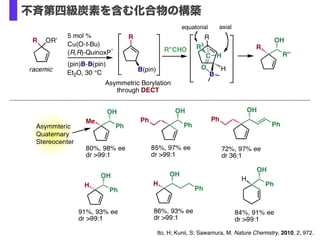
- 38. Ito, H; Kunii, S; Sawamura, M. Nature Chemistry, 2010, 2, 972. 不斉第四級炭素を含む化合物の構築
- 39. K. Kubota C(sp3)ーX への求核的ホウ素置換反応 Br + CuCl / Xantphos (3 mol %) K(O-t-Bu) (1.0 equiv) THF, rt B(pin)Alkyl AlkylB B O OO O 1.2 equiv B(pin) B(pin) 4 h, 85% 5 h, 91% B(pin) 5 h, 90% B(pin) 44 h, 0% B(pin) 48 h, 17% B(pin) 5 h, 51% B(pin) B(pin) 24 h, 62%a B(pin)B(pin) 30 h, 68%a aReaction was carried out at 40°C with 15 mol % of catalyst, 2.2 equiv of B2pin2 and 2.0 equiv of base. B(pin) 5 h, 84% B(pin) 4 h, 92% Alkyl X Alkyl B Cu cat. B B O OO O + X = Cl, Br, I O O base Alkyl MgX or Li XB(pin) CuCl / Xantphos: Ito, H.; Kubota, K. Org. Lett. 2012, 14, 890. ? CuI / PPh3: Yang, C.-T.; Steel, P. G.; Marder, T. B.; Liu, L. et al. Angew. Chem., Int. Ed. 2012, 51, 528. Ni catalyst: Dudnik, A. S.; Fu, G. C. J. Am. Chem. Soc. 2012, 134, 10693. Pd catalyst: Joshi-Pangu, A.; Ma, X.; Diane, M.; Iqbal, S.; Kribs, R. J.; Huang, R.; Wang, C.-Y.; Biscoe, M. R. J. Org. Chem. 2012, 77, 6629. Pd, Ni catalyst: Yi, J.; Liu, J. H.; Liang, J.; Dai, J. J.; Yang, C.-T.; Fu, Y.; Liu, L. ? Adv. Synth. Catal. 2012, 354, 1685. Fe catalyst: Atack, T. C.; Lecker, R. M.; Cook, S. P. J. Am. Chem. Soc. 2014, ASAP. Zn catalyst: Bose, S. K.; Fucke, K.; Liu, L.; Steel, P. G.; Marder, T. B. Angew. Chem., Int. Edit. 2014, 53, 1799. 競争が激しい研究対象
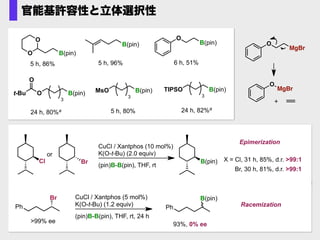
- 40. O O B(pin) t-Bu O O B(pin) 3 TIPSO B(pin) 3 MsO B(pin) 3 O B(pin) 5 h, 86% 6 h, 51% 24 h, 80%a 5 h, 80% 24 h, 82%a B(pin) 5 h, 96% 官能基許容性と立体選択性 O MgBr O MgBr + Cl Br or CuCl / Xantphos (10 mol%) K(O-t-Bu) (2.0 equiv) (pin)B-B(pin), THF, rt B(pin) X = Cl, 31 h, 85%, d.r. >99:1 Br, 30 h, 81%, d.r. >99:1 Epimerization Ph Br >99% ee Ph B(pin) 93%, 0% ee Racemization CuCl / Xantphos (5 mol%) K(O-t-Bu) (1.2 equiv) (pin)B-B(pin), THF, rt, 24 h
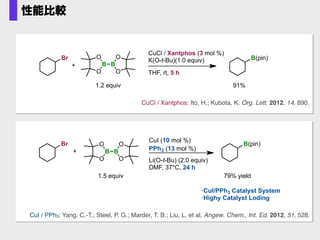
- 41. CuCl / Xantphos: Ito, H.; Kubota, K. Org. Lett. 2012, 14, 890. Br + CuCl / Xantphos (3 mol %) K(O-t-Bu)(1.0 equiv) THF, rt, 5 h B(pin) B B O OO O 1.2 equiv 91% CuI / PPh3: Yang, C.-T.; Steel, P. G.; Marder, T. B.; Liu, L. et al. Angew. Chem., Int. Ed. 2012, 51, 528. CuI (10 mol %) PPh3 (13 mol %)B B O OO O + Br Li(O-t-Bu) (2.0 equiv) DMF, 37°C, 24 h B(pin) 79% yield ·CuI/PPh3 Catalyst System ·Highy Catalyst Loding 1.5 equiv 性能比較
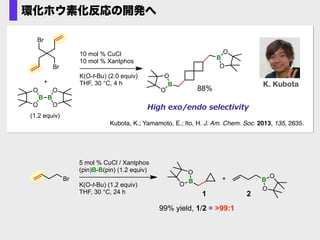
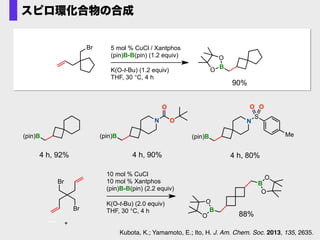
- 42. K. Kubota Kubota, K.; Yamamoto, E.; Ito, H. J. Am. Chem. Soc. 2013, 135, 2635. B B 88% O O O O O B O B O O (1.2 equiv) Br Br + 10 mol % CuCl 10 mol % Xantphos K(O-t-Bu) (2.0 equiv) THF, 30 °C, 4 h High ?exo/endo ?selectivity 環化ホウ素化反応の開発へ 5 mol % CuCl / Xantphos (pin)B-B(pin) (1.2 equiv) K(O-t-Bu) (1.2 equiv) THF, 30 °C, 24 h B O O +Br B O O 1 2 99% yield, 1/2 = >99:1
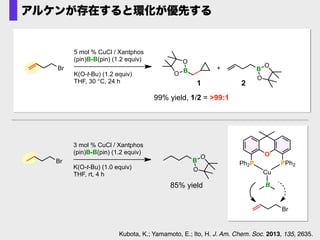
- 43. B Cu Br O Ph2P PPh2 5 mol % CuCl / Xantphos (pin)B-B(pin) (1.2 equiv) K(O-t-Bu) (1.2 equiv) THF, 30 °C, 24 h B O O +Br B O O 1 2 99% yield, 1/2 = >99:1 3 mol % CuCl / Xantphos (pin)B-B(pin) (1.2 equiv) K(O-t-Bu) (1.0 equiv) THF, rt, 4 h Br B O O 85% yield アルケンが存在すると環化が優先する Kubota, K.; Yamamoto, E.; Ito, H. J. Am. Chem. Soc. 2013, 135, 2635.
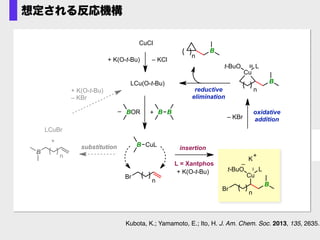
- 44. Br n Cu B Lt-BuO I – K + LCu(O-t-Bu) B CuL Br B LCuBr + n substitution insertion + K(O-t-Bu) – KBr n L = Xantphos + K(O-t-Bu) oxidative addition n Cu B Lt-BuO III reductive elimination n B CuCl + K(O-t-Bu) – KCl B B+BOR– – KBr 想定される反応機構 Kubota, K.; Yamamoto, E.; Ito, H. J. Am. Chem. Soc. 2013, 135, 2635.
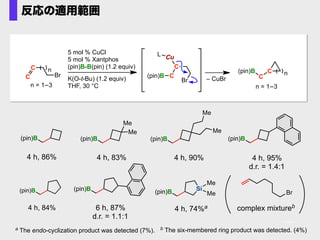
- 45. a The endo-cyclization product was detected (7%). (pin)B 4 h, 86% (pin)B Me Me 4 h, 83% (pin)B Me Me 4 h, 90% (pin)B 4 h, 95% d.r. = 1.4:1 (pin)B 4 h, 84% (pin)B 6 h, 87% d.r. = 1.1:1 Si(pin)B Me Me 4 h, 74%a 5 mol % CuCl 5 mol % Xantphos (pin)B-B(pin) (1.2 equiv) K(O-t-Bu) (1.2 equiv) THF, 30 °C n C C Cu (pin)B – CuBr C n n = 1?3 n = 1?3 C C Br Br C (pin)B L b The six-membered ring product was detected. (4%) complex mixtureb Br 反応の適用範囲
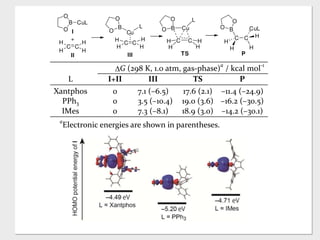
- 46. tion C C H HH H CuLB + I O O II C C H HH H Cu B L III O O CuB L C C H H H H O O TS P C C H B CuL H H H O O ?G (298 K, 1.0 atm, gas-phase)a / kcal mol-1 L I+II III TS P Xantphos 0 7.1 (–6.5) 17.6 (2.1) –11.4 (–24.9) PPh3 0 3.5 (–10.4) 19.0 (3.6) –16.2 (–30.5) IMes 0 7.3 (–8.1) 18.9 (3.0) –14.2 (–30.1) a Electronic energies are shown in parentheses. DFT calculations revealed that the activation barrier We h shown in via the re ture ini borylcopp used as t sessed th substrate with con coordinat dative ad of the st mediate tion post with cup copper m uct 5, as membere mechanis ate (E, n When a m activity o would be 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40
- 47. (pin)B 4 h, 92% (pin)B 4 h, 90% N O O Br Br + 10 mol % CuCl 10 mol % Xantphos (pin)B-B(pin) (2.2 equiv) K(O-t-Bu) (2.0 equiv) THF, 30 °C, 4 h B B 88% O O O O (pin)B 4 h, 80% N S O O Me Br 5 mol % CuCl / Xantphos (pin)B-B(pin) (1.2 equiv) K(O-t-Bu) (1.2 equiv) THF, 30 °C, 4 h B 90% O O Kubota, K.; Yamamoto, E.; Ito, H. J. Am. Chem. Soc. 2013, 135, 2635. スピロ環化合物の合成
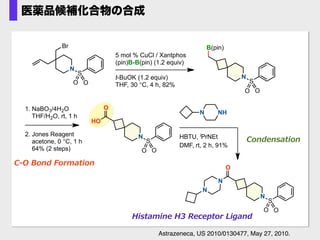
- 48. 1. NaBO3/4H2O THF/H2O, rt, 1 h 2. Jones Reagent acetone, 0 °C, 1 h 64% (2 steps) NHN HBTU, iPrNEt DMF, rt, 2 h, 91% C-‐??O ?Bond ?Formation Condensation Histamine ?H3 ?Receptor ?Ligand O N S O O HO O N S O O N N 5 mol % CuCl / Xantphos (pin)B-B(pin) (1.2 equiv) t-BuOK (1.2 equiv) THF, 30 °C, 4 h, 82% B(pin) N S O O N S O O Br Astrazeneca, US 2010/0130477, May 27, 2010. 医薬品候補化合物の合成
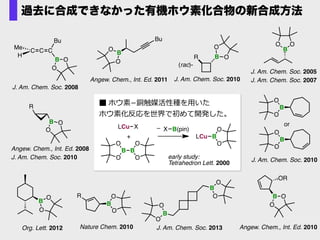
- 49. 過去に合成できなかった有機ホウ素化合物の新合成方法 early study: Tetrahedron Lett. 2000 B OO J. Am. Chem. Soc. 2005 J. Am. Chem. Soc. 2007 B OR O O Angew. Chem., Int. Ed. 2010 BR O O J. Am. Chem. Soc. 2010 (rac)- R B O O Angew. Chem., Int. Ed. 2008 J. Am. Chem. Soc. 2010 C C C B Bu Me H O O J. Am. Chem. Soc. 2008 B O O J. Am. Chem. Soc. 2010 B O O or B B O O O O J. Am. Chem. Soc. 2013 B O O Org. Lett. 2012 R B O O Nature Chem. 2010 Bu B O O Angew. Chem., Int. Ed. 2011 B B O OO O LCu X + LCu B O OX B(pin)–
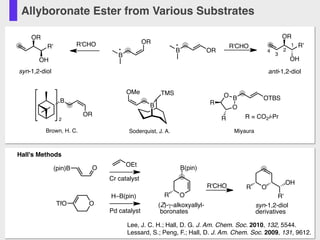
- 50. Allyboronate Ester from Various Substrates OR R' OH OR R'CHO 1 2 3 4 OR R' OH R'CHO OR anti-1,2-diolsyn-1,2-diol B B * * B OR 2 B TMSOMe Soderquist, J. A. B OTBS O O R R MiyauraBrown, H. C. R = CO2i-Pr Lee, J. C. H.; Hall, D. G. J. Am. Chem. Soc. 2010, 132, 5544. Lessard, S.; Peng, F.; Hall, D. J. Am. Chem. Soc. 2009, 131, 9612. R' OH R'CHO syn-1,2-diol derivatives O B(pin) O Hall's Methods O(pin)B OTfO OEt R Cr catalyst Pd catalyst H–B(pin) R (Z)-γ-alkoxyallyl- boronates
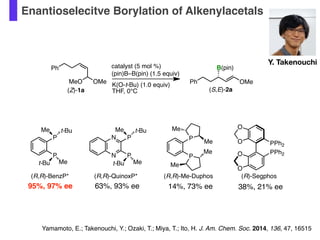
- 51. Enantioselecitve Borylation of Alkenylacetals Y. Takenouchicatalyst (5 mol %) OMe B(pin) PhK(O-t-Bu) (1.0 equiv) THF, 0°C(Z)-1a (S,E)-2a Ph P P Me t-Bu t-Bu Me (R,R)-BenzP* N N P P Me t-Bu t-Bu Me (R,R)-QuinoxP* P P Me Me Me Me (R,R)-Me-Duphos OMeMeO (pin)B–B(pin) (1.5 equiv) O O O O PPh2 PPh2 (R)-Segphos 95%, 97% ee 63%, 93% ee 14%, 73% ee 38%, 21% ee Yamamoto, E.; Takenouchi, Y.; Ozaki, T.; Miya, T.; Ito, H. J. Am. Chem. Soc. 2014, 136, 47, 16515
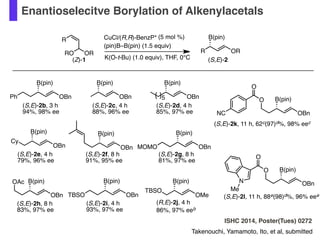
- 52. Enantioselecitve Borylation of Alkenylacetals Takenouchi, Yamamoto, Ito, et al, submitted ISHC 2014, Poster(Tues) 0272 (5 mol %) R OR B(pin) K(O-t-Bu) (1.0 equiv), THF, 0°C(Z)-1 (S,E)-2 R ORRO CuCl/(R,R)-BenzP* (pin)B–B(pin) (1.5 equiv) OMe B(pin) TBSO (R,E)-2j, 4 h 86%, 97% eeb OBn B(pin) (S,E)-2b, 3 h 94%, 98% ee OBn B(pin) (S,E)-2c, 4 h 88%, 96% ee OBn B(pin) (S,E)-2d, 4 h 85%, 97% ee 5 OBn B(pin) (S,E)-2e, 4 h 79%, 96% ee Cy OBn B(pin) (S,E)-2f, 8 h 91%, 95% ee OBn B(pin) (S,E)-2h, 8 h 83%, 97% ee OAc OBn B(pin) (S,E)-2g, 8 h 81%, 97% ee MOMO Ph OBn B(pin) (S,E)-2k, 11 h, 62c(97)d%, 98% eec OBn B(pin) (S,E)-2l, 11 h, 88e(98)d%, 96% eee (S,E)-2i, 4 h 93%, 97% ee OBn B(pin) TBSO O O N Me O O NC
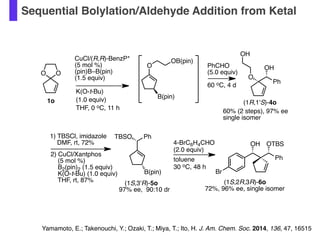
- 53. Sequential Bolylation/Aldehyde Addition from Ketal 1) TBSCl, imidazole DMF, rt, 72% 2) CuCl/Xantphos (5 mol %) B2(pin)2 (1.5 equiv) K(O-t-Bu) (1.0 equiv) THF, rt, 87% TBSO Ph B(pin) OTBSOH Ph (1S,2R,3R)-6o 72%, 96% ee, single isomer (1S,3'R)-5o 97% ee, 90:10 dr 4-BrC6H4CHO (2.0 equiv) PhCHO (5.0 equiv) 60 oC, 4 d 60% (2 steps), 97% ee single isomer OH O Ph OO O OB(pin) B(pin) 1o OH CuCl/(R,R)-BenzP* (5 mol %) (pin)B–B(pin) (1.5 equiv) Br toluene 30 oC, 48 h K(O-t-Bu) (1.0 equiv) THF, 0 oC, 11 h (1R,1'S)-4o Yamamoto, E.; Takenouchi, Y.; Ozaki, T.; Miya, T.; Ito, H. J. Am. Chem. Soc. 2014, 136, 47, 16515
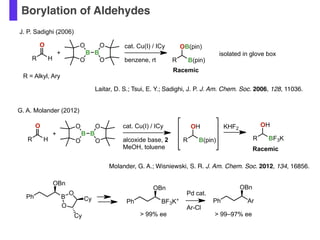
- 54. Borylation of Aldehydes R H O R = Alkyl, Ary cat. Cu(I) / ICy benzene, rt B B O O O O + R B(pin) OB(pin) J. P. Sadighi (2006) Racemic isolated in glove box cat. Cu(I) / ICy alcoxide base, 2 MeOH, toluene R B(pin) OH G. A. Molander (2012) KHF2 R BF3K OH Racemic R H O B B O O O O + Laitar, D. S.; Tsui, E. Y.; Sadighi, J. P. J. Am. Chem. Soc. 2006, 128, 11036. Molander, G. A.; Wisniewski, S. R. J. Am. Chem. Soc. 2012, 134, 16856. Ph B O O Cy Cy OBn Ph BF3K+ OBn Ph Ar OBn > 99% ee > 99–97% ee Pd cat. Ar-Cl
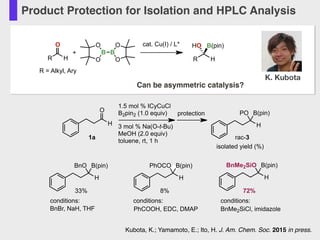
- 55. Product Protection for Isolation and HPLC Analysis R H O R = Alkyl, Ary B B O O O O + cat. Cu(I) / L* R H B(pin)HO Can be asymmetric catalysis? O H 1.5 mol % ICyCuCl B2pin2 (1.0 equiv) 3 mol % Na(O-t-Bu) MeOH (2.0 equiv) toluene, rt, 1 h 1a protection H B(pin)PO H B(pin)BnO BnBr, NaH, THF H B(pin)PhOCO PhCOOH, EDC, DMAP H B(pin)BnMe2SiO BnMe2SiCl, imidazole isolated yield (%) rac-3 conditions: conditions: 33% 8% 72% conditions: K. Kubota Kubota, K.; Yamamoto, E.; Ito, H. J. Am. Chem. Soc. 2015 in press.
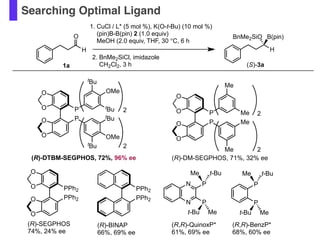
- 56. Searching Optimal Ligand O 1. CuCl / L* (5 mol %), K(O-t-Bu) (10 mol %) (pin)B-B(pin) 2 (1.0 equiv) MeOH (2.0 equiv, THF, 30 °C, 6 h 2. BnMe2SiCl, imidazole CH2Cl2, 3 h1a H (S)-3a H BnMe2SiO B(pin) P P Me t-Bu t-Bu Me (R,R)-BenzP* 68%, 60% ee N N P P Me t-Bu t-Bu Me (R,R)-QuinoxP* 61%, 69% ee O O O O PPh2 PPh2 PPh2 PPh2 (R)-SEGPHOS 74%, 24% ee (R)-BINAP 66%, 69% ee O O O O P P Me Me Me Me 2 2 (R)-DM-SEGPHOS, 71%, 32% ee O O O O P P tBu OMe tBu tBu OMe tBu 2 2 (R)-DTBM-SEGPHOS, 72%, 96% ee
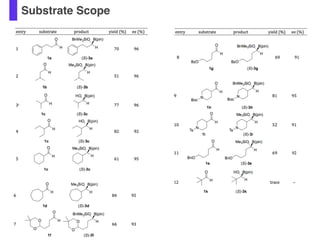
- 57. Substrate Scope
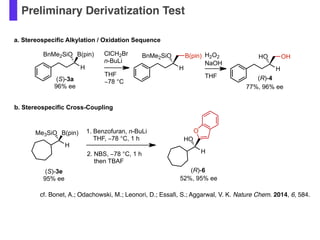
- 58. Preliminary Derivatization Test cf. Bonet, A.; Odachowski, M.; Leonori, D.; Essa?, S.; Aggarwal, V. K. Nature Chem. 2014, 6, 584. (S)-3a 96% ee ClCH2Br n-BuLi THF ?78 °C H BnMe2SiO (R)-4 B(pin) H HO OH 77%, 96% ee H2O2 NaOH THF H Me3SiO B(pin) 1. Benzofuran, n-BuLi THF, ?78 °C, 1 h H HO O 2. NBS, ?78 °C, 1 h then TBAF (S)-3e 95% ee 52%, 95% ee (R)-6 b. Stereospecific Cross-Coupling a. Stereospecific Alkylation / Oxidation Sequence H BnMe2SiO B(pin)
- 59. 本日の講演内容 1. 銅触媒によるホウ素化反応:? 光学活性アルキルホウ素化合物の合成方法 3. メカノ応答性をもつ発光性金錯体 2. BBSホウ素化反応:? 遷移金属フリーでかつ官能基共存性のある? 芳香族ホウ素化合物の合成方法
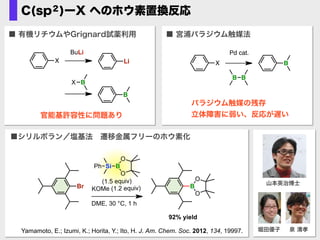
- 60. ■シリルボラン/塩基法?遷移金属フリーのホウ素化 92% yield (1.5 equiv) KOMe (1.2 equiv) DME, 30 °C, 1 h Si B O O Br B O O Ph Yamamoto, E.; Izumi, K.; Horita, Y.; Ito, H. J. Am. Chem. Soc. 2012, 134, 19997. 山本英治博士 堀田優子 泉 清孝 ■ 有機リチウムやGrignard試薬利用 B X Li BuLi BX 官能基許容性に問題あり ■ 宮浦パラジウム触媒法 X Pd cat. B B B パラジウム触媒の残存 立体障害に弱い、反応が遅い C(sp2)ーX へのホウ素置換反応
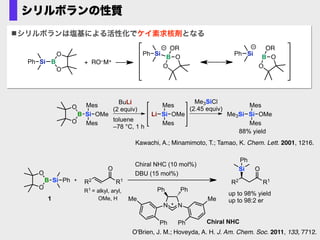
- 61. シリルボランの性質 シリルボランは塩基による活性化でケイ素求核剤となる O B O Si Mes Mes OMe Si Mes Mes OMeLi BuLi (2 equiv) toluene –78 °C, 1 h Me3SiCl (2.45 equiv) Si Mes Mes OMeMe3Si 88% yield Kawachi, A.; Minamimoto, T.; Tamao, K. Chem. Lett. 2001, 1216. Chiral NHC (10 mol%) O B O Si Ph R1 O R2 1 R1 O R2 Si up to 98% yield up to 98:2 er R1 = alkyl, aryl, OMe, H DBU (15 mol%) Ph N N Ph Ph Ph Ph Me Me Chiral NHC O'Brien, J. M.; Hoveyda, A. H. J. Am. Chem. Soc. 2011, 133, 7712. Si B O O Ph + RO–M+ Si B O O Ph OR Si B O O Ph OR
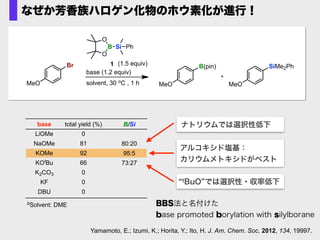
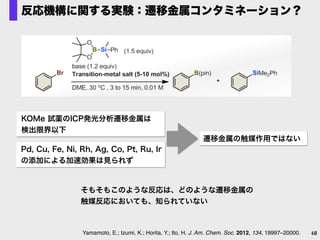
- 62. Br base (1.2 equiv) solvent, 30 oC , 1 h B(pin) MeO MeO SiMe2Ph1 MeO O B O Si Ph (1.5 equiv) なぜか芳香族ハロゲン化物のホウ素化が進行! Yamamoto, E.; Izumi, K.; Horita, Y.; Ito, H. J. Am. Chem. Soc. 2012, 134, 19997. base LiOMe NaOMe KOMe KOtBu K2CO3 KF DBU B/Si 80:20 95:5 73:27 total yield (%) 0 81 92 66 0 0 0 bSolvent: DME tBuO では選択性?収率低下 ナトリウムでは選択性低下 アルコキシド塩基: カリウムメトキシドがベスト BBS法と名付けた base promoted borylation with silylborane
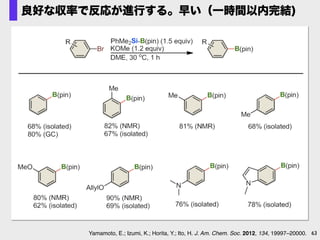
- 63. 63Yamamoto, E.; Izumi, K.; Horita, Y.; Ito, H. J. Am. Chem. Soc. 2012, 134, 19997–20000. 良好な収率で反応が進行する。早い(一時間以内完結)
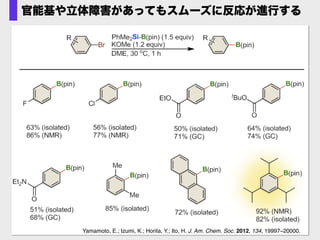
- 64. Yamamoto, E.; Izumi, K.; Horita, Y.; Ito, H. J. Am. Chem. Soc. 2012, 134, 19997–20000. 官能基や立体障害があってもスムーズに反応が進行する
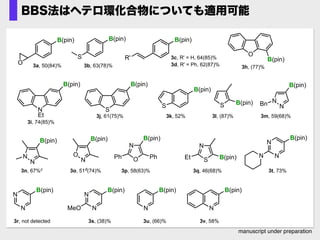
- 65. manuscript under preparation BBS法はヘテロ環化合物についても適用可能 3k, 52% 3l, (87)% B(pin) S 3h, (77)% 3i, 74(85)% O B(pin) N Et B(pin) 3j, 61(75)% S B(pin) 3p, 58(63)% N NBn B(pin) O N B(pin) S B(pin) N N B(pin) N O B(pin) Ph Ph N SEt B(pin) N N B(pin) N N B(pin) N N B(pin) MeO N 3m, 59(68)% 3n, 67%c 3o, 51d(74)% 3q, 46(68)% 3r, not detected 3s, (38)% 3t, 73% B(pin) 3c, R' = H, 64(85)% B(pin) 3a, 50(84)% O S B(pin) 3b, 63(78)% R' 3d, R' = Ph, 62(87)% 3u, (66)% N B(pin) 3v, 58% N B(pin)
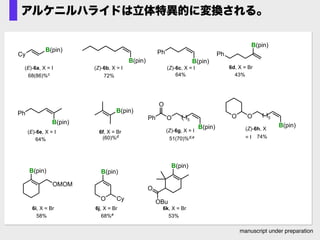
- 66. manuscript under preparation アルケニルハライドは立体特異的に変換される。 B(pin) Cy B(pin) B(pin) Ph B(pin) OMOM B(pin) B(pin) B(pin) 68(86)%c 72% 64% (60)%d B(pin) O 5 B(pin) O B(pin) Ph Ph 64% 74% 43% O OBu 58% 53% 51(70)%d,e O B(pin) Cy 68%e (E)-6a, X = I (Z)-6b, X = I (Z)-6c, X = I (Z)-6g, X = I (Z)-6h, X = I 6d, X = Br (E)-6e, X = I 6f, X = Br 6j, X = Br6i, X = Br 6k, X = Br OPh O 5
- 68. 遷移金属の触媒作用ではない 68 Pd, Cu, Fe, Ni, Rh, Ag, Co, Pt, Ru, Ir? の添加による加速効果は見られず KOMe 試薬のICP発光分析遷移金属は? 検出限界以下 Yamamoto, E.; Izumi, K.; Horita, Y.; Ito, H. J. Am. Chem. Soc. 2012, 134, 19997–20000. 反応機構に関する実験:遷移金属コンタミネーション? そもそもこのような反応は、どのような遷移金属の 触媒反応においても、知られていない
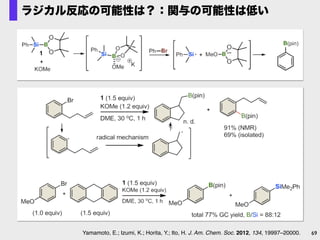
- 69. 69Yamamoto, E.; Izumi, K.; Horita, Y.; Ito, H. J. Am. Chem. Soc. 2012, 134, 19997–20000. ラジカル反応の可能性は?:関与の可能性は低い
- 70. 70 AFIR自動反応経路探索: 北海道大学 前田?武次先生 Ref: 前田理、畑中美穂、植松遼平、武次徹也、諸熊奎治? 人工力誘起反応法による化学反応経路の自動探索: 有機合成化学への応用と展望 有機合成化学協会誌, 2014, 5, 567. S. Maeda T. Taketsugu RO– M+ Si B O O Ph X
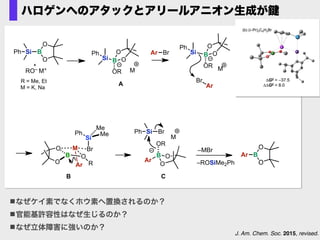
- 71. J. Am. Chem. Soc. 2015, revised. ハロゲンへのアタックとアリールアニオン生成が鍵 RO– M+ Si B O O Ph OB O OR Si Ph M BrAr Ar Br Si BrPh OB O OR Ar M B O O Ar OB O OR Si Ph M –MBr B O O O R M Ar Br Si Me MePh –ROSiMe2Ph A B C R = Me, Et M = K, Na なぜケイ素でなくホウ素へ置換されるのか? 官能基許容性はなぜ生じるのか? なぜ立体障害に強いのか?
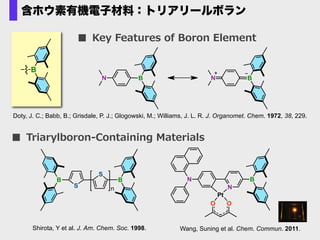
- 72. ■ Key ?Features ?of ?Boron ?Element N N Pt OO B Wang, Suning et al. Chem. Commun. 2011. ■ Triarylboron-‐??Containing ?Materials N B N B B B S S B n Shirota, Y et al. J. Am. Chem. Soc. 1998. Doty, J. C.; Babb, B.; Grisdale, P. J.; Glogowski, M.; Williams, J. L. R. J. Organomet. Chem. 1972, 38, 229. 含ホウ素有機電子材料:トリアリールボラン
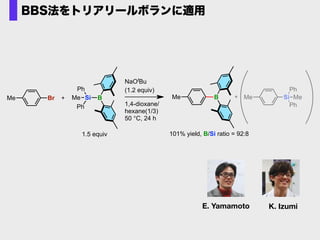
- 73. K. IzumiE. Yamamoto Me Si Ph Ph MeBrMe SiMe Ph Ph 1.5 equiv B Me B 101% yield, B/Si ratio = 92:8 NaOtBu (1.2 equiv) 1,4-dioxane/ hexane(1/3) 50 °C, 24 h BBS法をトリアリールボランに適用
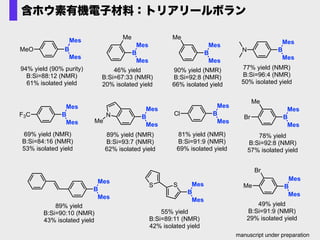
- 74. 含ホウ素有機電子材料:トリアリールボラン MeO B Mes Mes 94% yield (90% purity) B:Si=88:12 (NMR) 61% isolated yield B Me Mes Mes 90% yield (NMR) B:Si=92:8 (NMR) 66% isolated yield F3C B Mes Mes 69% yield (NMR) B:Si=84:16 (NMR) 53% isolated yield B Me Mes Mes 46% yield B:Si=67:33 (NMR) 20% isolated yield N B Mes Mes 77% yield (NMR) B:Si=96:4 (NMR) 50% isolated yield N Me B Mes Mes 89% yield (NMR) B:Si=93:7 (NMR) 62% isolated yield Cl B Mes Mes 81% yield (NMR) B:Si=91:9 (NMR) 69% isolated yield B Mes Mes 89% yield B:Si=90:10 (NMR) 43% isolated yield B SS Mes Mes 55% yield B:Si=89:11 (NMR) 42% isolated yield Me Br B Mes Mes 78% yield B:Si=92:8 (NMR) 57% isolated yield Me Br B Mes Mes 49% yield B:Si=91:9 (NMR) 29% isolated yield manuscript under preparation



![有機ホウ素化合物の基本的な性質
■ RB(OR)2 は塩基の添加により活性化される。
B
OR
OR
R
OR
ORB
OR
OR
R B
OR
OR
R OR
■ 様々なボロン酸エステル
O
O
BR
O
O
BR
O
O
BR
O
O
BR
R
R
R B(pin)
R Bpin
OH
OH
BR
O
B
O
B
O
B
R R
R
boroxine
–H2O
■ ボロン酸は縮合に注意
■ ボロン酸の保護基
R BF3
-K+
B N
O
O
O
O
MeR
N
B
N
R
H
H
Burke, 2008 Suginome, 2007
R B(dan)MIDA boronate
B
O
O
OR
M+
Miyaura, 2008
BAr
■ その他の安定化
Hc
and Hd
in Figu
and 7.76 and 9.02 p
of 1a in [D2]tetr
relatively downfie
are attributed to t
the neighboring b
deshielded singlet
atom, which reflec
(see the Supporti
1
H NMR measure
significant change
a large energy ga
Scheme 1. Stepwise boron doping of an extended polyaromatic hydro-
carbon.
Scheme 2. Synthesis of B-doped nanographene 1a. Reagents and
Figure 1. 1
H NMR sp
平面化: Yamaguchi, 2012
立体障害導入](https://image.slidesharecdn.com/parti-150526115717-lva1-app6892/85/Part-I-5-320.jpg)
![of 1a in [D2]tetrachloroethane at 353 K (F
relatively downfield chemical shifts of the Hb
are attributed to the deshielding effect by the
the neighboring benzene rings in the cove reg
deshielded singlet signal at 10.85 ppm corresp
atom, which reflects the close contact with the
(see the Supporting Information).[13]
Variabl
1
H NMR measurements from 193 to 353 K did
significant change. This temperature independ
a large energy gap between the singlet close
state and a triplet excited state. The gap w
theoretically to be 34.9 kcalmol?1
for 1a at
31G* level, which is far larger than that of the p
doping of an extended polyaromatic hydro-
oped nanographene 1a. Reagents and
O, from 08C to 258C, then 5, toluene, from
NO2 and CH2Cl2.
Figure 1. 1
H NMR spectrum of 1a in [D2]tetrachloroeth
Yamaguchi, 2012
Fig. 9 Left: the structure of compound 17. Middle: A green OLED based on
2C
Fig. 9 Left: the structure of compound 17. Middle: A green OLED based on compound 15. Right: An orange OLED based on
4. Devices incorporating 8 wt.% of this material doped into
CBP (4,4?-bis(9-carbazolyl)biphenyl) showed remarkably high
ef?ciency red phosphorescence, with maximum current, power and
external quantum ef?ciencies (EQEs) of 10.31 cd A-1
, 5.04 lm W-1
and 9.36%, respectively. It should be noted that, while much higher
ef?ciencies have been achieved with the parent green phosphor
Ir(ppy)2(acac) using a similar device structure,8a,b
the performance
of 4 is still very impressive as it is a red emitter and is expected to
improving electron mobility in the emissive layer is
that can be used to achieve better carrier balance i
To con?rm that the BMes2 group indeed impro
transport in the device, we fabricated single-carri
capable of transporting electrons only from thin
or Pt(ppy)(acac). Remarkably, the ?lm of 15 was
supporting a current density 3–4 orders of magnitude
that of Pt(ppy)(acac), indicative of markedly impro
11a
19November2012
sc.org|doi:10.1039/C1DT10292C
Wang, 2010
■有機ホウ素化合物の高効率合成法の開発はますます重要になっている
●官能基許容性 ●光学活性隊の不斉合成 ●遷移金属フリー ●立体障害克服 ●低コスト
■ 有機ホウ素化合物そのものを医薬品としたもの
有機ホウ素化合物のニーズの高まり
N
H
H
N B
O
N
N
Ph
O
OH
OH
O
B
F
OH
Bortezomib, 悪性リンパ腫治療薬 Tavaborole, 抗真菌剤
カルボン酸
の拮抗作用
糖鎖認識
■ 有機電子材料を志向した化合物
有機EL](https://image.slidesharecdn.com/parti-150526115717-lva1-app6892/85/Part-I-8-320.jpg)

![既存の合成方法では?
■ 触媒的不斉ホウ素化: 限定的(実は二三例しかない)
Ph
[Rh(cod)2]BF4 (1 mol %)
(R)-BINAP (1 mol %)
–78°C, 6 h
O
HB
O
+ Ph
B(cat)
91%, 96.2 % ee
Hayashi, T.; Matsumoto, Y.; Ito, Y. J. Am. Chem. Soc. 1989, 111, 3426.!
■ 不斉ホウ素化合物を用いるヒドロホウ素化: 化学量論量の不斉源
BH
2 +
H B(ipc)2 H OHoxidation
99% ee
OH
+ 2
H B+
H
B
■ ヒドロホウ素化:代表的な有機ホウ素化合物の合成方法の一つ](https://image.slidesharecdn.com/parti-150526115717-lva1-app6892/85/Part-I-11-320.jpg)