reaksi redoks
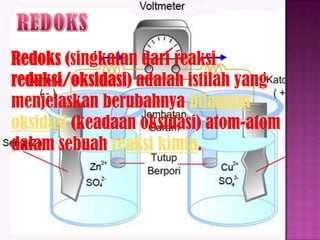
- 2. Redoks (singkatan dari reaksi reduksi/oksidasi) adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
- 4. Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi •Oksidasi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion •Reduksi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
- 5. ada dua metode yang dapat digunakan untuk meyetarakannnya, yaitu: 1. Metode bilangan oksidasi, yang digunakan untuk reaksi yang berlangsung tanpa atau dalam air, dan memiliki persamaan reaksi lengkap (bukan ionik). 2. Metode setengah reaksi (metode ion elektron), yang digunakan untuk reaksi yang berlangsung dalam air dan memiliki persamaan ionik.
- 6. Contoh reaksi reduksi : a. Reduksi bijih besi (Fe2O3, hematite) oleh karbon (C) Reaksi : 2 Fe2O3(s) + 3 C(s) " 4 Fe(s) + 3 CO2(g) b. Tembaga(II) oksida direaksikan dengan gas hidrogen untuk mendapatkan logamnya. Reaksi : CuO(s) + H2(g) " Cu(g) + H2O(g)
- 7. Contoh reaksi oksidasi : a. Perkaratan besi oleh gas oksigen Reaksi : 4 Fe(s) + 3O2(g) " 2Fe2O3(s) b. Pembakaran logam magnesium di udara. Reaksi : 2 Mg(s) + O2(g) " 2MgO(s)
- 8. Contoh Reaksi Redoks Contoh reaksi redoks adalah apabila batang tembaga dicelupkan dalam larutan perak nitrat, maka lapisan putih mengkilat akan terjadi pada permukaan batang tembaga dan larutan berubah menjadi biru. Reaksi redoks terjadi antara logam tembaga dan larutan perak nitrat
- 9. Dalam hal ini bilangan oksidasi tembaga naik dari 0 menjadi +2 dan bilangan oksidasi perak turun dari +1 menjadi 0. Tembaga mengalami oksidasi dan perak mengalami reduksi. Persamaan reaksi antara keduanya dapat dituliskan sebagai berikut: Cu(NO)3 (aq) + 2 Ag (s) atau Cu (s) + 2 Ag+ (aq)
- 10. LANGKAH-LANGKAH PENYETARAAN REAKSI REDOKS Prinsip dasar metode ini adalah jumlah kenaikan bilangan oksidasi dari reduktor (zat yang teroksidasi) sama dengan jumlah penurunan bilangan reduksi dari oksidator (zat yang tereduksi). Metode setengah reaksi digunakan untuk reaksi redoks yang memiliki persamaan reaksi ionik dimana serah terima elektron digambarkan dengan jelas.
- 11. Ada dua macam sel elektrokimia, yaitu sebagai berikut. 1. Sel Volta (Sel Galvani) Dalam sel ini energi kimia diubah menjadi energi listrik atau reaksi redoks menghasilkan arus listrik. 2. Sel Elektrolisis Dalam sel ini energi listrik diubah menjadi energi kimia atau arus listrik menghasilkan reaksi redoks.