Reduksioksidasi
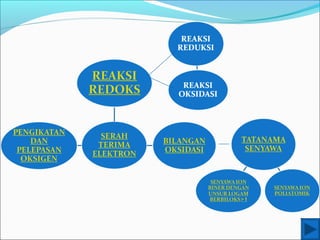
- 3. REAKSI REDOKS REAKSI REDOKS MERUPAKAN GABUNGAN DARI DUA REAKSI, YAITU REAKSI OKSIDASI DAN REAKSI REDUKSI.
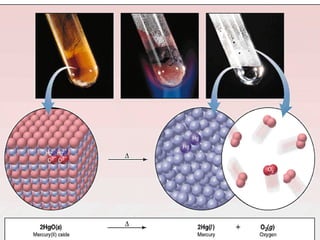
- 4. REDOKS BERDASARKAN PENGIKATAN DAN PELEPASAN OKSIGEN OKSIDASI REDUKSI 1. Oksidasi suatu unsur akan menghasilkan suatu oksida. 4Fe +O2 2Fe2O3 2Mn + O2 2MnO 2. Oksidasi senyawa sulfida menghasilkan oksida logam penyusunnya. 4FeS2 +11O2 2Fe2O3 + 8SO2 3. Oksidasi atau pembakaran senyawa karbon menghasilkan gas karbondioksida dan air. C3H8 + 5O2 3CO2 + 4H2O C12H22O11 + 12O2 12CO2 + 11H2O 1. Pemanasan raksa oksida (HgO) 2HgO 2Hg + O2 2. Pemanasan kalium klorat (KClO3) 2KClO3 2KCl + 3O2 OKSIDASI = PENGIKATAN OKSIGEN REDUKSI = PELEPASAN OKSIGEN C + O2  CO2 S + O2  SO2 N2 + O2  2NO
- 6. REDOKS BERDASARKAN PERPINDAHAN ELEKTRON 1. 2Cu + O2 2CuO 2. Cu + Cl2 CuCl2 2Cu 2Cu2+ + 4e (Oksidasi) O2 + 4e 2O2- (Reduksi) 2Cu + O2 2CuO (Redoks) Cu Cu2+ + 2e (Oksidasi) Cl2 + 2e 2Cl- (Reduksi) Cu + Cl2 CuCl2 (Redoks) OKSIDASI = PELEPASAN ELEKTRON REDUKSI = PENGIKATAN ELEKTRON
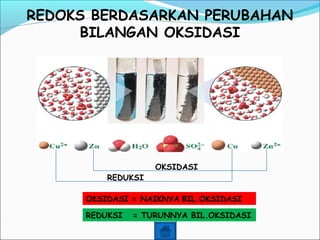
- 7. REDOKS BERDASARKAN PERUBAHAN BILANGAN OKSIDASI REDUKSI OKSIDASI OKSIDASI = NAIKNYA BIL.OKSIDASI REDUKSI = TURUNNYA BIL.OKSIDASI
- 8. ATURAN CONTOH 1.Bilangan oksidasi unsur bebas adalah nol. 2.Bilangan oksidasi monoatom sama dengan muatan ionnya. 3.Jumlah bilangan oksidasi atom-atom pembentuk ion poliatom sama dengan muatan ion poliatom tersebut. 1.Bilangan oksidasi atom-atom pada Ne, H2, O2, Cl2, P4, S8, C, Cu, Fe,dan Na adalah nol. 2.Bilangan oksidasi Na+ = +1, bilangan oksidasi Mg2+ = +2, bilangan oksidasi S2- = -2 3.Jumlah bilangan oksidasi atom S dan atom O dalam SO4 2- adalah -2 ATURAN PENENTUAN BILANGAN OKSIDASI
- 9. 4.Jumlah bilangan oksidasi untuk semua atom dalam senyawa adalah nol. 5.Bilangan oksidasi unsur-unsur logam golongan utama (IA,IIA,IIIA) sesuai dengan nomor golongannya. 6.Bilangan oksidasi unsur-unsur logam golangan transisi lebih dari satu. 7.Biloks.hidrogen dalam senyawanya adalah +1, kecuali dalam hidrida, atom hidrogen mempunyai biloks. -1. 8. Biloks.oksigen dalam senyawanya adalah -2, kecuali dalam peroksida (-1) dan dalam senyawa biner dengan fluor (+2) 4.Jumlah bilangan oksidasi atom Cu dan atom O dalam CuO adalah nol. 5.Biloks.K dalam KCl,KNO3,dan K2SO4 = +1, biloks.Ca dalam CaSO4 dan biloks.Mg dalam MgSO4= +2. 6. Biloks.Cu =+1 dan +2 Fe=+2 dan +3 Sn=+2 dan +4 Pb=+2 dan +4 Au=+1 dan +3 7.Biloks. H dalam H2O,NH3 dan HCl = +1, biloks H dalam NaH dan CaH2 = -1. 8.Biloks.O dalam H2O = -2 Biloks.O dalam H2O2 dan BaO2= -1 Biolks.O dalam OF2 = +2
- 10. Assign the oxidation state to each element for the following substances: 1. Cl2 2. NaCl 3. CaCl2 4. H2O 5. NaOH 6. H2SO4 7. Na3PO4 8. CH4 Cl: 0 (pure element) Na: +1(group 1) Cl: -1 (group 7) Ca: +2 (group 2) Cl: -1 (group 7) H: +1 (always) O: -2 (always) Na: +1 O: -2 H: +1 (see above) H: +1 O: -2 S: +6 (+2 +6 – 8 = 0) Na: +1 O: -2 P: +5 (+3 +5 – 8 = 0) H: +1 C: -4 (+4 - 4 = 0)
- 11. EXERCISE : 1.Tentukan biloks Cl dalam KClO4 2.Tentukan biloks Cr dalam Cr2O7 2- 3.Tentukan biloks P dalam PO4 3-
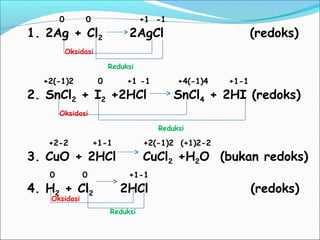
- 12. Bagaimana cara membedakan reaksi redoks dan bukan redoks? Suatu reaksi disebut redoks, jika pada reaksi itu terdapat zat yang mengalami reduksi dan zat yang mengalami oksidasi. Manakah yang bukan reaksi redoks pada reaksi berikut? 1. 2Ag + Cl2 2AgCl 2. SnCl2 + I2 +2HCl SnCl4 + 2HI 3. CuO + 2HCl CuCl2 +H2O 4. H2 + Cl2 2HCl
- 13. 0 0 +1 -1 1. 2Ag + Cl2 2AgCl (redoks) Oksidasi Reduksi +2(-1)2 0 +1 -1 +4(-1)4 +1-1 2. SnCl2 + I2 +2HCl SnCl4 + 2HI (redoks) Oksidasi Reduksi +2-2 +1-1 +2(-1)2 (+1)2-2 3. CuO + 2HCl CuCl2 +H2O (bukan redoks) 0 0 +1-1 4. H2 + Cl2 2HCl (redoks) Oksidasi Reduksi
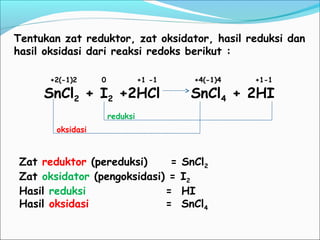
- 14. +2(-1)2 0 +1 -1 +4(-1)4 +1-1 SnCl2 + I2 +2HCl SnCl4 + 2HI Tentukan zat reduktor, zat oksidator, hasil reduksi dan hasil oksidasi dari reaksi redoks berikut : Zat reduktor (pereduksi) = SnCl2 Zat oksidator (pengoksidasi) = I2 Hasil reduksi = HI Hasil oksidasi = SnCl4 oksidasi reduksi
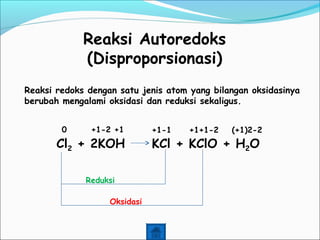
- 15. Reaksi Autoredoks (Disproporsionasi) Reaksi redoks dengan satu jenis atom yang bilangan oksidasinya berubah mengalami oksidasi dan reduksi sekaligus. Cl2 + 2KOH KCl + KClO + H2O 0 +1-2 +1 +1-1 +1+1-2 (+1)2-2 Reduksi Oksidasi
- 16. Bilangan oksidasi untuk menentukan nama senyawa 1.Penamaan senyawa ion biner yang unsur logamnya berbiloks lebih dari satu. 2.Penamaan senyawa ion poliatomik.
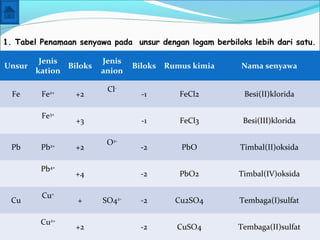
- 17. Unsur Jenis kation Biloks Jenis anion Biloks Rumus kimia Nama senyawa Fe Fe2+ +2 Cl- -1 FeCl2 Besi(II)klorida Fe3+ +3 -1 FeCl3 Besi(III)klorida Pb Pb2+ +2 O2- -2 PbO Timbal(II)oksida Pb4+ +4 -2 PbO2 Timbal(IV)oksida Cu Cu+ + SO42- -2 Cu2SO4 Tembaga(I)sulfat Cu2+ +2 -2 CuSO4 Tembaga(II)sulfat 1. Tabel Penamaan senyawa pada unsur dengan logam berbiloks lebih dari satu.
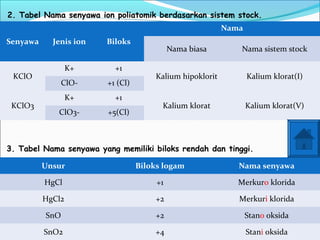
- 18. Senyawa Jenis ion Biloks Nama Nama biasa Nama sistem stock KClO K+ +1 Kalium hipoklorit Kalium klorat(I) ClO- +1 (Cl) KClO3 K+ +1 Kalium klorat Kalium klorat(V) ClO3- +5(Cl) Unsur Biloks logam Nama senyawa HgCl +1 Merkuro klorida HgCl2 +2 Merkuri klorida SnO +2 Stano oksida SnO2 +4 Stani oksida 3. Tabel Nama senyawa yang memiliki biloks rendah dan tinggi. 2. Tabel Nama senyawa ion poliatomik berdasarkan sistem stock.
- 19. Reaksi redoks disekitar kita 1. Reaksi redoks pada pengaratan logam besi. 2. Reaksi redoks pada pemutihan pakaian. 3. Reaksi redoks pada penyetruman akumulator. 4. Reaksi redoks pada ekstraksi logam. 5. Reaksi redoks pada daur ulang perak. Tugas kelompok
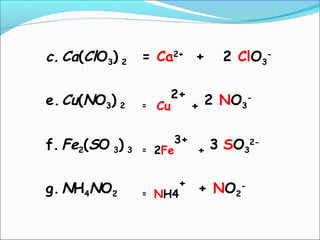
- 20. c. Ca(ClO3) 2 = Ca2+ + 2 ClO3 - e.Cu(NO3) 2 = Cu 2+ + 2 NO3 - f. Fe2(SO 3) 3 = 2Fe 3+ + 3 SO3 2- g. NH4NO2 = NH4 + + NO2 -