Sel volta ipa 1
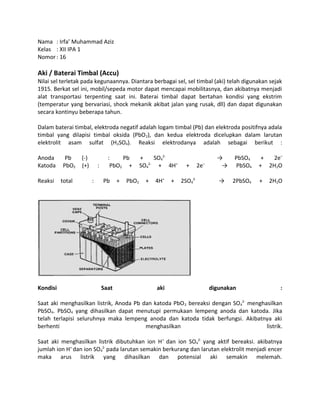
- 1. Nama : Irfa’ Muhammad Aziz Kelas : XII IPA 1 Nomor : 16 Aki / Baterai Timbal (Accu) Nilai sel terletak pada kegunaannya. Diantara berbagai sel, sel timbal (aki) telah digunakan sejak 1915. Berkat sel ini, mobil/sepeda motor dapat mencapai mobilitasnya, dan akibatnya menjadi alat transportasi terpenting saat ini. Baterai timbal dapat bertahan kondisi yang ekstrim (temperatur yang bervariasi, shock mekanik akibat jalan yang rusak, dll) dan dapat digunakan secara kontinyu beberapa tahun. Dalam baterai timbal, elektroda negatif adalah logam timbal (Pb) dan elektroda positifnya adala timbal yang dilapisi timbal oksida (PbO2), dan kedua elektroda dicelupkan dalam larutan elektrolit asam sulfat (H2SO4). Reaksi elektrodanya adalah sebagai berikut : Anoda Pb (-) : Pb + SO4 2- → PbSO4 + 2e– Katoda PbO2 (+) : PbO2 + SO4 2- + 4H+ + 2e– → PbSO4 + 2H2O Reaksi total : Pb + PbO2 + 4H+ + 2SO4 2- → 2PbSO4 + 2H2O Kondisi Saat aki digunakan : Saat aki menghasilkan listrik, Anoda Pb dan katoda PbO2 bereaksi dengan SO4 2- menghasilkan PbSO4. PbSO4 yang dihasilkan dapat menutupi permukaan lempeng anoda dan katoda. Jika telah terlapisi seluruhnya maka lempeng anoda dan katoda tidak berfungsi. Akibatnya aki berhenti menghasilkan listrik. Saat aki menghasilkan listrik dibutuhkan ion H+ dan ion SO4 2- yang aktif bereaksi. akibatnya jumlah ion H+ dan ion SO4 2- pada larutan semakin berkurang dan larutan elektrolit menjadi encer maka arus listrik yang dihasilkan dan potensial aki semakin melemah.
- 2. Oleh karena reaksi elektrokimia pada aki merupakan reaksi kesetimbangan (reversibel) maka dengan memberikan arus listrik dari luar ( mencas ) keadaan 2 elektroda (anoda dan katoda) yang terlapisi dapat kembali seperti semula. demikian pula ion akan terbentuk lagi sehingga konsentrasi larutan elektrolit naik kembali seperti semula. Anoda PbO2 ( - ) : PbSO4 + 2H2O → PbO2 + 4H+ + SO4 2- + 2e– Katoda Pb ( + ) : PbSO4 + 2e– → Pb + SO4 2- Reaksi total : 2PbSO4 + 2H2O → Pb + PbO2 + 4H+ + 2SO4 2- Selama proses penggunaan maupun pengecasan aki terjadi reaksi sampingan yaitu elektrolisis air dan tentu saja ada air yang menguap dengan demikian penting untuk menambahkan air terdistilasi ke dalam baterai timbal. Baru-baru ini jenis baru elektroda yang terbuat dari paduan timbal dan kalsium, yang dapat mencegah elektrolisis air telah dikembangkan. Baterai modern dengan jenis elektroda ini adalah sistem tertutup dan disebut dengan baterai penyimpan tertutup yang tidak memerlukan penambahan air. Sumber : http://mediabelajaronline.blogspot.com/2011/09/sel-volta-dalam-kehidupan-sehari-hari. html
- 3. Nama : Irfa’ Muhammad Aziz Kelas : XII IPA 1 Nomor : 16 Baterai / Sel Kering / Sel Lelanche Sel Leclanché ditemukan oleh insinyur Perancis Georges Leclanché (1839-1882) lebih dari seratus tahun yang lalu. Berbagai usaha peningkatan telah dilakukan sejak itu, tetapi, yang mengejutkan adalah desain awal tetap dipertahankan, yakni sel kering mangan. Sel kering mangan terdiri dari bungkus dalam zink (Zn) sebagai elektroda negatif (anoda), batang karbon/grafit (C) sebagai elektroda positif (katoda) dan pasta MnO2 dan NH4Cl yang berperan sebagai larutan elektrolit. a. Baterai Biasa Anoda : logam seng (Zn) Katoda : batang karbon/gafit (C) Elektrolit : MnO2, NH4Cl dan serbuk karbon (C) Anoda Zn (-) : Zn → Zn2+ + 2e– Katoda C (+) : 2MnO2 + 2NH4+ + 2e- → Mn2O3 + 2NH3 + H2O Reaksi total : Zn + 2MnO2 + 2NH4+ → Zn2+ + Mn2O3 + 2NH3 + H2O b. Baterai Alkaline Dalam sel kering alkalin, padatan KOH atau NaOH digunakan sebagai ganti NH4Cl. Umur sel kering mangan (baterai biasa) diperpendek oleh korosi zink akibat keasaman NH4Cl. Sedangkan pada sel kering alkali bebas masalah ini karena penggantian NH4Cl yang bersifat asam dengan KOH/NaOH yang bersifat basa. Jadi umur sel kering alkali lebih panjang.Selain itu juga menyebabkan energi yang lebih kuat dan tahan lama. Anoda Zn (-) : Zn → Zn2+ + 2e– Katoda C (+) : 2MnO2 + H2O + 2e- → Mn2O3 + 2OH– Reaksi total : Zn + 2MnO2 + H2O → Zn2+ + Mn2O3 + 2OH–
- 4. c. Baterai Nikel-Kadmium Mirip dengan baterai timbal, sel nikel-kadmium juga reversibel. Selain itu dimungkinkan untuk membuat sel nikel-kadmium lebih kecil dan lebih ringan daripada sel timbal. Jadi sel ini digunakan sebagai batu baterai alat-alat portabel seperti : UPS, handphone dll. Anoda Cd (-) : Cd + 2OH– → Cd(OH)2 + 2e– Katoda NiO2 (+) : NiO2 + 2H2O + 2e– → Ni(OH)2 + 2OH– Reaksi total : Cd + NiO2 + 2H2O → Cd(OH)2 + Ni(OH)2 Sumber : http://mediabelajaronline.blogspot.com/2011/09/sel-volta-dalam-kehidupan-sehari-hari. html