Төмөр ба түүний нэгдлүүд
- 2. Гарчиг       Төмөр Төмөр агуулсан эрдэс Төмрийн сульфат Төмрийн сульфатын үйлдвэрлэл Төмрийн сульфатын хэрэглээ Төмрийн сульфатыг гарган авах
- 4. Атомын бүтэц С. О. : +2, +3
- 5. Төмөр агуулсан эрдэсүүд Төмөр байгальд маш их тархсан элемент.Газрын цардасын массын 4,65%-ыг төмөр бүрдүүлдэг.Төмрийн хүдрийн 300-аад эрдэс байдаг боловч 16%-с багагүй Fe агуулсан хүдэр нь үйлдвэрлэлийн шинжтэй
- 6. Төмөр агуулсан эрдэсүүд Минерал Химийн томъёо Fe-ийн агуулга % Магнетийн (соронзон Fe3O4 72,4 төмөрлөг) Гематит (төмрийн ,улаан Fe2O3 70 төмөрлөг) Гетит FeO(On) эсвэл Fe2O3*H2O 62 Гидрогетит Fe2O3 * H2O 62 Сидертит FeCO3 48,2 Ильменит FeTiO3 36,8
- 7. –¢”©–º—Ä–∏–π–Ω —Å—É–ª—å—Ñ–∞—Ç –¢”©–º—Ä–∏–π–Ω —Å—É–ª—å—Ñ–∞—Ç FeSO4 –Ω—å -1,82 –æ–æ—Å 900 —Ö–æ–æ—Ä–æ–Ω–¥ —É—Å–∞–Ω —É—É—Å–º–∞–ª–∞–∞—Å —Ç–∞–ª—Å–∂–∏–Ω–∞. –¢”©–º—Ä–∏–π–Ω –¥—É—Ç—É—É –∏—Å–ª–∏–π–Ω —Å—É–ª—å—Ñ–∞—Ç—ã–≥ —Ç–µ—Ö–Ω–∏–∫—Ç —Ç”©–º—Ä–∏–π–Ω –±–∞–π–≤–∞–Ω –≥—ç–∂ –Ω—ç—Ä–ª—ç–¥—ç–≥ –±”©–≥”©”©–¥ -1,82 ‚Äì –æ–æ—Å 56,8 ‚Äì–Ω —Ö—è–∑–≥–∞–∞—Ä—Ç –≥“Ø–Ω –Ω–æ–≥–æ–æ–Ω ”©–Ω–≥–∏–π–Ω 1,899–≥/—Å–º3 –Ω—è–≥—Ç –±“Ø—Ö–∏–π –º–æ–Ω–æ–∫–ª–∏–Ω —Ç–∞–ª—Å—Ç—ã–≥ “ؓؗŖ≥—ç–Ω —Ç–∞–ª—Å–∂–¥–∞–≥. –ê–≥–∞–∞—Ä—Ç ”©–≥”©—Ä—à–¥”©–≥ –±–∞ –≥–∞–¥–∞—Ä–≥—É—É–¥ –Ω—å FeSO4 “ؓؗŗŗç–Ω—ç—ç—Å ”©–Ω–≥”© –Ω—å —à–∞—Ä –±–æ–ª–¥–æ–≥. –¢”©–º—Ä–∏–π–Ω –±–∞–π–≤–∞–Ω–≥ —Ö”©–¥”©”© –∞–∂ –∞—Ö—É–π–¥ —Ü—ç—Ü—ç—Ä–ª—ç–≥–∏–π–Ω —Ö–æ—Ä—Ç–æ–Ω—Ç–æ–π –±–æ–ª–æ–Ω —è–ª–∑—Ä–∞–ª—Ç–∞–π —Ç—ç–º—Ü—ç—Ö—ç–¥ —Ö–æ—Ä –±–æ–ª–≥–æ–Ω –∞—à–∏–≥–ª–∞–¥–∞–≥ . –ì—ç—Ö–¥—ç—ç “Ø–π–ª—á–ª—ç—Ö —á–∞–¥–≤–∞—Ä–∞–∞—Ä–∞–∞ —Ç”©–º—Ä–∏–π–Ω –±–∞–π–≤–∞–Ω –Ω—å –∑—ç—Å–∏–π–Ω –±–∞–π–≤–∞–Ω–≥–∞–∞—Å 10 –¥–∞—Ö–∏–Ω —Å—É–ª “Ø–π–ª—á–∏–ª–≥—ç—ç—Ç—ç–π. –¢”©–º—Ä–∏–π–Ω —Å—É–ª—å—Ñ–∞—Ç ”©–Ω–≥”© FeSo4 —Ç”©–º”©—Ä –Ω–æ–≥–æ–æ–Ω 1,82-90% Heavy metals¬Ý 20 ppm max¬Ý Water Insoluble¬Ý 0.05% max
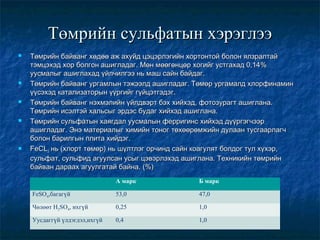
- 8. Төмрийн сульфатын хэрэглээ      Төмрийн байванг хөдөө аж ахуйд цэцэрлэгийн хортонтой болон ялзралтай тэмцэхэд хор болгон ашигладаг. Мөн мөөгөнцөр хогийг устгахад 0,14% уусмалыг ашиглахад үйлчилгээ нь маш сайн байдаг. Төмрийн байванг ургамлын тэжээлд ашигладаг. Төмөр ургамалд хлорфинамин үүсэхэд катализаторын үүргийг гүйцэтгэдэг. Төмрийн байванг нэхмэлийн үйлдвэрт бэх хийхэд, фотозурагт ашиглана. Төмрийн исэлтэй хальсыг эрдэс будаг хийхэд ашиглана. Төмрийн сульфатын хаягдал уусмалын ферригинс хийхэд дүүргэгчээр ашигладаг. Энэ материалыг химийн тоног төхөөрөмжийн дулаан тусгаарлагч болон барилгын плита хийдэг. FeCL3 нь (хлорт төмөр) нь шүлтлэг орчинд сайн коагулят болдог тул хүхэр, сульфат, сульфид агуулсан усыг цэвэрлэхэд ашиглана. Техникийн төмрийн байван дараах агуулгатай байна. (%) А марк Б марк FeSO4,багагүй 53,0 47,0 Чөлөөт H2SO4, ихгүй 0,25 1,0 Уусдаггүй үлдэгдэл,ихгүй 0,4 1,0
- 9. Төмрийн байванг колчеданы шаарнаас гарган авах Агаар хүрэлцэхгүй орчинд колчеданыг шатаасны дараах тодорхой хэмжээний сульфидыг агуулсан соронзон шинжтэй хөрөгдсөн колчедоны шаарыг энэ зорилгоор ашигладаг. Түүний найрлага нь 45% Fe2O3, 25% FeO, 10-15% FeS байна. Түүнийг хүхрийн хүчлээр боловсруулахад төмрийн дутуу ба гүйцэд ислийн сульфатууд үүсдэг. FeO + H2SO4 = FeSO4 + H2O Fe2O3+3 H2SO4 = Fe2(SO4)3 + 3 H2O Үүнтэй зэрэгцэн сульфидын задралаар үүссэн хүхэрт устөрөгч нь Fe2(SO4)3-ыг ангижруулна. Fe2(SO4)3 + H2S = 2 Fe(SO4) + H2SO4+S Fe2(SO4)3 төмрийн гүйцэд ислийн сульфатыг ангижруулахад сульфид хүрэлцэхгүй тохиолдолд металл мөрийг ашигладаг. Fe2(SO4)3 + Fe = 3 Fe(SO4) Шаарыг хүхрийн хүчлээр задлахдаа хутгуур бүхий тогоонд 5-10 минут явуулдаг. Хутгалтыг зогсоогоод массыг реакторт ахин 30 минут байлгана. Энэ үед тэрээр хатуу сүвэрхэг бүтээгдэхүүнийг үүсгэдэг. Түүнийг усанд уусгаад уусмалыг тунгаасны дараа FeSO4 7H2O байвангийн талсжуулагчид өгнө. 1 тн төмрийн байван гарган авахад: 0,3-0,35т колчедений шаар, 0,45-0,5 т хүхрийн хүчил 0,13-0,14т металл төмөр, 1,5 т уур зарцуулдаг. Төмрийн байванг мөн колчеданын шааргыг хүхэрлэг хийн усаар үйлчилж сульфатжуулж гарган авч болно. 2Fe2O3 + 6H2SO3 + 3O2 = 2 Fe2 (SO4)3+ 6H2O
- 10. Анхаарал тавьсан та бүхэнд баярлалаа