Stoikiometri
- 1. Stoikiometri ‚óèBy : Narita Putri Pertiwi ‚óèKelas : XII - IPA
- 2. Tentang Stoikiometri Stoikiometri adalah bagian ilmu kimia yang membahas tentang perbandingan massa unsur-unsur dalam senyawa seperti unsur dalam rumus kimia dan reaksi kimia.
- 3. Penetuan rumus Empiris/Molekul Yang Pertama rumus Empiris. Rumus Empiris menunjukkan perbandingan jumlah atom-atom yang terdapat dalam suatu senyawa. Perbandingan tersebut dinyatakan dalam bilangan bulat kecil, dianalisis terhadap senyawa dan dinyatakan mol atom penyusunnya.
- 4. ‚óè Contoh : ‚óè Dari hasil analisis suatu senyawa, diketahui mengandung 26,57% kalium; 35,36% kromium; 38,07% oksigen. Jika Ar K = 39; Cr = 52; dan O = 16, temukan empiris senyawa tersebut.
- 5. ‚óè Diketahui : Massa K = 26,57 g; Cr = 35,6 g; dan O 38,07 g. ‚óè Jawab : Maka perbandingan mol atom, ‚óè K : Cr : O = 26,57/39 : 35,36/52 : 38,07/16 ‚óè = 0,6800 : 0,6800 : 2,379 ‚óè Setelah itu apa yang harus dilakukan? Kita membagi dengan Hasil terkecil dalam perbandingan tersebut.
- 6. ‚óè K : Cr : O = 0,6800/0,6800 : 0,6800/0,6800 : 2,379/0,6800 ‚óè = 1 : 1 : 3,5 ‚óè = 2 : 2 : 7 ‚óè Jadi rumus senyawa empiris tersebut adalah, ‚óè K2Cr2O7
- 7. Presentase Unsur Dlam senyawa ‚óè Yang kedua, kita menentukan presentase unsur dalam senyawa. Rumus kimia menunjukkan jumlah atom penyusun suatu zat. Karena massa atom suatu unsur tertentu, maka dari rumus kimia tersebut dapat ditentukan presentase atau komposisi masing-masing unsur dalam suatu zat.
- 8. ‚óè Contoh : Tentukan komposisi masing-masing unsur dalam senyawa Al2O3 ( Ar Al = 27; O = 16) ‚óè Jawab : ‚óè Misal Al2O3 sejumlah 1 mol, berarti massanya = 102 gr (Mr Al2O3 = 102). ‚óè setiap 1 mol Al2O3 mengandung 2 mol Al =2 x 27 gr = 54 ‚óè Maka presentase Al dalam Al2O3 = ‚óè (54 gr/102 gr) x 100% = 53,94%
- 9. ● Setiap 1 mol Al2O3 mengandung 3 mol atom O = 3 x16 = 48 gr ● Presentase massa O dalam Al2O3 = ● (48 gr/102 gr) x 100% = 46, 06% ● Atau cara lebih praktisnya adalah, ● (100 – presentase atom pertama)% ● ===> (100 – 53,94)% = 46,06%
- 10. ‚óè Dari beberapa cara tadi, terlihat bawah rumusnya adalah : ‚óè % A dalam senyawa AmBn = ‚óè (m x Ar A/Mr AmBn) x 100% ‚óè % B dalam senyawa AmBn = ‚óè (m x Ar B/Mr AmBn) x 100%
- 11. ‚óè Dengan cara yang sama dapat juga dilakukan untuk mencari massa unsur senyawa dalam sejumlah massa zat. ‚óè Rumus : ‚óè Massa A dalam P gra, AmBn = ‚óè (m x Ar A/Mr AmBn) x P gram
- 12. ‚óè Terkadang komposisi suatu unsur dalam suatu zat dinyatakan dengan senyawa sederhana dari unsur tersebut. Misalnya, kandungan unsur Kalium dalam pupuk dinyatakan sebagai 14% K2O. Artinya jika semua Kalium dalam pupuk dikonversi menjadi K2O, Maka 100 KG PUPUK Terdapat K2O 14 kg. ‚óè Jika dalam senyawa diketahui massa masing-masing unsur dan massa rumusnya, maka rumus molekul senyawa tersebut dapat ditentukan.
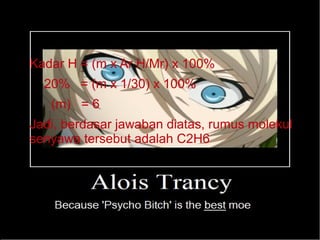
- 13. ‚óè Contoh: ‚óè Suatu senyawa mengandung 80% unsur Karbon dan 20% unsur Hidrogen massa rumusnya senyawa tersebut. Tentukan rumus molekulnya. ‚óè Jawab: ‚óè Kadar C = (n x Ar C/Mr) x 100% ‚óè 80% = (n x 12/30) x 100% ‚óè (n) = (80% x 30/100 x 12) = 2
- 14. ‚óè Kadar H = (m x Ar H/Mr) x 100% ‚óè 20% = (m x 1/30) x 100% ‚óè (m) = 6 ‚óè Jadi, berdasar jawaban diatas, rumus molekul senyawa tersebut adalah C2H6
- 15. THANK YOU