Tema 4
- 1. Os ├Ītomos e a s├║a complexidade 4 F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Xos├® Manuel Besteiro Colexio Apost├│lico Mercedario VER├ŹN
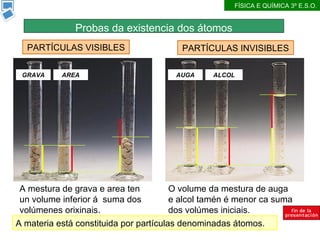
- 2. A mestura de grava e area ten un volume inferior ├Ī suma dos vol├║menes orixinais. O volume da mestura de auga e alcol tam├®n ├® menor ca suma dos vol├║mes iniciais. PART├ŹCULAS VISIBLES PART├ŹCULAS INVISIBLES A materia est├Ī constituida por part├Łculas denominadas ├Ītomos. GRAVA AREA AUGA ALCOL Probas da existencia dos ├Ītomos F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 3. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Na sublimaci├│n as part├Łculas de gas est├®ndense por todo o espazo Nas disoluci├│ns as part├Łculas de soluto est├®ndense por toda a disoluci├│n A disoluci├│n de permanganato esp├Īndese por todo o recipiente Probas da existencia dos ├Ītomos A materia est├Ī constituida por part├Łculas moi pequenas denominadas ├Ītomos que s├│ poden visualizarse con microscopios de efecto t├║nel
- 4. VISUALIZACI├ōN DE ├üTOMOS POR EFECTO T├ÜNEL F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 5. ELEMENTOS QU├ŹMICOS E ├üTOMOS F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. SUBSTANCIA . Tipos de materia que se diferencian polas s├║as propiedades espec├Łficas (densidade,dureza, brillo, conductividade, etc) ├üTOMO: Parte m├Īis pequena de cada elemento que pode intervir nunha combinaci├│n qu├Łmica (Dalton) A uni├│n de ├Ītomos iguais orixina elementos A uni├│n de ├Ītomos diferentes orixina compostos MATERIA: ├® todo aquelo que ten masa e volume CLIC PARA CONTINUAR
- 6. ELEMENTOS QU├ŹMICOS E ├üTOMOS ELEMENTOS: Substancias puras que non se descompo├▒en noutras por procedementos f├Łsicos nen qu├Łmicos. Est├Īn formados por ├Ītomos iguais.Ex: Au, O 2 , N 2 , Fe, C,ŌĆ” Elementos e ├Ītomos nom├®anse co mesmo nome F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. COMPOSTO: Substancia pura que pode descompo├▒erse noutras por procedementos f├Łsicos ou qu├Łmicos.(Electr├│lise, descomposici├│n t├®rmica,ŌĆ”) Est├Īn formados por ├Ītomos diferentes. Ex: H 2 O, H 2 SO 4 , NH 3, NaCl Repres├®ntanse por unha f├│rmula CLIC PARA CONTINUAR
- 7. DESCOMPOSICI├ōN T├ēRMICA DESCOMPOSICI├ōN POR ELECTR├ōLISE Descomposici├│n mediante calor. Unha substancia descomponse pola acci├│n dunha corrente el├®ctrica continua. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. SEPARACI├ōN DOS COMPO├æENTES DUN COMPOSTO H 2 O H 2 + O 2 CuCO 3 CuO + C O 2
- 8. MODELOS AT├ōMICOS F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Dende a antig├╝idade o home tivo curiosidade pola composici├│n da materia. Os sucesivos avances levaron a aparici├│n de novos modelos que permiten explicar as novas experiencias CLIC PARA CONTINUAR Dem├│crito (S.Va.c.) introduce o termo de ├Ītomo como a parte m├Īis pequena da materia. ├üTOMO sen divisi├│n Dividindo a materia en cachos cada vez m├Īis pequenos chegar├Ła un momento no que non poder├Łamos dividila m├Īis. A esa porci├│n m├Łnima e indivisible chamouna ├Ītomo(indivisible) A influenza de Arist├│teles fixo que as ideas de Dem├│crito non fosen admitidas. Dem├│crito
- 9. MODELOS AT├ōMICOS F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Arist├│teles , outro gran pensador grego, fixo que se impuxese a teor├Ła dos cuatro elementos. Seg├║ndo Arist├│teles, a materia estaba formada por cantidades variabeis de catro elementos:Terra , Auga, Aire ,e, lume . O predominio dun ou outro destes elementos fac├Ła que a materia fora: H├║mida Fr├Ła Seca Quente ESQUEMA INTERNET CLIC PARA CONTINUAR ANIMACIONES INICIO
- 10. No mundo cristi├Īn, a teor├Ła de Arist├│teles foi adoptada polos alquimistas, precursores dos cient├Łficos, que desenrolaron a s├║a actividade durante toda a idade Media . F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Arist├│teles
- 11. F├ŹSICA E QU├ŹMCA 3┬║ E.S.O. MODELO DE DALTON(1808) Tiveron que pasar vinte s├®culos para que un qu├Łmico ingl├®s chamado John Dalton retomara as ideas de Dem├│crito e publicase, en 1808, a s├║a famosa teor├Ła at├│mica:
- 12. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. IDEAS FUNDAMENTAIS DA TEOR├ŹA DE DALTON: Os ├Ītomos son indivisibles e non se modifican nas reacci├│ns . . qu├Łmicas. A materia est├Ī constituida por ├Ītomos. T├│dolos ├Ītomos dun mesmo elemento qu├Łmico son iguais. Os ├Ītomos de elementos qu├Łmicos diferentes son diferentes. Os compostos est├Īn formados pola uni├│n de ├Ītomos de . diferentes elementos.
- 13. O modelo at├│mico de Dalton sup├│n que a materia est├Ī formada por ├Ītomos que son part├Łculas neutras e indivisibeis. Representaci├│n dos elementos e compostos na teor├Ła de Dalton . F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. IDEAS FUNDAMENTAIS DA TEOR├ŹA DE DALTON:
- 14. CRITICAS ├ü TEORIA DE DALTON ├ütomos indivis├Łbeis ? ( prot├│ns,neutr├│ns,electr├│nsŌĆ”) ├ütomos dun mesmo elemento id├®nticos en masa e propiedades (Is├│topos) Non explica os fen├│menos el├®ctricos Os decubrimentos de finais do s├®culo XIX e comezo do XX deixaron en evidencia a teor├Ła da indivisibilidade at├│mica. APORTACI├ōNS DE DALTON Explica a lei de conservaci├│n da masa das reacci├│ns qu├Łmicas Interpreta a lei das proporci├│ns definidas: dous elementos que se unen para formaren un composto fano sempre na mesma proporci├│n F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. + + + +
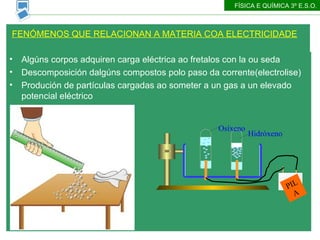
- 15. Alg├║ns corpos adquiren carga el├®ctrica ao fretalos con la ou seda Descomposici├│n dalg├║ns compostos polo paso da corrente(electrolise) Produci├│n de part├Łculas cargadas ao someter a un gas a un elevado potencial el├®ctrico FEN├ōMENOS QUE RELACIONAN A MATERIA COA ELECTRICIDADE F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Os├Łxeno Hidr├│xeno PILA
- 16. MODELO AT├ōMICO DE THOMSON F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. En 1897, O brit├Īnico Joseph John Thomson descubriu unhas part├Łculas con propiedades sorprendentes: pr├Īcticamente non ti├▒an masa e ti├▒an carga el├®ctrica negativa. Chamounos electr├│ns. Baseouse na s├║a experiencia co tubo de descarga. No interior existe un gas sometido a unha diferencia de potencial. Desde o polo negativo (c├Ītodo) em├Łtese unha radiaci├│n cara o polo positivo (├Īnodo). A radiaci├│n ├® emitida polo gas. Joseph John Thomson (1856 ŌĆō 1940)
- 17. Raios cat├│dicos F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Tubo de descarga gas c├Ītodo ├Īnodo Radiaci├│n=electr├│ns 10.000 voltios Substancia fluorescente
- 18. O ├Ītomo pos├║e part├Łculas negativas chamadas electr├│ns. Intu├Ła ,dada a neutralidade da materia, a existencia dunha carga positiva no ├Ītomo. Anuncia que o ├Ītomo ├® ŌĆ£UNHA ESFERA MACIZA CARGADA POSITIVAMENTE E NO SU INTERIOR EST├üN INCRUSTADOS OS ELECTR├ōNSŌĆØ Simil: sand├Ła (Pepitas=electr├│ns. Froito:├Ītomo cargado positivamente) F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. MODELO DE THOMSON
- 19. En 1886, o f├Łsico alem├Īn Eugen Goldstein, empregando un tubo cat├│dico cun c├Ītodo perforado, descubriu unha nova radiaci├│n, que flu├Ła polos buracos do c├Ītodo en direcci├│n oposta ├Ī dos raios cat├│dicos. Chamouselle "raios canais". Posto que os raios canais se moven na direcci├│n oposta aos raios cat├│dicos de carga negativa , ├®sta era de natureza positiva. APORTACI├ōNS DE THOMSON Explica os fen├│menos el├®ctricos Acaba coa idea da indivisivilidade do ├Ītomo FALLOS DE THOMSON Non explica a desviaci├│n das part├Łculas alfa cando se bombardean l├Īminas de ouro DESCUBRIMIENTO DO PROT├ōN F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
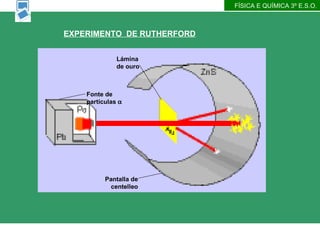
- 20. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. EXPERIMENTO DE RUTHERFORD
- 21. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. EXPERIMENTO DE RUTHERFORD Fonte de part├Łculas ’üĪ L├Īmina de ouro Pantalla de centelleo
- 22. OBSERVACI├ōNS DE RUTHERFORD Rutherford bombardeou unha fina l├Īmina de oro con part├Łculas alfa (n├║cleos de Helio, procedentes da desintegraci├│n do Polonio) Observou que a maior├Ła das part├Łculas que atravesaban a l├Īmina segu├Łan unha l├Ł├▒a recta ou se desviaban un ├Īngulo moi pequeno da direcci├│n inicial. Soamente, moi poucas part├Łculas se desviaban grandes ├Īngulos, o que contradec├Ła ao modelo at├│mico proposto por Thomson. Rutherford supuxo que ditas desviaci├│ns provi├▒an dunha ├║nica interacci├│n entre a part├Łcula proxectil e o ├Ītomo CONCLUSI├ōNS DE RUTHERFORD Rutherford concluiu que o feito de que a maior├Ła das part├Łculas atravesaran a folla met├Īlica, indica que gran parte do ├Ītomo est├Ī baleiro O rebote das part├Łculas indica un encontro directo cunha zona fortemente positiva do ├Ītomo e ├Ī vez moi densa de masa . F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 23. O ├Ītomo est├Ī constituido por unha parte central ├Ī que se le chama n├║cleo e na que se encontra concentrada case toda a masa do n├║cleo e toda a carga positiva. Na parte externa do ├Ītomo( Codia ) enc├│ntrase toda a carga negativa e a s├║a masa ├® moi pequena en comparaci├│n co resto do ├Ītomo, esta est├Ī formada polos electr├│ns que conte├▒a o ├Ītomo. Os electr├│ns xiran a gran velocidade arredor do n├║cleo, en orbitas circulares. O tama├▒o do n├║cleo ├® moi pequeno en comparaci├│n co do ├Ītomo, aproximadamente 10.000 veces menor. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. POSTULADOS DE RUTHERFORD . Electr├│n N├║cleo
- 24. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. MODELO AT├ōMICO SEGUNDO RUTHERFORD OBXECCI├ōNS A RUTHERFORD O modelo ser├Ła inestable xa que os prot├│ns repeler├Łanse .Tivo que descubrir os neutr├│ns como as part├Łculas que impedir├Łan esas repulsi├│ns. Os electr├│ns perder├Łan enerx├Ła ao xirar arredor do n├║cleo baixo unha aceleraci├│n centr├Łpeta e acabar├Łan caindo sobre o n├║cleo CODIA N├ÜCLEO electr├│ns. prot├│ns. neutr├│ns. ├üTOMO
- 25. N┬║ AT├ōMICO(Z) ├ē o n├║mero de prot├│ns que ten o ├Ītomo, coincide co lugar que ocupa na taboa peri├│dica e tam├®n co n┬║ de electr├│ns en ├Ītomos neutros. N┬║ M├üSICO(A) ├ē a suma do n┬║ de prot├│ns e do n┬║ de neutr├│ns que ten un ├Ītomo F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. CUALIDADES QUE PERMITEN DIFERENCIAR DOUS ├üTOMOS A = Z + n┬║ neutr├│ns EL N├ÜMERO M├üSICO (A) EL N├ÜMERO AT├ōMICO (Z) T├│dolos ├Ītomos do mesmo elemento qu├Łmico te├▒en o mesmo n┬║ at├│mico X A Z
- 26. IS├ōTOPOS : Son ├Ītomos do mesmo elemento (te├▒en igual n┬║ at├│mico Z) , pero te├▒en distinto n┬║ m├Īsico A por teren diferente n┬║ de neutr├│ns. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O CUALIDADES QUE PERMITEN DIFERENCIAR DOUS ├üTOMOS A = Z + n┬║ neutr├│ns Protio Deuterio Tritio IS├ōTOPOS DO HIDR├ōXENO
- 27. MASAS AT├ōMICAS E MOLECULARES A masa at├│mica dun elemento ├® a media dos n├║meros m├Īsicos de t├│dolos is├│topos que o forman. Ex: Se un elemento ten tres is├│topos F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. % 3 A 3 % 2 A 2 % 1 A 1 Abundancia (%) N├║meros m├Īsicos(A)
- 28. IS├ōTOPOS. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Calcula a masa at├│mica do Ne├│n co├▒ecidas as masas e a abundancia dos seus is├│topos :
- 29. I├ōNS. Son ├Ītomos que perderon ou ga├▒aron electr├│ns para estabilizarse ANI├ōN : I├│n negativo formado cando un ├Ītomo gana electr├│ns, adquirindo un exceso de carga negativa. Repres├®ntase como : X - Ex: Cl - CATI├ōN: i├│n positivo formado cando un ├Ītomo perde electr├│ns , queda con defecto de carga negativa ou m├Īis carga positiva que negativa. Repres├®ntase como : X +TI├ōN Ex: Na + F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 30. I├ōNS. Fe 26 56 26 prot├│ns 26 electr├│ns 30 neutr├│ns ├Ītomo de ferro Fe +2 26 56 26 prot├│ns 24 electr├│ns 30 neutr├│ns cati├│n ferro +2 F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
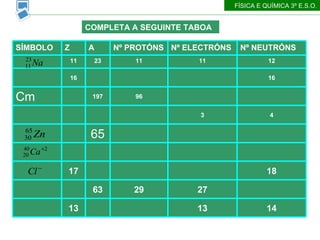
- 31. COMPLETA A SEGUINTE TABOA F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. 14 13 13 27 29 63 18 17 65 4 3 96 197 Cm 16 16 12 11 11 23 11 N┬║ NEUTR├ōNS N┬║ ELECTR├ōNS N┬║ PROT├ōNS A Z S├ŹMBOLO
- 32. COMPLETA A SEGUINTE TABOA F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. 14 13 13 27 13 Al 34 32 29 63 29 Cu 18 18 17 35 17 20 18 20 40 20 35 30 30 65 30 4 3 3 7 3 Li 101 96 96 197 96 Cm 16 16 16 32 16 S 12 11 11 23 11 N┬║ NEUTR├ōNS N┬║ ELECTR├ōNS N┬║ PROT├ōNS A Z S├ŹMBOLO
- 33. RESUMINDO: u.m.a. = unidade de masa at├│mica (masa dun ├Ītomo de hidr├│xeno) N├║cleo N├║cleo Codia 1 u.m.a. 1 u.m.a. 1/1840 u.m.a. Positiva Non ten Negativa F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Electr├│n Neutr├│n Prot├│n CARGA MASA LOCALIZACI├ōN PART├ŹCULA
- 34. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. O Modelo de BOHR trata de explicalos espectros. Cando a luz branca incide sobre un prisma , descomponse en cores formando un espectro. Cando a luz procede dun elemento o espectro est├Ī formado s├│ por algunhas raias. Espectros de emisi├│n MODELO AT├ōMICO DE BOHR (1913) Litio Potasio
- 35. F├ŹSICA E QU├ŹMICA 4┬║ E.S.O. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Espectro de emisi├│n www.puc.cl / sw_educ /qda1106/ CAP2/2B/2B1/ Espectro de absorci├│n ┬® Ed. ECIR Qu├Łmica 2┬║ Bachillerato
- 36. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. ESPECTRO DE EMISI├ōN DE DIFERENTES ├üTOMOS
- 37. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. MODELO AT├ōMICO DE BOHR (1913) Os electr├│ns s├│ se poden mover en determinadas ├│rbitas chamadas ŌĆ£├ōRBITAS ESTACIONARIAS ŌĆ£nas cales non se absorbe nin emite enerx├Ła. Nas ├│rbitas estacionarias c├║mprese: n = n┬║ cu├Īntico principal s├│ pode tomar os valores 0 , 1 , 2 , 3 , 4 , 5 , 6ŌĆ” A enerx├Ła destas ├│rbitas aumenta a medida que se apartan do n├║cleo. O salto dun electr├│n dunha ├│rbita de maior enerx├Ła a outra de menor enerx├Ła d├Ī lugar ├Ī emisi├│n dunha radiaci├│n electromagn├®tica en forma de luz. Esta enerx├Ła emitida non pode ser calquera (Est├Ī cuantizada) e vai cumprir que: h = constante de Planck = 6,63┬Ę 10 -34 J┬Ęs v = frecuencia da radiaci├│n
- 38. FALLOS DO MODELO DE BOHR: Sup├│n que as ├│rbitas son circulares Despreza a masa do electr├│n ( a masa do prot├│n ├® unhas 1840 veces a masa do electr├│n) Sup├│n que o n├║cleo est├Ī fixo Explica o espectro do hidr├│xeno ,pero non o de ├Ītomos con m├Īis dun electr├│n F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 39. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. . Absorci├│n Emisi├│n
- 40. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. MODELO DE BOHR-SOMMERFELD(1916) ANTECEDENTES: Os modernos m├®todos de observaci├│n permit├Łan comprobar o desdobramento das li├▒as espectrais de Bohr A presenza dun campo magn├®tico ou el├®ctrico provocaba o desdobramento das li├▒as espectrais (EFECTO ZEEMAN 1896) SOMMERFELD modificou os potulados de Bohr para poder interpretar os novos feitos As ├│rbitas descritas polos electr├│ns dentro de cada nivel enerx├®tico poden ser circulares ou el├Łpticas A excentricidade de cada ├│rbita v├®n dada polo n┬║ cu├Īntico secundario ŌĆ£ lŌĆØ que sinala os os pos├Łbeis subniveis de enerx├Ła de cada nivel ŌĆØ nŌĆØ Valores que pode tomar ŌĆ£lŌĆØ : 0, 1, 2, 3, 4ŌĆ”n-1.
- 41. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. A orientaci├│n e a inclinaci├│n das ├│rbitas no espazo non pode ser calquera. Un novo n┬║ cu├Īntico ŌĆ£mŌĆØ chamado n┬║ cu├Īntico magn├®tico controla a orientaci├│n no espazo ŌĆ£ mŌĆØ pode tomar os valores que van desde ŌĆō l ŌĆ”, 0,ŌĆ”+ l, indo de un en un . Sommerfeld explicaba a complexidade das raias espectrais N┬║ CU├üNTICO DE SPIN (s) En 1925 Uhlembeck e Goldsmit explicaron o efecto Zeeman postulando que o electr├│n , adem├Īis de xirar arredor do n├║cleo, xiraba sobre si mesmo comport├Īndose coma un peque├▒o im├Īn s = +1/2 cando rotaci├│n e traslaci├│n te├▒en o mesmo sentido s = -1/2 cando rotaci├│n e traslaci├│n te├▒en sentidos contrarios .
- 42. En 1924 o f├Łsico franc├®s Louis de Broglie considerando a teor├Ła ondulatoria e corpuscular da luz , propuxo que a materia, en certas condici├│ns, poder├Ła mostrar propiedades de onda . De Broglie suxeriu que o electr├│n, na s├║a traxectoria arredor do n├║cleo, ten asociada unha lonxitude de onda particular. ANTECEDENTES DA TEOR├ŹA CU├üNTICA DE SCHR├¢DINGER Hip├│tese de De Broglie Principio de incerteza de Heisenberg 1.- HIP├ōTESE DE DE BROGLIE: F├ŹSICA E QU├ŹMICA 3┬║ E.S.O h =6,63┬Ę10 -34 J┬Ęs = constante de Planck mv para cualquera obxecto ch├Īmase momento
- 43. En 1926 Werner Heisenberg (1901-1976) sostuvo que: ŌĆ£ ├ē imposible co├▒ecer simultaneamente a posici├│n e o momento linear dunha part├Łcula. Canto m├Īis exacta sexa a determinaci├│n dunha delas , m├Īis inexacta ser├Ī a da outraŌĆØ. ANTECEDENTES DA TEOR├ŹA CU├üNTICA DE SCHR├¢DINGER 2.- PRINCIPIO DE INCERTEZA DE HEISENBERG: TEOR├ŹA CU├üNTICA DE SCHR├¢DINGER F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. En 1926, Erwin Schr├Čdinger describiu o comportamento do electr├│n dun ├Ītomo dacordo a consideraci├│ns estat├Łsticas. Schr├Čdinger considerou que a traxectoria definida do electr├│n segundo Bohr (├ōRBITA) debe sustituirse pola probabilidade de encontralo nunha zona do espazo at├│mico (ORBITAL)
- 44. Baixo este plantexamento, os estados de enerx├Ła permitidos para o electr├│n no ├Ītomo (chamados orbitais e onde cada un deles ten unha enerx├Ła caracter├Łstica e unha forma particular) quedan descritos por medio de catro n├║meros cu├Īnticos: O principal( n ) n= 1, 2 , 3 , 4 , 5, 6, K, L, M, N ,O O secundario ( l ),l= 0,1, 2 , 3, 4ŌĆ”n-1 s, p , d, f, f, f,ŌĆ” O magn├®tico ( m ) m= -lŌĆ”0ŌĆ”+l O esp├Łn ( s ). S = +/- 1/2 TEOR├ŹA CU├üNTICA DE SCHR├¢DINGER ORBITAL: ŌĆ£ ZONA DO ESPAZO NA QUE EXISTE A M├üXIMA PROBABILIDADE DE ENCONTRAR AO ELECTR├ōNŌĆØ F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 45. N├ÜMEROS CU├üNTICOS. N├║mero cu├Īntico principal ( n ) relaci├│nase directamente coa magnitude e a enerx├Ła dun orbital at├│mico. Este n├║mero pode ter calquera valor enteiro e positivo n : 1,2,3,4,.... Cando n aumenta, tam├®n aumenta a enerx├Ła e a distancia do electr├│n ao n├║cleo. N├║mero cu├Īntico secundario o azimutal ( l ) : Para medir a excentricidade da ├│rbita definiuse un segundo n├║mero cu├Īntico denominado secundario ou azimutal Os valores que toma o n├║mero cu├Īntico secundario dependen do valor de n , segundo l = 0,1,2...( n -1). Se n = 3 entonces l toma os valores 0,1 y 2 Os valores de l te├▒en os seus equivalentes en letras, l 0 1 2 3 4 Nome s p d f f F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 46. Orbitais s F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 47. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 48. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 49. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 50. N├║mero cu├Īntico magn├®tico m . Est├Ī relacionado coa orientaci├│n espacial do orbital .Os seus valores dependen de l e pode tomar 2 l + 1 valores enteiros, ├® decir + l ,.....,0,.......- l Se l = 0 entonces m = 0 Se l = 1 entonces m = +1, 0, -1 , de maneira que o subnivel p ( l =1) cont├®n tres orbitais que se designan como p x , p y , p z F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 51. O n├║mero cu├Īntico de esp├Łn non deriva da ecuaci├│n de Schr├Čdinger sen├│n que se introduciu para que a teor├Ła estivera dacordo cos datos experimentais F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. N├║mero cu├Īntico de esp├Łn (s). Corresponde ao xiro do electr├│n sobre o seu propio eixe, o cal pode ter dous sentidos, na direcci├│n das agullas do reloxo ou en sentido contrario. - O esp├Łn pode tomar os valores de +1/2 ,e, -1/2
- 52. Os niveis de enerx├Ła para o ├Ītomo de hidr├│xeno dependen exclusivamente do n├║mero cu├Īntico n, de maneira que t├│dolos subniveis te├▒en a mesma enerx├Ła. Para os ├Ītomos polielectr├│nicos, depende dos n├║meros cu├Īntico principal ( n ) e secundario ( l ). Variaci├│ns do nivel de enerx├Ła 1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s< ........ ENERX├ŹA E CAPACIDADE DOS ORBITAIS AT├ōMICOS F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 53. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Incremento de enerx├Ła n=1 n=2 n=3 n=4 1s 2s 2p 3s 3p 3d 4s 4p 5s 4d Nivel principal de enerx├Ła Subnivel
- 54. CONFIGURACI├ōN ELECTR├ōNICA DOS ├üTOMOS Ent├®ndese por configuraci├│n electr├│nica do ├Ītomo ├Ī distribuci├│n dos electr├│ns nos diferentes orbitais at├│micos. Para encontrar tal configuraci├│n d├®bense seguir certas regras Os electr├│ns sit├║anse nos orbitais de menor enerx├Ła. Seg├║n Pauli, cada electr├│n dun ├Ītomo ten os seus propios n├║meros cu├Īnticos . (n , l , m , s) Un orbital ten un m├Īximo de dous electr├│ns con esp├Łn oposto, o que se traduce en que o subnivel s ten como capacidade m├Īxima 2 electr├│ns. O subnivel p con tres orbitais, 6 electr├│ns. O subnivel d con cinco orbitais, 10 electr├│ns e o subnivel f con 7 orbitais, 14 electr├│ns. Cando un subnivel ten m├Īis dun orbital, os electr├│ns van ocupando o subnivel de maneira que cada electr├│n adicional que entra, se ubica en orbitais diferentes co mesmo esp├Łn. Esta condici├│n ch├Īmase regra de Hund ou regra de m├Īxima multiplicidade de esp├Łn. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 55. 7p 1s 2s 2p 3p 3s 3d 4d 5d 6d 6s 6p 5p 4p 5s 4s 7s 5f 4f REGRA DAS DIAGONAIS F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 56. ŌĆ£ Dous electr├│ns nun ├Ītomo non poden ter o mesmo conxunto de n├║meros cu├ĪnticosŌĆØ. Polo menos un dos catro n├║meros cu├Īnticos debe ser diferente. Esta condici├│n limita a capacidade de cada orbital , posto que dos electr├│ns nun orbital poden ter igual n,l ,e, m pero deben ter diferente esp├Łn +1/2 ou -1/2 F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. PRINCIPIO DE EXCLUSI├ōN DE PAULI. Unha forma de sinxela de representar as configuraci├│ns ├® a trav├®s do diagrama de orbitais onde cada cadrado representa un orbital. 1 H 1s 1 2 He 1s 2 3 Li 1s 2 2s 1
- 57. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O.
- 58. Escribe a configuraci├│n electr├│nica para f├│sforo, P: Z= 15 15 P 1s 2 2s 2 2p 6 3s 2 3p 3 ’éŁ’é» ’éŁ’é» ’éŁ’é» ’éŁ’é» ’éŁ’é» ’éŁ’é» ’éŁ ’éŁ ’éŁ F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. EXEMPLOS DE CONFIGURACI├ōNS ELECTR├ōNICAS K L M Escribe a configuraci├│n electr├│nica para o i├│n Na + Configuraci├│n para o ├Ītomo neutro 11 Na : (1s 2 2s 2 2p 6 3s 1 ) Configuraci├│n para o i├│n Na + 11 Na + : (1s 2 2s 2 2p 6 ) perde o ├║ltimo electr├│n.
- 59. Configuraci├│n do i├│n cloruro Cl - Configuraci├│n do ├Ītomo de cloro neutro: Cl Z = 17 (1s 2 2s 2 2p 6 3s 2 3p 5 ) Configuraci├│n electr├│nica do ion cloruro Cl - Cl - (1s 2 2s 2 2p 6 3s 2 3p 6 ) F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. EXEMPLOS DE CONFIGURACI├ōNS ELECTR├ōNICAS K L M Configuraci├│n electr├│nica de iones Zn 2+ y Sn 2+ Configuraci├│n do Zn neutro: Z= 30 (.......3s 2 3p 6 3d 10 4s 2 ) Zn 2+ (.......3s 2 3p 6 3d 10 ) Configuraci├│n do Sn neutro : Z = 50( ...4s 2 4p 6 4d 10 5s 2 5p 2 ) Sn 2+ (...4s 2 4p 6 4d 10 5s 2 )
- 60. Os qu├Łmicos sempre sentiron a necesidade de clasificar aos elementos para facilitar o seu estudo e o dos compostos. Intent├Īronse varias clasificaci├│ns, case todas con defectos. LAVOISIER: finais do s├®culo XVIII clasifica aos elementos en metais e non metais D├¢BEREINER: comezo do s├®culo XIX clasifica aos elementos en TRIADAS NEWLANDS : mediadas do s├®culo XIX ŌĆ£LEI DAS OCTAVASŌĆØ agrupa aos elementos en grupos e per├Łodos. Despois de cada 7 repet├Łanse as propiedades MEYER E MENDELIEV : finais do s├®culo XIX. Ordenan aos elementos en orde crecente do n┬║ m├Īsico En 1914 HENRY MOSELEY prop├│n a clasificaci├│n en orde crecente do n┬║ at├│mico F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. CLASIFICACI├ōN PERI├ōDICA DOS ELEMENTOS: SISTEMA P├łRI├ōDICO
- 61. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. CLASIFICACI├ōN PERI├ōDICA DOS ELEMENTOS: SISTEMA P├łRI├ōDICO WERNER e PANETH contruiron a taboa actual de 18 columnas e en orde crecente do n┬║ at├│mico .
- 62. A TABOA PERI├ōDICA Masa at├│mica (U) S├Łmbolo Nome N├║mero at├│mico Metais Non metais Gases nobres F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. Lant├Īnidos Act├Łnidos Alcalinos Alcalino-terreos Anf├Łxenos Hal├│xenos Gases nobres
- 63. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. CLASIFICACI├ōN PERI├ōDICA DOS ELEMENTOS: SISTEMA P├łRI├ōDICO A taboa peri├│dica est├Ī formada por cadros , en cada un dos cales se coloca o nome dun elemento e o seu s├Łmbolo acompa├▒ado do n┬║ at├│mico e da s├║a masa at├│mica PERIODO: conxunto de elementos que ocupan unha l├Ł├▒a horizontal . Dentro de cada per├Łodo os electr├│ns m├Īis externos est├Īn na mesma capa Identif├Łcanse cos n├║meros 1,2,3....7 ou coas letras K, L, M, N, O, P, Q. Son os niveis de enerx├Ła dos ├Ītomos (n├║mero cu├Īntico principal, n ). Per├Łodo 1 : ten 2 elementos Per├Łodos 2 ,e, 3 : te├▒en 8 elementos cada un Per├Łodos 4,e, 5 : te├▒en 18 elementos cada un Per├Łodos 6 , e , 7 : te├▒en 32 elementos cada un O hidr├│xeno col├│case no 1┬║ per├Łodo pero non encaixa en ning├║n grupo polas s├║as propiedades.
- 64. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. CLASIFICACI├ōN PERI├ōDICA DOS ELEMENTOS: SISTEMA P├łRI├ōDICO GRUPO: ├® cada unha das columnas do S.P. Son 18 en total Os elementos de cada grupo te├▒en o mesmo n┬║ de electr├│ns na ├║ltima capa(Capa de Valencia). Os elementos de cada grupo te├▒en propiedades qu├Łmicas semellantes CAPA DE VALENCIA: ├® a capa na que se colocan os ├║ltimos electr├│ns cando se fai a configuraci├│n electr├│nica. Son, polo tanto, os electr├│ns m├Īis externos ,e, os principais respons├Ībeis do comportamento qu├Łmico e f├Łsico dese elemento.
- 65. 1 . Grupos longos( Elementos Representativos) :Son 8 O electr├│n diferenciador acom├│dase en orbitais s ou p . Son os grupos : 1, 2,13,14,15,16,17,e,18 Reciben nomes espec├Łficos: Alcalinos(1) Alcalinot├®rreos(2) T├®rreos(13) Carbonoides(14) Nitroxenoides(15) Anf├Łxenos(16) Hal├│xenos(17) Gases Nobres(18) 2. Grupos curtos ( Elementos de transici├│n ): Son 10 Elementos de Transici├│n Curta : O ├® diferenciador acom├│dase en orbitais d . Elementos de Transici├│n Larga : O e diferenciador acom├│dase en orbitais f . A taboa per├Ł├│dica div├Łdese en catro bloques que se representan por diferentes cores: metais , non metais , semimetais e gases nobres . Cada bloque ten unhas propiedades caracter├Łsticas. F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. CLASIFICACI├ōN DOS GRUPOS EN FUNCI├ōN DAS S├ÜAS PROPIEDADES
- 66. METAIS, NON METAIS E GASES NOBRES Aluminio Esta├▒o Cobre Ouro Xofre Iodo Bromo Fl├║or F F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. METAIS ŌĆó Representan case o 75 % de t├│dolos elementos. ŌĆó Te├▒en brillo met├Īlico. ŌĆó Conducen ben a calor e a electricidade. ŌĆó Son d├║ctiles e male├Ībeis. ŌĆó Excepto o mercurio, que ├® l├Łquido, son s├│lidos a temperatura ambiente e funden a alta temperatura. ŌĆó Tenden a perder electr├│ns e formar i├│ns positivos. ŌĆó Son malos condutores da calor e da electricidade. ŌĆó A temperatura ambiente poden ser s├│lidos, l├Łquidos ou gases. ŌĆó A maior├Ła dos s├│lidos son brandos. ŌĆó A temperatura de fusi├│n para a maior├Ła dos s├│lidos ├® baixa, igual que a de ebulici├│n para os l├Łquidos. ŌĆó Solen captar electr├│ns formando i├│ns negativos. NON METAIS GASES NOBRES ŌĆó Enc├│ntranse na natureza como ├Ītomos illados. ŌĆó Son gases a temperatura ambiente. ŌĆó Desde o punto de vista qu├Łmico son moi est├Ībeis: non forman compostos. Non ganan nin pierden electr├│ns; ├® decir, non forman i├│ns. ŌĆó As s├║as aplicaci├│ns est├Īn relacionadas coa s├║a estabilidade qu├Łmica.
- 67. OS ELEMENTOS QU├ŹMICOS M├üIS COM├ÜNS: BIOELEMENTOS Ch├Īmanse bioelementos os elementos qu├Łmicos que forman parte dlos seres vivos. Os m├Īis abundantes son: C, H, O, N, Ca, P, Mg, S, Na, K e Cl, constit├║en m├Īis do 99% destes seres. Leite, queixo, pan e verduras. CDR = 800 mg A CDR ├® a cantidade dun nutriente que unha persoa sa debe inxerir por termo medio cada d├Ła, a trav├®s da dieta, para mantener un bon estado de saude. Leite, aves, pescado, carne, legumes e froitos secos. CDR = 800 mg Leite, carne, verduras, legumes noces. CDR = 300 mg Carne, pescado e ovos. CDR = sen establecer Sal com├║n. CDR = 500 mg Leite, chocolate, froita, verduras e cereais. CDR = 2000 mg Sal com├║n. CDR = sen establecer F├ŹSICA E QU├ŹMICA 3┬║ E.S.O. C Carbono 6 12 Na Sodio 11 23 Cl Cloro 17 35,5 S Azufre 16 32 O Ox├Łgeno 8 16 H Hidr├│geno 1 1 N Nitr├│geno 7 14 K Potasio 19 39,1 P F├│sforo 15 31 Mg Carbono 12 24,3 Ca Calcio 40,1 20
- 68. OS ELEMENTOS QU├ŹMICOS M├üIS COM├ÜNS: OLIGOELEMENTOS Son oligoelementos os elementos que est├Īn en menor proporci├│n (aproximadamente o 0,1%) e que son indispens├Ībeis para t├│dolos seres vivos, coma o Fe, o Zn, o Mn, o F, o I , o Cu e ol Co. F├Łgado, legumes, carne e xema de ovo CDR = 14 mg Carne, cereais integrais e legumes. CDR = 15 mg T├®, arroz integral, froitos secos e legumes. CDR = 2-5 mg T├®, pescado e agua fluorada CDR = sen establecer Sal iodado, marisco e algas CDR = 150 mg F├Łgado, noces e legumes. CDR = 1,5-3 mg Carne, pescado, l├Īcteos e lentellas. CDR = sin establecer F├ŹSICA E QU├ŹMICA 4┬║ E.S.O. I Yodo 53 126,9 Co Cobalto 27 58,9 F Fl├║or 9 19 Cu Cobre 29 63,5 Zn Zinc 30 65,4 Mn Manganeso 25 54,9 Fe Hierrp 55,8 26
- 69. F├ŹSICA E QU├ŹMICA 4┬║ E.S.O. FIN