Teori atom dan Radioaktivitas
- 1. TEORI ATOM dan RADIOAKTIVITAS B y : S k o l a s t i k a R e s t i N ./ 32
- 2. T e o r i A t o m R a d i o a k t i v i t a s
- 4. E v o l u s i M o d e l A t o m John Dalton (1766-1844) JJ. Thomson (1856 - 1940) Ernest Rutherford (1871-1937) Niels Bohr (1885 - 1962) KlikFoto
- 5. T e o r i A t o m D a l t o nPada tahun 1503, Dalton menggabungkan hasil ŌĆō hasil eksperimennya dengan pengamatan ŌĆō pengamatan lain tentang zat dan mengusulkan sebuah teori atom. Teori atom yang diusulkan Dalton adalah sebagai berikut : ŌĆó Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi. ŌĆó Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda. ŌĆó Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. ŌĆó Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan
- 6. Hipotesa Dalton digambarka n dengan model atom sebagai bola pejal
- 7. Pada perkembangan selanjutnya ditemukan berbagai fakta yang tidak dapat dijelaskan oleh teori tersebut, antara lain : ŌĆó Tidak dapat menjelaskan sifat listrik materi. ŌĆó Tidak dapat menjelaskan gejala kelistrikan dalam materi. ŌĆó Tidak dapat menjelaskan daya gabung unsur-unsur. Misalnya mengapa satu atom oksigen dapat mengikat dua atom hidrogen membentuk air.
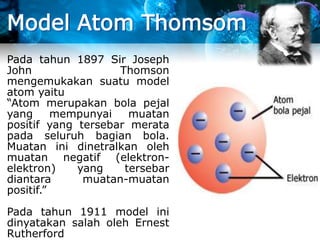
- 8. Model Atom Thomsom Pada tahun 1897 Sir Joseph John Thomson mengemukakan suatu model atom yaitu ŌĆ£Atom merupakan bola pejal yang mempunyai muatan positif yang tersebar merata pada seluruh bagian bola. Muatan ini dinetralkan oleh muatan negatif (elektron- elektron) yang tersebar diantara muatan-muatan positif.ŌĆØ Pada tahun 1911 model ini dinyatakan salah oleh Ernest Rutherford
- 9. Model Atom Rutherford Model atom Rutherford ŌĆóAtom terdiri atas inti yang bermuatan listrik positif yang mengandung hampir seluruh massa atom. ŌĆóElektron bermuatan negatif beredar mengelilingi inti pada lintasan-lintasan tertentu seperti planet-planet yang beredar mengelilingi matahari pada susunan tata surya. ŌĆóAtom secara keseluruhan bermuatan netral, jumlah muatan positif inti atom sama dengan jumlah muatan elektron-elektronnya. ŌĆóInti atom dan elektron tarik-menarik sehingga timbul gaya sentripetal pada elektron yang menyebabkan elektron tetap pada orbitnya(lintasannya) ŌĆóPada reaksi kimia inti atom tidak mengalami perubahan hanya elektron-elektron pada lintasan luarnya yang saling mempengaruhi.
- 10. Model Atom tata surya Rutherford
- 11. S u s u n a n P e r c o b a a n R u t h e r f o r d
- 12. Kelemahan Model atom Rutherford ’ü▒Karena dalam gerak orbitnya elektron memancarkan energi, maka energi elektron berkurang sehingga jari-jari lintasannya mengecil. Lintasannya tidak lagi berupa lingkaran dengan jari-jari tetap tetapi berupa putaran berpilin yang mendekati inti dan akhirnya elektron akan jatuh ke inti. Artinya atom tidak stabil, padahal kenyataan atom adalah stabil Atom stabil Atom tidak stabil Spektrum menurut teori Atom Rutherford Spektrum hasil pengamatan Atom hidrogen ’ü▒Apabila jari-jari lintasan elektron semakin kecil maka waktu putarnya semakin kecil juga. Akibatnya frekwensi dan panjang gelombang elektromag-netik yang dipancarkan menjadi bermacam macam padahal dari hasil pengamatan kenyataannya spektrum dari atom hidrogen menunjukkan spektrum garis yang khas.
- 13. Spektrum Atom Hidrogen Model atom Rutherford tidak dapat menjelaskan spektrum cahaya yang dipancarkan oleh atom hidrogen. Dengan menggunakan spektrometer dapat diamati panjang gelombang yang dipancarkan oleh atom hidrogen. Pada tahun 1886 John Jacob Balmer secara empiris membuat perumusan tentang deret-deret yang sesuai dengan panjang gelombang pada spektrum atom hidrogen. = panjang gelombang spektrum cahaya yang dipancarkan oleh spektrum atom hidrogen R = tetapan Ryberg = 1,097x107 m-1 n = bilangan kwantum lebih besar 2
- 14. Deret Balmer bukanlah satu-satunya spektrum garis yang dihasilkan atom ŌĆō atom hidrogen. Deret ŌĆō deret lainnya didapatkan dalam daerah ultraungu, dengan batas panjang gelombang antara 121,6 dan 91,2 nm. Deret ini disebut deret Lyman dan memenuhi rumus: Deret ŌĆō deret lainnya ditemukan dalam daerah inframerah, yaitu Paschen, Brackett, dan Pfund. Secara umum rumus deret dapat dinyatakan sebagai:
- 15. Model Atom Bohr 1. Elektron tidak dapat bergerak mengelilingi inti melalui sembarang lintasan ,tetapi hanya dapat melalui lintasan tertentu saja tanpa mebebaskan energi.Lintasan itu disebut lintasan stasioner. Pada lintasan ini elektron memiliki momentum angular (sudut). Pada tahun 1913 Niels Bohr mengoreksi kelemahan teori atom Rutherford dengan teori kuantum Planck. Model atom Bohr dinyatakan dengan dua postulat m = massa elektron v = keecepatan linier elektron r = jaari-jari orbit elektron n = bilangan kwantum h = tetapan planck =6,626.10-34 J.s 2. Elektron dapat berpindah dari suatu lintasan ke lintasan yang lain dengan memancarkan atau menyerap energi foton. Energi footon yang dipancarkan atau diserap saat terjadi perpindahan lintasan sebanding dengan frekwensinya
- 16. Next >>
- 17. Apa yang dimaksud dengan radioaktivitas? Radioaktif atau radiasi yang berasal dari bahan radioaktif adalah satu bentuk energi yang dipancarkan oleh atom atau molekul yang disebarkan melalui ruang atau materi sebagai partikel / partikel ataupun gelombang elektromagnetik. Radioaktivitas (juga disebut radioaktif juga merupakan fenomena alami atau buatan, dimana ditimbulkan oleh zat tertentu atau bahan kimia. Ada dua radio aktif yang ada pada umumnya yaitu Radioaktivitas spontan atau alami: Hal ini diwujudkan dalam unsur- unsur radioaktif dan isotop ditemukan di alam dan mencemari lingkungan seperti uranium dan thorium dalam lingkungan (tanah,pohon, air dan udara) dan Radioaktivitas buatan atau induksi: radioaktif ini merupakan salah satu yang disebabkan oleh transformasi nuklir buatan seperti Technitium-99m yang digunakan dalam medis dan Iridium-192 yang digunakan dalam industri termasuk pembangkit listrik tenaga nuklir.
- 18. Radioaktivitas atau peluruhan radioaktif adalah perubahan atau konversi secara spontan inti nuklida stabil ke inti lainnya di mana ada radiasi pengion. Setiap kali jumlah proton dalam inti, maka akan ada unsur perubahan. Radioaktivitas ditemukan pada tahun 1896 oleh Henri Becquerel pada garam uranium. Untuk memperjelas sifat radioaktivitas signifikan, fisikawan Perancis Pierre Curie dan Marie Curie asal Polandia berkontribusi untuk hal ini. Sinar radioaktif ini berbentuk seperti gelombang cahaya, gelombang radio, sinar infra- red (panas), microwave dan sinar X. Antara sinar mengion yang ada adalah partikel Alfa, partikel beta, sinar Gamma, sinar X dan juga Neutron.
- 19. Pada tahun 1899 Ernest Rutherford melakukan percobaan dalam rangka studinya mengenai radioaktif. Ia menempatkan sedikit radium didasar sebuah kotak kecil dari timah hitam (timbal). Dia mendapatkan bahwa berkas sinar terpisah menjadi tiga komponen. Ada berapa jeniskah sinar radioaktif? Dengan memperhatikan arah sinar yang dibelokkan, dia menyimpulkan bahwa komponen sinar yang tidak dibelokkan adalah tidak bermuatan (sinar), komponen sinar yang dibelokkan ke kanan adalah bermuatan positif (sinar),dan sinar yang dibelokkan kekiri adalah bermuatan negative (sinar).
- 20. Bagaimana dengan daya tembus sinar ŌĆō sinar radioakti? Secara singkat urutan daya tembus adalah :
- 21. Sifat-sifat sinar 1. Sinar diahasilkan oleh pancaran-pancaran partikel dari sebuah sumber radioaktif. 2. Sinar tidak lain adalah inti atom helium,bermuatan +2e dan bermassa 4u. 3. Sinar dapat menghitamkan film. Jejak partikel dalam bahan radioaktif berupa garis lurus. 4. Radiasi sinar memiliki daya tembus terlemah dibandingkan dengan sinar lain. 5. Radiasi sinar memiliki jangkauan beberapa cm di udara da sekitar 10-2 mm dalam logam tipis. 6. Radiasi sinar mempunyai daya ionisasi paling kuat sebab muatannya paling besar. 7. Sinar dibelokkan oleh medan magnetic dan medan listrik. 8. Kecepatan sinar sekitar 0,054c sampai 0,07c, dengan c=kelajuan cahaya dalam vakum. 9. Massa sinar lebih besar dari sinar sehingga lebih lambat.
- 22. Sifat-sifat sinar 1.Sinar dihasilkan oleh pancaran partikel-partikel . 2.Sinar tidak lain adalah electron berkecapatan tinggi yang bermuatan -1 e. 3.Radiasi sinar < sinar < sinar . 4.Kecepatan parikel antara 0,32c dan 0,9c. 5.Sinar dibelokkan dengan medan magnetic dan medan listrik karena massanya kecil. 6.Jejak partikel dalam bahan berkelok-kelok. 7.Sinar memiliki jangkauan beberapa cm di udara.
- 23. Sifat-sifat sinar 1. Memiliki daya tembus paling besar tetapi daya ionisasi paling lemah. 2. Tidak dibelokkan oleh medan listrik dan medan magnetic. 3. Sinar merupakan radiasi elektromagnetik dengann panjang gelombang yang sangat pendek. 4. Sinar hampir tidak bermassa. 5. Kecepatan bernilai sama dengan kecepatan cahaya di ruang hampa. 6. Sinar dalam interaksinya menimbulkan peristiwa fotolistrik atau juga dapat menimbulkan produksi pasangan. Dalam interaksi dengan bahan,s eluruh energi sinar diserap oleh bahan. Peristiwa inilah yang disebut produksi pasangan.
- 24. Peluruhan Inti Atom Untuk mempertahankan kekekalan muatan (muatan total sebelum dan sesudah peluruhann adalah sama),peruahan muatan seperti ini berarti bahwa sebuah electron negative harus dipancarkan.Dengan demikian, Pemancaran elektron Elektron meninggalkan inti dan dikenal dengan ŌĆ£partikel betaŌĆØ. Pemancaran positron Peristiwa disini juga disebut sebagai peluruhan beta, karena mirip dengan pancaran elektron negative. Proses pengkapan elektron oleh proton untuk menjadi neutron dapat dinyatakan sebagai Penangkapan electron