TERMOKIMIA
- 2. APA ITU TERMOKIMIA? ÔÇßTermokimia adalah ilmu yang memepelajari tentang perubahan panas dalam reaksi kimia
- 3. SISTEM DAN LINGKUNGAN ÔÇß Sistem adalah bagian tertentu dari alam yang menjadi pusat perhatian. ÔÇß Lingkungan adalah segala sesuatu yang berada diluar sistem. Contoh : Sistem biasanya mencakup zat yang terlibat dalam perubahan kimia dan fisik. Misalnya, dalam percobaan netralisasi asam-basa, sistem mencakup 50 mL HCl dan 50 mL NaOH ditambahkan, sementara tabung reaksi, udara disekitar reaksi dan laboratorium tempat melangsungkan reaksi adalah Lingkungannya.
- 4. 3 Macam Sistem ÔÇß Sistem terbuka adalah sistem yang memungkinkan terjadinya perpindahan energi dan materi ke lingkungan. ÔÇß Sistem tertutup adalah sistem yang hanya memungkinkan terjadinya perpindahan energi ke lingkungan. ÔÇß Sistem terisolasi adalah sistem yang tidak memungkinkan terjadinya perpindahan kalor maupun materi dari sistem ke lingkungan.
- 5. Contoh
- 6. ENERGI DAN ENTALPI ÔÇß Energi adalah kemampuan untuk melaksanakan kerja ÔÇß Entalpi adalah istilah dalam termodinamika yang menyatakan jumlah energi dari suatu sistem termodinaka
- 7. Apa perbedaan antara Energi dan Entalpi? ÔÇß Energi hanya diukur dalam joule, tetapi entalpi diukur baik dengan joule dan joule per mol. ÔÇß Entalpi juga merupakan bentuk energi. Energi adalah keadaan materi, tetapi entalpi selalu perubahan energi antara dua keadaan. ÔÇß Energi hanya dapat berubah positif tetapi entalpi bisa positif dan negatif.
- 8. Perubahan entalpi PENGERTIAN Perubahan entalpi adalah perubahan panas dari reaksi pada suhu dan tekanan yang tetap, yaitu selisih antara entalpi zat-zat hasil dikurangi entalpi zat-zat reaktan. Rumus : ΔH = Hh - Hr ΔH : perubahan entalpi Hh : entalpi hasil reaksi Hr : entalpi zat reaktan.
- 9. Contoh
- 10. Reaksi eksoterm dan endoterm Reaksi eksoterm Adalah reaksi yang pada saat berlangsung terjadi pelepasan kalor Contoh
- 11. Reaksi endoterm Yaitu reaksi yang pada saat berlangsung terjadi penyerapan kalor Contoh :
- 13. Jenis-jenis perubahan entalphy(ΔH) :  Perubahan entalphy standar (ΔH°)  Adalah pengukuran besarnya kalor yang disebabkan dari suatu reaksi yang berlangsung pada suhu 25°C (298 K) dan tekanan 1 atm. Perubahan entalphy pembentukan standar(ΔH°f)  Ex : pembentukan H2O  H2 + O2 H2O ΔH°f = -134 j/mol
- 14.  Perubahan entalphy penguraian standar(ΔH°d) Adalah kebalikan dari ΔH°f , yaitu besarnya energy yang dibebaskan atau yang diperlukan untuk menguraikan 1 mol suatu senyawa menjadi unsur-unsurnya.  Ex : ΔH penguraian CO2 = + 392.2 kj/mol  CO2(g) C(s) + O2(g)
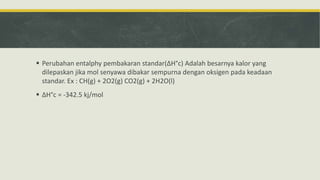
- 15.  Perubahan entalphy pembakaran standar(ΔH°c) Adalah besarnya kalor yang dilepaskan jika mol senyawa dibakar sempurna dengan oksigen pada keadaan standar. Ex : CH(g) + 2O2(g) CO2(g) + 2H2O(l)  ΔH°c = -342.5 kj/mol
- 16. Kalorimetri Kalorimetri adalah suatu sistem isolasi (tidak ada pertukaran materi maupun energi dengan lingkungan diluar kalorimeter. qreaksi = -(qkalorimeter + qlarutan) Jika nilai kapasitas kalor kalorimeter sangat kecil, kalor kalorimeter dapat diabaikan sehingga perubahan kalor dapat dianggap hanya berakibat pada kenaikan suhu larutan dalam kalorimeter.
- 17. Sehingga : qreaksi = -qlarutan qreaksi = -m.c.∆T Dengan : q = kalor reaksi (J atau kJ) m = massa (g atau kg) c = kalor jenis (J/g°C atau J/kg K) ∆T = perubahan suhu (°C atau K)
- 18. Namun biasanya pada kalorimeter bom, kapasitas kalor kalorimeter perlu diperhitungkan qreaksi = -(qkalorimeter + qlarutan) dengan nilai qkalorimeter = Ckalorimeter.∆T qreaksi = -(Ckalorimeter.∆T + m.c.∆T)
- 19. Hukum Hess “Perubahan entalphi suatu reaksi hanya tergantung pada keadaan awal (zat-zat pereaksi) dan keadaan akhir (zat-zat reaksi) dari suatu reaksi dan tidak tergantung bagaimana jalannya reaksi.” Pada perhitungan menggunakan hukum Hess, terdapat 4 cara yang dapat digunakan. • Cara data lengkap • Cara rumus ∆Hf • Cara diagram energi • Cara diagram siklus
- 20. Cara Data Lengkap Tidak semua reaksi kimia berlangsung dalam satu tahap, ada yang 2 tahap atau lebih. Namun, menurut Hess (1840) berapa pun tahap reaksinya, jika bahan awal dan hasil akhirnya sama, akan memberikan perubahan entalpi yang sama. Contoh reaksi : 1. Reaksi langsung A B ΔH1 = x Kkal 2. Secara tidak langsung a) lewat C A C C B ΔH2 = b Kkal ΔH3 = c Kkal
- 21. Contoh
- 22. Diagram Siklus dan Diagram Tingkat Energi + 1/2O2(g)
- 23. Rumus ∆Hf Diketahui : ∆Hf° H2O(g) = -242 kJ/mol ∆Hf° CO2(g) = -394 kJ/mol ∆Hf° CH4(g) = -84 kJ/mol Hitunglah perubahan entalpi pembakaran CH4
- 24. Apa Itu Energi Ikatan? Energi ikatan didefinisikan sebagai kalor yang diperlukan untuk memutuskan ikatan oleh satu mol molekul gas menjadi atom-atom atau gugus dalam keadaan gas.
- 25. Pemutusan dan Penggabungan ÔÇß Reaksi kimia pada dasarnya terdiri dari 2 proses yaitu : 1. Pemutusan ikatan antar atom dari senyawa yang bereaksi. Proses ini memerlukan kalor (Endoterm) 2. Penggabungan kembali ikatan dari atom-atom yang terlibat reaksi sehingga membentuk susunan baru. Proses ini melepaskan kalor (Eksoterm)
- 26. Pada reaksi : H2(g) + Cl2(g) 2HCl(g) ÔÇß Tahap pertama : H2(g) 2H(g) ................ Diperlukan energi Cl2(g) 2Cl(g) ............... Diperlukan energi ÔÇß Tahap kedua : H2(g) + Cl2(g) 2HCl(g) ... Melepaskan energi Secara skematis dapat digambarkan sebagai berikut. H2 Cl2 2H 2Cl 2HCl(g) MELEPAS ENERGI MENYERAP ENERGI
- 27. Energi Disosiasi Ikatan (D) Energi Disosiasi ikatan adalah energi yang diperlukan untuk memutuskan salah satu ikatan 1 mol suatu molekul gas menjadi gugus-gugus molekul gas. CH4(g) CH3(g) + H(g) ∆H = +425 KJ/mol *Energi ikatan dinyatakan dalam satuan kJ/mol.
- 28. Energi Ikatan Rata-rata Energi ikatan rata-rata merupakan energi rata-rata yang diperlukan untuk memutuskan sebuah ikatan dari seluruh ikatan suatu molekul gas menjadi atom- atom gas.
- 29. Contoh : Tentukan Energi ikat rata-rata dari ikatan C – H !  CH4(g) CH3(g) + H(g)..... ∆H = +425 KJ/mol  CH3(g) CH2(g) + H(g)..... ∆H = +480 KJ/mol  CH2(g) CH(g) + H(g)....... ∆H = +425 KJ/mol  CH(g) C(g) + H(g)........... ∆H = +335 KJ/mol  Maka, Energi ikat rata-rata dari ikatan C – H adalah +1665 KJ/mol = 416,25 KJ/mol 4 + +1665 KJ/mol
- 30. Tabel Energi Ikatan Rata-rata
- 31. Fungsi Energi Ikat 1. Sebagai petunjuk kekuatan ikatan dan kestabilan. ÔÇß Molekul dengan energi ikatan yang besar berarti ikatan dalam molekul tersebut kuat atau stabil. ÔÇß Molekul dengan energi ikatan yang kecil lebih mudah terurai
- 32. 2. Untuk memperkirakan nilai perubahan entalpi (∆H) ∆H merupakan selisih dari energi yang digunakan untuk memutuskan ikatan dengan energi untuk menggabungkan ikatan ΔH =∑Energi ikat Pereaksi – ∑Energi ikat Hasil Reaksi
- 33. Contoh Diketahui energi ikatan rata-rata : C ≡ C : 839 kJ/mol C− C : 343 kJ/mol H − H: 436 kJ/mol C − H: 410 kJ/mol Perubahan entalpi yang terjadi pada reaksi : CH3 −C ≡ CH + 2 H2 → CH3 −CH2 −CH3 sebesar... A. +272 kJ/mol B. – 272 kJ/mol C. – 1.711 kj/mol D. – 1.983 kJ/mol E. – 3.694 kJ/mol
- 34. Pembahasan Sisa ikatan yang masih ada: Ruas kiri : 1 buah C − C : 343KJ/mol 1 buah C ≡ C : 839 kJ/mol 2 buah H − H : 436 kJ/mol Kanan 2 buah C − C : 343KJ/mol 4 buah C − H : 410 kJ/mol
- 35. Bahan Bakar dan Perubahan Entalpi Bahan bakar merupakan suatu senyawa yang bila dilakukan pembakaran terhadapnya dihasilkan kalor yang dapat dimanfaatkan untuk berbagai keperluan. Bahan bakar yang banyak dikenal adalah jenis bahan bakar fosil, misalnya minyak bumi atau batu bara. Selain bahan bakar fosil dikembangkan pula bahan bakar jenis lain misalnya alkohol, hidrogen.
- 36. Tabel Nilai Kalor Bakar Beberapa Bahan Bakar