à Tom 1r batx
- 1. ðհŋēŅģ§ 1
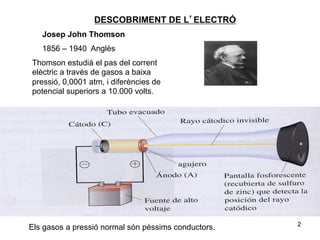
- 2. DESCOBRIMENT DE LâELECTRà Josep John Thomson 1856 â 1940 AnglÃĻs Thomson estudià el pas del corrent elÃĻctric a travÃĐs de gasos a baixa pressiÃģ, 0,0001 atm, i diferÃĻncies de potencial superiors a 10.000 volts. 2 Els gasos a pressiÃģ normal sÃģn pÃĻssims conductors.
- 3. DESCUBRIMENT DE LâELECTRà La utilitzaciÃģ de camps elÃĻctrics i magnÃĻtics va permetre a Thomson identificar i trobar la relaciÃģ entre la cà rrega i la massa de lâelectrÃģ. qe coulombs = 1,758 x108 me grams 3
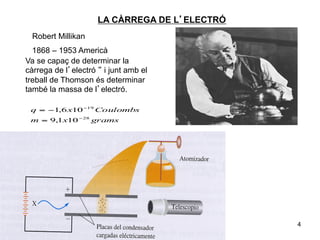
- 4. LA CÃRREGA DE LâELECTRà Robert Millikan 1868 â 1953 Americà Va se capaç de determinar la cà rrega de lâelectrÃģ â i junt amb el treball de Thomson ÃĐs determinar tambÃĐ la massa de lâelectrÃģ. q = â1,6 x10 â19 Coulombs m = 9,1x10 â 28 grams 4
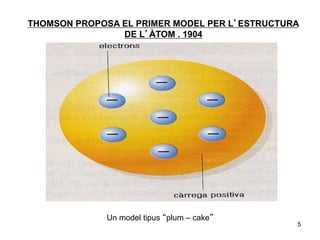
- 5. THOMSON PROPOSA EL PRIMER MODEL PER LâESTRUCTURA DE LâÃTOM . 1904 Un model tipus âplum â cakeâ 5
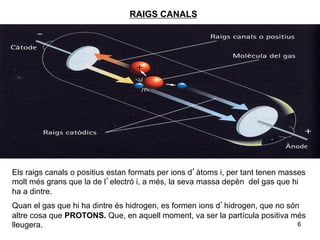
- 6. RAIGS CANALS Els raigs canals o positius estan formats per ions dâà toms i, per tant tenen masses molt mÃĐs grans que la de lâelectrÃģ i, a mÃĐs, la seva massa depÃĻn del gas que hi ha a dintre. Quan el gas que hi ha dintre ÃĐs hidrogen, es formen ions dâhidrogen, que no sÃģn altre cosa que PROTONS. Que, en aquell moment, va ser la partÃcula positiva mÃĐs lleugera. 6
- 7. LA RADIOACTIVITAT Antoine Henri Becquerel, FrancÃĻs. En 1896 va descobrir accidentalment que els minerals dâurani emeten radiacions invisibles, sense estimulaciÃģ prÃĻvia. Marie Skolodowska (polonesa) i el seu marit, Pierre Curie (francÃĻs). MÃĐs tard, van descobrà nous elements, com el radi i el poloni tambÃĐ emetien radiacions que anomenaren radioactivitat 7
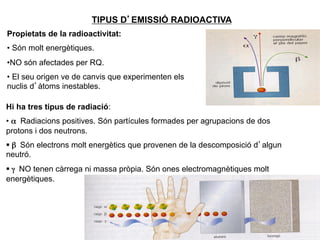
- 8. TIPUS DâEMISSIà RADIOACTIVA Propietats de la radioactivitat: âĒâŊ SÃģn molt energÃĻtiques. âĒâŊNO sÃģn afectades per RQ. âĒâŊ El seu origen ve de canvis que experimenten els nuclis dâà toms inestables. Hi ha tres tipus de radiaciÃģ: âĒâŊ Îą Radiacions positives. SÃģn partÃcules formades per agrupacions de dos protons i dos neutrons. §ï§âŊ Îē SÃģn electrons molt energÃĻtics que provenen de la descomposiciÃģ dâalgun neutrÃģ. §ï§âŊ Îģ NO tenen cà rrega ni massa prÃēpia. SÃģn ones electromagnÃĻtiques molt energÃĻtiques. 8
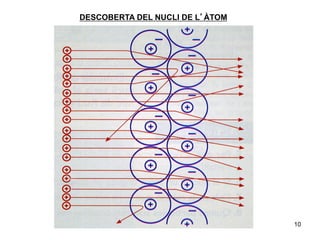
- 9. DESCOBERTA DEL NUCLI DE LâÃTOM Ernest Rutherford 1871 â 1937 Nova Zelanda Bombardejà amb nuclis heli una finÃssima là mina dâor. Es va trobar com si llancÃĐssim tret contra un paper de seda i sortÃs rebotat. 9
- 10. DESCOBERTA DEL NUCLI DE LâÃTOM 10
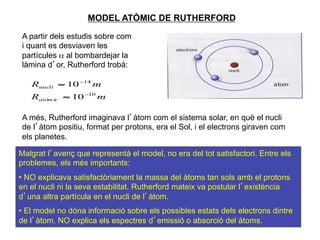
- 11. MODEL ATÃMIC DE RUTHERFORD A partir dels estudis sobre com i quant es desviaven les partÃcules Îą al bombardejar la là mina dâor, Rutherford trobà : Rnucli â 10 â14 m RatÃēm ic â 10 â10 m A mÃĐs, Rutherford imaginava lâà tom com el sistema solar, en quÃĻ el nucli de lâà tom positiu, format per protons, era el Sol, i el electrons giraven com els planetes. Malgrat lâavenç que representà el model, no era del tot satisfactori. Entre els problemes, els mÃĐs importants: âĒâŊ NO explicava satisfactÃēriament la massa del à toms tan sols amb el protons en el nucli ni la seva estabilitat. Rutherford mateix va postular lâexistÃĻncia dâuna altra partÃcula en el nucli de lâà tom. âĒâŊ El model no dÃģna informaciÃģ sobre els possibles estats dels electrons dintre de lâà tom. NO explica els espectres dâemissiÃģ o absorciÃģ del à toms. 11
- 12. DESCUBRIMENT DEL NEUTRÃ: James Chadwick Amb les seves experiÃĻncies Rutherford ja seân va donar compte que els nuclis dels à toms tenien una massa superior a la que Únicament aportaven els neutrons. Hi havia dâhaver una altra partÃcula. James Chadwick en 1932, va idear un procediment que li va permetre trobar el neutrÃģ. El muntatge ÃĐs el de la figura: NEUTRONS Bombardejà amb partÃcules alfa una là mina de beril·li, aquesta metia unes partÃcules que, no tenien cà rrega perÃē que tenien una energia cinÃĻtica semblant a la del protÃģ, xocaven contra una là mina de parafina. Aquesta emetia protons que sà eren detectats pel comptador Geiger. 12 Chadwick havia descobert el neutrÃģ
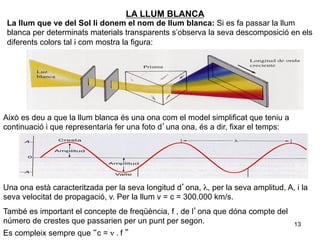
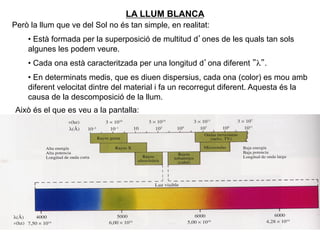
- 13. LA LLUM BLANCA La llum que ve del Sol li donem el nom de llum blanca: Si es fa passar la llum blanca per determinats materials transparents sâobserva la seva descomposiciÃģ en els diferents colors tal i com mostra la figura: AixÃē es deu a que la llum blanca ÃĐs una ona com el model simplificat que teniu a continuaciÃģ i que representaria fer una foto dâuna ona, ÃĐs a dir, fixar el temps: Una ona està caracteritzada per la seva longitud dâona, Îŧ, per la seva amplitud, A, i la seva velocitat de propagaciÃģ, v. Per la llum v = c = 300.000 km/s. TambÃĐ es important el concepte de freqÞÃĻncia, f , de lâona que dÃģna compte del nÚmero de crestes que passarien per un punt per segon. 13 Es compleix sempre que âc = Î― . f â
- 14. LA LLUM BLANCA PerÃē la llum que ve del Sol no ÃĐs tan simple, en realitat: âĒâŊ Està formada per la superposiciÃģ de multitud dâones de les quals tan sols algunes les podem veure. âĒâŊ Cada ona està caracteritzada per una longitud dâona diferent âÎŧâ. âĒâŊ En determinats medis, que es diuen dispersius, cada ona (color) es mou amb diferent velocitat dintre del material i fa un recorregut diferent. Aquesta ÃĐs la causa de la descomposiciÃģ de la llum. AixÃē ÃĐs el que es veu a la pantalla: 14
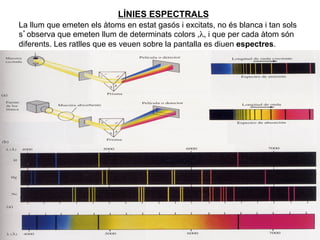
- 15. LÃNIES ESPECTRALS La llum que emeten els à toms en estat gasÃģs i excitats, no ÃĐs blanca i tan sols sâobserva que emeten llum de determinats colors ,Îŧ, i que per cada à tom sÃģn diferents. Les ratlles que es veuen sobre la pantalla es diuen espectres. 15
- 16. MOMENT HISTÃRIC: PRIMERS PASOS DE LA MECÃNICA QUÃNTICA âĒâŊ 1900 Planck explica un fenomen no explicat fins el moment relacionat amb la radiaciÃģ que emeten els cossos. Planck utilitza una nova idea, en espais limitats, les partÃcules i ones tan sols poden tenir determinats valors de lâenergia i, per tant, tan sols poden emetre o absorbir energia en paquets dâenergia de valor: âE= h.f â on â f â ÃĐs la freqÞÃĻncia de lâona. âĒâŊ 1905 Einstein confirma la hipÃētesi de Planck explicant amb ella lâefecte fotoelÃĻctric. âĒâŊ 1913 Bohr proposa el seu model atÃēmic que explica els espectres dâemissiÃģ i absorciÃģ dels à toms. 16
- 17. MODEL ATÃMIC DE BOHR PER LâHIDROGEN Niels Bohr, danÃĻs 1885 â 1962, aplica la teoria quà ntica per explicar lâà tom dâhidrogen i en particular les seves lÃnies espectrals. HipÃētesi de Bohr: 1.âŊ LâelectrÃģ es pot estar en determinats nivells energÃĻtics en els quals no emet energia. 2.âŊ LâelectrÃģ dintre de lâà tom tan sols pot tenir certs valors de lâenergia. 3.âŊ Quan lâelectrÃģ passa dâun nivell dâenergia a un altre de mÃĐs energia, ho fa absorbint un fotÃģ dâenergia Efinal- Einicial= h.f ; h = 6,624 x10â34 J .s Quan es dedueixen possibles valors de lâenergia de lâelectrÃģ dintre de lâà tom trobem: 2,18 x10 â18 En = â (J ) n2 17
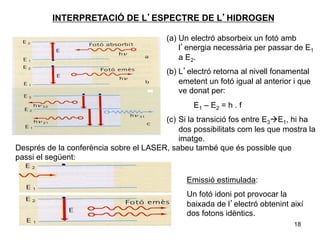
- 18. INTERPRETACIà DE LâESPECTRE DE LâHIDROGEN (a)âŊ Un electrÃģ absorbeix un fotÃģ amb lâenergia necessà ria per passar de E1 a E2. (b)âŊ LâelectrÃģ retorna al nivell fonamental emetent un fotÃģ igual al anterior i que ve donat per: E1 â E 2 = h . f (c)âŊ Si la transiciÃģ fos entre E3à ï E1, hi ha dos possibilitats com les que mostra la imatge. DesprÃĐs de la conferÃĻncia sobre el LASER, sabeu tambÃĐ que ÃĐs possible que passi el segÞent: EmissiÃģ estimulada: Un fotÃģ idoni pot provocar la baixada de lâelectrÃģ obtenint aixà dos fotons idÃĻntics. 18
- 19. ABSORCIà I EMISSIà DE RADIACIONS Molts à toms en estat gasÃģs absorbeixen i emeten radiacions que queden dintre del visible. Gas Gas 19
- 20. RATLLES ESPECTRALS 1eV = 1,60x10â19 J 20
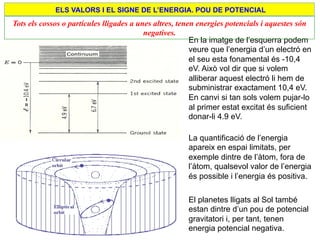
- 21. ELS VALORS I EL SIGNE DE LâENERGIA. POU DE POTENCIAL Tots els cossos o partÃcules lligades a unes altres, tenen energies potencials i aquestes sÃģn negatives. En la imatge de lâesquerra podem veure que lâenergia dâun electrÃģ en el seu esta fonamental ÃĐs -10,4 eV. AixÃē vol dir que si volem alliberar aquest electrÃģ li hem de subministrar exactament 10,4 eV. En canvi si tan sols volem pujar-lo al primer estat excitat ÃĐs suficient donar-li 4.9 eV. La quantificaciÃģ de lâenergia apareix en espai limitats, per exemple dintre de lâà tom, fora de lâà tom, qualsevol valor de lâenergia ÃĐs possible i lâenergia ÃĐs positiva. El planetes lligats al Sol tambÃĐ estan dintre dâun pou de potencial gravitatori i, per tant, tenen energia potencial negativa.
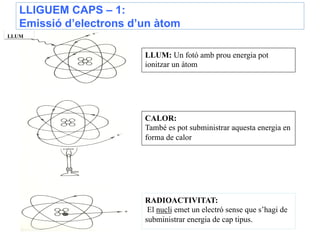
- 22. LLIGUEM CAPS â 1: AixÃ, un à tom pot emetre electrons de diferents llos i amb diferents energies, tal i com mostra lâesquema segÞent: EmissiÃģ dâelectrons dâun à tom LLUM LLUM: Un fotÃģ amb prou energia pot ionitzar un à tom CALOR: TambÃĐ es pot subministrar aquesta energia en forma de calor RADIOACTIVITAT: El nucli emet un electrÃģ sense que sâhagi de subministrar energia de cap tipus. Aprofitem per repassar que lâà tom pot emetre fotons de diferents procedÃĻncies i diferents energies.
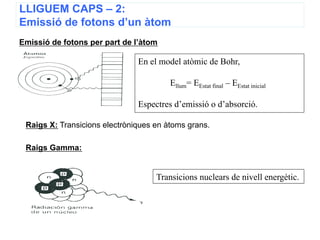
- 23. LLIGUEM CAPS â 2: EmissiÃģ de fotons dâun à tom EmissiÃģ de fotons per part de lâà tom En el model atÃēmic de Bohr, Ellum= EEstat final â EEstat inicial Espectres dâemissiÃģ o dâabsorciÃģ. Raigs X: Transicions electrÃēniques en à toms grans. Raigs Gamma: Transicions nuclears de nivell energÃĻtic. 10
- 24. TEORIA MECANICA - ONDULATÃRIA âĒâŊ1924 De Broglie proposa que les partÃcules elementals, com els electrons, protons i demÃĐs, tambÃĐ es comporten com ones en determinades circumstà ncies. âĒâŊ 1925 SchrÃķdinger desenvolupa les matemà tiques de la mecà nica ondulatÃēria de lâelectrÃģ. Ara el comportament de lâelectrÃģ dins lâà tom ve descrit per una ona que tan sols ens informe dels llocs on ÃĐs mÃĐs provable trobar lâelectrÃģ. Les conseqÞÃĻncies dâaquesta teoria sÃģn: 1.âŊ Es perd la idea de trajectÃēria per a lâelectrÃģ. No es pot precisar on es troba. Tan sols podem parlar de zones on ÃĐs mÃĐs provable trobar lâelectrÃģ. 2.âŊ Les zones on ÃĐs mÃĐs provable trobar lâelectrÃģ reben el nom dâorbitals. 3.âŊ Aquests orbitals queden determinats per 4 nÚmeros, que diem quà ntics. Aquests nÚmeros tan sols poden tenir certs valors. Els orbitals reben el nom de: â s, p, d i f â, segons la seva forma i aquesta depÃĻn dels nÚmeros quà ntics. 4.âŊ A mÃĐs, lâelectrÃģ, tÃĐ propietats magnÃĻtiques prÃēpies que es poden atribuir a un moviment de rotaciÃģ sobre ell mateix, que rep el nom dâespÃn. TambÃĐ 24 lâespÃn tan sols pot tenir certs valors.
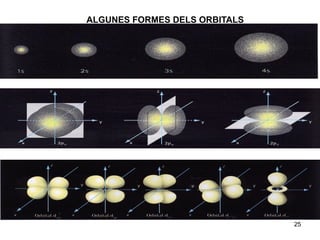
- 25. ALGUNES FORMES DELS ORBITALS 25
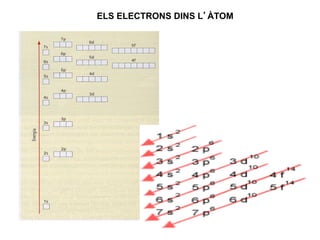
- 26. ELS ELECTRONS DINS LâÃTOM 26