Ă€TOMS - ISĂ’TOPS - IONS
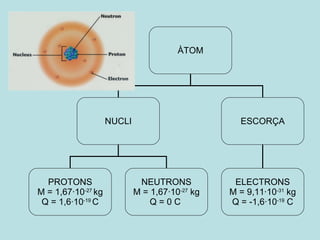
- 1. ÀTOM NUCLI ESCORÇA ELECTRONS M = 9,11·10 -31 kg Q = -1,6·10 -19 C PROTONS M = 1,67·10 -27 kg Q = 1,6·10 -19 C NEUTRONS M = 1,67·10 -27 kg Q = 0 C
- 2. X = element Z = nombre atòmic = nombre de protons A = nombre mĂ ssic = nombre de protons + neutrons Ex: Z = 2 A = 4 2 protons, 2 electrons, 2 neutrons És el nombre caracterĂstic que identifica cada element
- 3. ISÒTOPS Àtoms amb = nombre atòmic ≠nombre mà ssic Els isòtops són à toms d’un mateix element amb diferent nombre de neutrons. 1 protó, 1 electró, 2 neutrons 1 3 H Triti 1 protó, 1 electró, 1 neutró 1 2 H Deuteri 1 protó, 1 electró 1 1 H Hidrogen
- 4. ÀTOMS NEUTRES Són à toms sense cà rrega neta electrons = protons = Z IONS Són à toms carregats elèctricament Cations : positius Han perdut electrons e - < Z Ex: Fe 2+ Anions : negatius Han guanyat electrons e - > Z Ex: Cl -
- 5. 40 20 Ca 2+ 1 1 H + 92 235 U 92 238 U 20 18 17 20 17 17 18 18 17 18 17 17 8 6 6 NEUTRONS ELECTRONS PROTONS