V I I┬░ Lezione
- 1. Classificazione delle proteine in base ai livelli strutturali PROTEINE FIBROSE ŌĆó Costituite in gran parte da un unico tipo di struttura secondaria ŌĆó Hanno catene polipeptidiche disposte in lunghi fasci o in foglietti ŌĆó Determinano la resistenza, la forma e la protezione esterna delle cellule nei vertebrati ŌĆó Insolubili in acqua: presenza di molti amminoacidi idrofobici sia allŌĆÖinterno che allŌĆÖesterno della proteina PROTEINE GLOBULARI ŌĆó Contengono pi├╣ tipi di struttura secondaria ŌĆó Hanno catene polipeptidiche ripiegate per assumere una forma globulare o sferica ŌĆó La maggior parte degli enzimi e delle proteine regolatrici sono globulari ŌĆó Pi├╣ solubili in acqua: presentano un interno idrofobo e una superficie idrofila
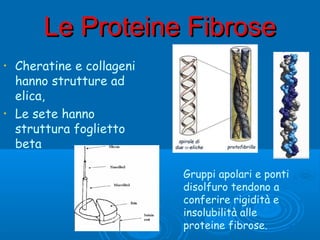
- 2. Le Proteine FibroseLe Proteine Fibrose ŌĆó Sono di origine animali, ŌĆó insolubili in acqua, ŌĆó Assolvono ruoli strutturali per lo pi├╣. Si dividono in tre categorie: ’āś le cheratine ’āś i collageni ’āś le sete Formano tessuti protettivi Formano tessuti connettivi Come i bozzoli dei bachi da seta
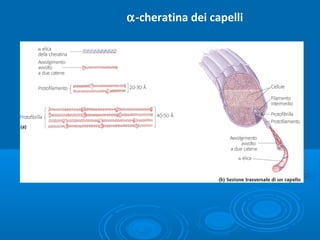
- 3. Proteine fibrose: ╬▒-cheratina ŌĆó Componente dei capelli, lana, penne, unghie, artigli, corna, zoccoli e strati esterni della pelle ŌĆó ├ł costituita da una struttura ad ╬▒-elica destrorsa ŌĆó Due catene di ╬▒-elica si avvolgono in un superavvolgimento sinistrorso ŌĆó Ha un ruolo strutturale ŌĆó ├ł ricca di Cys che formano ponti disolfuro trasversali tra fibre adiacenti, aumentandone la resistenza 18 % Cys
- 5. Le Proteine FibroseLe Proteine Fibrose ŌĆó Cheratine e collageni hanno strutture ad elica, ŌĆó Le sete hanno struttura foglietto beta Gruppi apolari e ponti disolfuro tendono a conferire rigidit├Ā e insolubilit├Ā alle proteine fibrose.
- 6. Il collagene: una tripla elicaIl collagene: una tripla elica ’āś Principale componente dei tessutiPrincipale componente dei tessuti connettivi (ossa, tendini, denti, cartilagini)connettivi (ossa, tendini, denti, cartilagini) ’āś Tre catene avvolte tra loroTre catene avvolte tra loro ((tropocollagenetropocollagene): elica pi├╣ estesa dellŌĆÖ): elica pi├╣ estesa dellŌĆÖ╬▒╬▒-- elicaelica ’āś Composizione amminoacidica particolareComposizione amminoacidica particolare ’ü¼ Un residuo ogni tre ├©Un residuo ogni tre ├© GlyGly ’ü¼ Ricco inRicco in prolinaprolina ’ü¼ Amminoacidi insoliti (idrossilisina,Amminoacidi insoliti (idrossilisina, idrossiprolina: formano ponti a idrogeno)idrossiprolina: formano ponti a idrogeno) ŌĆ£post-traduzionaliŌĆØŌĆ£post-traduzionaliŌĆØ
- 7. Le Proteine GlobulariLe Proteine Globulari ŌĆó Sono solubili in acqua, ŌĆó di forma quasi sferica, ŌĆó Assolvono funzioni biologiche. Possono essere:Possono essere: ŌĆó EnzimiEnzimi ŌĆó OrmoniOrmoni ŌĆó Proteine di trasportoProteine di trasporto ŌĆó Proteine di depositoProteine di deposito
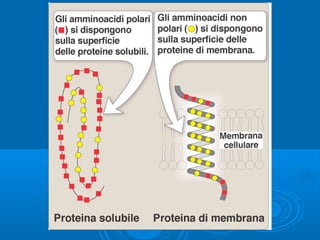
- 8. Le Proteine GlobulariLe Proteine Globulari ŌĆó ContengonoContengono amminoacidi conamminoacidi con catene polari e carichi,catene polari e carichi, ŌĆó Sono struttureSono strutture elicoidali.elicoidali. Mioglobina, proteina globulare che trasporta lŌĆÖossigeno nei muscoli. Le interazioni sono dovute a ponti disolfuro, alla polarit├Ā o meno dei gruppi R, e alla capacit├Ā di formare legame ad idrogeno.
- 9. La Struttura TerziariaLa Struttura Terziaria ŌĆó La struttura terziaria ├© la conformazione tridimensionale assunta da una proteina. ŌĆó ├ł stabilizzata da legami non covalenti come ponti idrogeno, interazioni idrofobiche tra amminoacidi non polari e legami ionici. ├ł indispensabile per la sua attivit├Ā biologica.
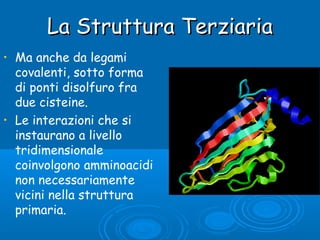
- 10. La Struttura TerziariaLa Struttura Terziaria ŌĆó Ma anche da legami covalenti, sotto forma di ponti disolfuro fra due cisteine. ŌĆó Le interazioni che si instaurano a livello tridimensionale coinvolgono amminoacidi non necessariamente vicini nella struttura primaria.
- 11. La Struttura TerziariaLa Struttura Terziaria ŌĆó Quando le interazioni vengono meno, in presenza di elevate temperature, di pH non ottimale o di detergenti, la struttura tridimensionale viene persa, cos├¼ la proteina va incontro a denaturazione, perdendo la sua attivit├Ā biologica. la denaturazione a volte ├© un processo reversibile, e, allontanando l'agente denaturante, la proteina riprende spontaneamente la sua conformazione tridimensionale (che ├© dettata dalla struttura primaria).
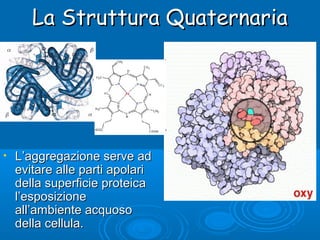
- 13. La Struttura QuaternariaLa Struttura Quaternaria ŌĆó Ogni proteina tende ad assumere una sola struttura terziaria e proteine differenti assumono conformazioni differenti. Talvolta le proteine possono assumere anche una struttura quaternaria. ├ł composta da aggregati di un certo numero di subunit├Ā Emoglobina di un adulto
- 14. La Struttura QuaternariaLa Struttura Quaternaria ŌĆó LŌĆÖaggregazione serve adLŌĆÖaggregazione serve ad evitare alle parti apolarievitare alle parti apolari della superficie proteicadella superficie proteica lŌĆÖesposizionelŌĆÖesposizione allŌĆÖambiente acquosoallŌĆÖambiente acquoso della cellula.della cellula.
- 15. DIGESTIONE DELLE PROTEINE PROTEINA MACROPEPTIDI PEPTIDI AMMINOACIDI Vena porta Acido cloridrico + Pepsina Pepridasi pancreatiche Enzimi parete intestinale FEGATO
- 17. CREATINACREATINA EFFETTI POSITIVI (50%) SU FORZA E POTENZA MUSCOLARI IN SINGOLI GESTI RIPETUTI OPPURE IN SCATTI INTERCALATI AD ATTIVITAŌĆÖ AEROBICA. EFFETTO ANABOLIZZANTE RITENZIONE IDRICA E EFFETTO OSMOTICO EFFETTI SULLA FATICA (relativo risparmio glicolisi anaerobia e modulazione ammoniemia)
- 18. CREATINACREATINA EFFETTI COLLATERALI Sicuramente aumento di massa corporea per ritenzione idrica In acuto: effetto osmotico intraintestinale, diarrea, disidratazione , crampi A lungo termine: insufficienza renale? Diminuzione della sintesi del trasportatore di membrana?
- 19. Sintesi dellaSintesi della creatinacreatina e suae sua degradazionedegradazione inin creatininacreatinina
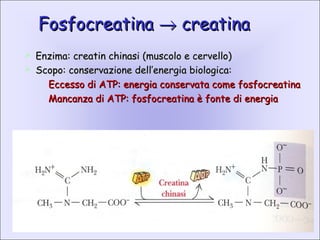
- 20. FosfocreatinaFosfocreatina ŌåÆŌåÆ creatinacreatina ’āś Enzima: creatin chinasi (muscolo e cervello)Enzima: creatin chinasi (muscolo e cervello) ’āś Scopo: conservazione dellŌĆÖenergia biologica:Scopo: conservazione dellŌĆÖenergia biologica: ’ü¼ Eccesso di ATP: energia conservata come fosfocreatinaEccesso di ATP: energia conservata come fosfocreatina ’ü¼ Mancanza di ATP: fosfocreatina ├© fonte di energiaMancanza di ATP: fosfocreatina ├© fonte di energia
- 22. EnzimiEnzimi’ü« Gli enzimi consentono alle reazioni diGli enzimi consentono alle reazioni di procedere a velocit├Ā compatibili con la vitaprocedere a velocit├Ā compatibili con la vita ’ü« sono catalizzatori di natura proteicasono catalizzatori di natura proteica ’ü« influenzano la velocit├Ā, mainfluenzano la velocit├Ā, ma nonnon lŌĆÖequilibriolŌĆÖequilibrio ’ü« non si consumano: si trovano immutati alla finenon si consumano: si trovano immutati alla fine della reazionedella reazione ’ü« presenti in piccole quantit├Ā (importanza dellapresenti in piccole quantit├Ā (importanza della concentrazione)concentrazione) ’ü« formano complessi reversibili con il substratoformano complessi reversibili con il substrato ’ü« sonosono specifici (ad esempio digestione)specifici (ad esempio digestione)
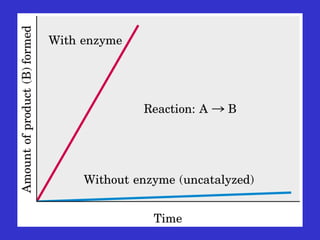
- 23. Gli enzimi sono catalizzatori di naturaGli enzimi sono catalizzatori di natura proteica: accelerano le reazioni biologicheproteica: accelerano le reazioni biologiche di diversi ordini di grandezzadi diversi ordini di grandezza Aumenti di velocit├Ā prodotti da enzimi
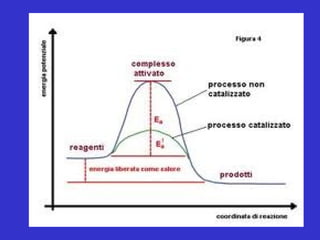
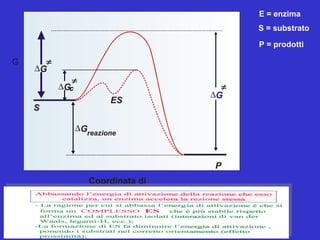
- 26. G Coordinata di reazione ŌłåGreazione ŌłåG S P ES ŌłåGc ŌłåG E = enzima S = substrato P = prodotti
- 27. Modello ŌĆ£Lock and KeyŌĆØ: lŌĆÖenzima si combina chimicamente col substrato ŌĆó Il sito attivo ├© costituito dal ŌĆ£negativoŌĆØ del substrato ŌĆō Si formano legami ŌĆ£esattiŌĆØ fra enzima e substrato ŌĆō Esiste una regione dellŌĆÖenzima detta sito di legame e una detta sito catalitico ŌĆó Riconoscimento spesso tridimensionale ŌĆō Esempio: glicerol kinasi (lega solo il glicerolo in forma alfa)
- 28. il legame avviene in una specifica regione dellŌĆÖenzima chiamato sito attivo il potere catalitico dellŌĆÖenzima ├© legato alla formazione del complesso enzima substrato ES se la concentrazione dellŌĆÖenzima ├© costante la velocit├Ā della reazione aumenta proporzionalmente allŌĆÖaumento della concentrazione del substrato fino a un valore costante vmax sito attivo occupa solo una piccola parte del volume dellŌĆÖenzima sito attivo ├© tridimensionale legami sito attivo-substrato:legami secondari CARATTERISTICHE GENERALI
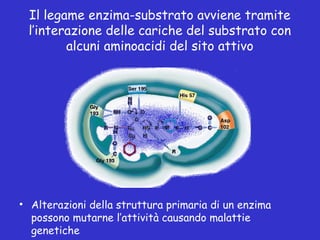
- 29. Il legame enzima-substrato avviene tramite lŌĆÖinterazione delle cariche del substrato con alcuni aminoacidi del sito attivo ŌĆó Alterazioni della struttura primaria di un enzima possono mutarne lŌĆÖattivit├Ā causando malattie genetiche
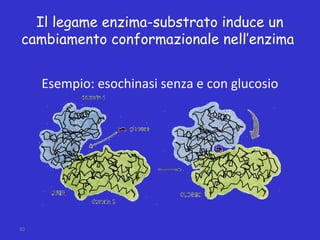
- 30. 30 Il legame enzima-substrato induce un cambiamento conformazionale nellŌĆÖenzima Esempio: esochinasi senza e con glucosio