materi.pptx
- 2. Kimia organik adalah bidang ilmu yang mempelajari tentang struktur, sifat-sifat, komposisi, reaksi, dan sintesis senyawa organik. Senyawa organik dibangun terutama oleh karbon dan hidrogen serta dapat mengandung unsur-unsur lain. Pengertian
- 3. Perbedaan senyawa organik dan anorganik Senyawa organik Senyawa anorganik Reaksi berjalan lambat Reaksi berjalan cepat Titik didih dan titik leleh rendah Titik didih dan titik leleh tinggi Mudah terurai dengan pemanasan Lebih stabil dengan pemanasan Molekulnya dapat membentuk isomer Tidak dapat membentuk isomer Mudah larut dalam pelarut nonpolar, kurang larut dalam air atau pelarut polar Mudah larut dalam air atau pelarut polar, kurang larut dalam pelarut nonpolar
- 4. Kekhasan atom karbon (C) Macam rantai karbon - Termasuk atom non logam a. Rantai terbuka (alifatik) - Memiliki 4 elektron valensi C â C â C â C - Membentuk 4 ikatan kovalen b. Rantai tertutup (siklik) Macam ikatan atom C - Ikatan tunggal (ikatan jenuh) C â C â C â C - Ikatan rangkap (ikatan tak jenuh) c. Rantai lurus a. Ikatan rangkap dua C â C â C â C C â C = C â C d. Rantai cabang b. Ikatan rangkap tiga C â C â C â C â C C ⥠C â C â C âŦŨ⎠C Kimia Karbon C C C
- 5. Macam senyawa hidrokarbon - Alkana ( â ) ïĻ CnH2n+2 - Alkena ( = ) ïĻ CnH2n - Alkuna ( ⥠) ïĻ CnH2n-2 Alkana
- 6. Alkena
- 7. Alkuna
- 8. Rantai samping (Cabang) Rantai samping atau cabang adalah suatu gugus alkil sebagai cabang dari rantai induk. Gugus alkil dinamai menurut induk alkananya sendiri dengan mengubah akhiran âana menjadi âil. Rumus dari gugus alkil adalah R = CnH2n+1 Contohnya CH4 adalah metana maka gugus âCH3 adalah gugus metil. Struktur Nama -CH3 Metil -CH2CH3 Etil -CH2CH2CH3 Propil -CH2(CH2)2CH3 Butil -CH2(CH2)3CH3 Amil
- 9. Penamaan berdasarkan IUPAC (International Union of Pure and Applied Chemistry) untuk rantai karbon bercabang sebagai berikut : a. Menentukan rantai induk yaitu rantai karbon terpanjang b. Menomori rantai induk dimulai dari ujung yang paling dekat dengan percabangan c. Mengenali jenis cabang dan posisinya d. Melekatkan nomor dan nama cabang pada nama rantai induk Contoh : C C C C C C C C
- 10. Struktur garis Contoh : C C C C CC C C C C â
- 11. Isomer Isomer merupakan senyawa-senyawa dengan rumus kimia sama namun rumus strukturnya berbeda. a. Isomer rangka/rantai Terjadi karena adanya perbedaan rantai induk b. Isomer posisi Terjadi karena adanya perbedaan posisi cabang-cabang pada rantai induk yang sama ataupun perbedaan letak ikatan rangkap pada alkena dan alkuna c. Isomer geometri Terjadi karena tidak adanya rotasi bebas pada ikatan antaratom C - Cis â atom atau gugus atom berada pada sisi yang sama - Trans â atom atau gugus atom berada pada sisi yang berseberangan
- 12. a. Alkana Sifat fisik : - Bersifat nonpolar - Titik didih meningkat dengan bertambahnya jumlah atom C - Adanya gugus alkil atau cabang dapat menurunkan tiitk didih - Larut dalam pelarut nonpolar Sifat kimia : - Cukup stabil atau tidak reaktif - Mengalami tiga jenis reaksi yaitu : 1) Reaksi oksidasi atau pembakaran 2) Reaksi substitusi atau penggantian 3) Reaksi eliminasi atau pelepasan Sifat fisik dan kimia alkana, alkena, alkuna
- 13. b. Alkena Sifat fisik : - Bersifat nonpolar - Titik didih meningkat dengan bertambahnya jumlah atom C - Adanya gugus alkil atau cabang dapat menurunkan titik didih Sifat kimia : - Lebih reaktif dibandingkan alkana - Reaksi yang dapat terjadi : 1) Reaksi oksidasi 2) Reaksi adisi atau penambahan 3) Reaksi polimerisasi
- 14. c. Alkuna Sifat fisik : - Bersifat nonpolar - Titik didih meningkat dengan bertambahnya jumlah atom C - Adanya gugus alkil atau cabang dapat menurunkan titik didih Sifat kimia : - Lebih reaktif dibandingkan alkana dan alkena - Reaksi yang dapat terjadi : 1) Reaksi oksidasi 2) Reaksi adisi
- 15. Sikloalkana merupakan rantai karbon yang saling terikat dan membentuk cincin dengan ikatan jenuh dan dapat dikatakan sebagai modifikasi dari alkana. Cincin-cincin sikloalkana terbentuk karena âCH2â yang saling mengikat. Karakteristik sikloalkana - Memiliki rumus CnH2n - Bersifat nonpolar, tidak larut dalam air - Titik didih dan titik leleh sama dengan alkana dengan jumlah atom C sama - Bersifat jenuh Contoh sikloalkana : Sikloalkana
- 16. Tata nama sikloalkana : - Untuk sikloalkana tidak bercabang cukup menyebutkan nama sesuai jumlah atom C dengan awalan sikloâ dan akhiran âana. - Untuk sikloalkana bercabang dengan satu cabang maka harus ditentukan yang mana rantai induknya. - Untuk sikloalkana yang memiliki lebih dari satu cabang maka penamaannya harus mengutamakan urutan terkecil pada penomoran cabang. - Apabila ada dua alkil yang memiliki kemungkinan untuk mendapatkan nomor yang sama maka penomoran berdasarkan urutan alfabet nama alkil tersebut.
- 18. CH3 H3CH2C CH3 C H 3 CH3 CH3 C H 3 C H 3 C H 3
- 19. Isomer geometri pada sikloalkana : H H C H 3 H 3 C H 3 C H C H 3 H
- 20. Gugus Fungsi Alkohol/alkanol Eter/alkoksi alkana Aldehid/alkanal Keton/alkanon Asam karboksilat/asam alkanoat Ester/alkil alkanoat Amina/alkil amina Haloalkana/alkil halida O H R O R R ' C R O H C R R ' O R C O O R ' R C O O H N H 2 R X R
- 21. Alkohol Tiga jenis alkohol : - Alkohol primer â atom C dengan gugus âOH mengikat satu atom C lain Contoh : - Alkohol sekunder â atom C dengan gugus âOH mengikat dua atom C lain Contoh : - Alkohol tersier â atom C dengan gugus âOH mengikat tiga atom C lain Contoh : Alkohol dan eter (CnH2n+2O) C C C C O H C C C C O H C C C C O H C
- 22. Cara membedakan alkohol primer, sekunder, dan tersier : Dengan reaksi oksidasi Alkohol primer + ð â aldehid Alkohol sekunder + ð â keton Alkohol tersier + ð â Tata nama - Diambil dari nama alkana induk dengan akhiran âol - Penomoran atom C dimulai dari C yang mengikat gugus âOH - Bila terdapat lebih dari satu gugus fungsi maka digunakan penandaan di, tri, dst tepat sebelum akhiran -ol
- 23. Pembuatan alkohol - Reaksi substitusi nukleofilik Contoh : - Reduksi senyawa karbonil Contoh : C - C - C - C - B r + O H - k a l o r C - C - C - C - O H + B r - C H 3 C C H 3 O C H 3 C H C H 3 O H O O H
- 24. Eter Tata nama : C O C m e t o k s i m e t a n a / d i m e t i l e t e r C O C m e t o k s i e t a n a / e t i l m e t i l e t e r C C O C 2 - m e t o k s i p r o p a n a C C
- 25. Pembuatan eter Sintesis eter Williamson Yaitu reaksi antara alkil halida dengan suatu alkoksida atau fenoksida Contoh : C H 3 O - + C H 3 C H 2 C H 2 - C l C H 3 O C H 2 C H 2 C H 3 + C l - i o n m e t o k s i d a 1 - k l o r o p r o p a n a m e t o k s i p r o p a n a C H 3 C H 2 C H 2 O - + C H 3 - I C H 3 O C H 2 C H 2 C H 3 + I - i o n p r o p o k s i d a i o d o m e t a n a m e t o k s i p r o p a n a
- 26. Cara membedakan alkohol dan eter Direaksikan dengan natrium - Alkohol + Na â gas H2 R-OH + Na â R-ONa + H2 - Eter + Na â
- 27. Aldehid Tata nama : Aldehid dan keton (CnH2nO) H C O H m e t a n a l / f o r m a l d e h i d / m e t i l a l d e h i d C H 3 C O H e t a n a l / e t i l a l d e h i d C 2 H 5 C H O p r o p a n a l / p r o p i l a l d e h i d
- 28. Pembuatan aldehid Reaksi oksidasi suatu alkohol primer Contoh : R C H 2 O H R C H O o k s i d a t o r C H 3 ( C H 2 ) 5 C H 2 O H C H 3 ( C H 2 ) 5 C H O o k s i d a t o r
- 30. Pembuatan keton Reaksi oksidasi suatu alkohol sekunder Contoh : R - C H - R ' R - C - R ' o k s i d a t o r O H O C H 3 - C H - C H 3 C H 3 - C - C H 3 o k s i d a t o r O H O
- 31. Cara membedakan aldehid dan keton - Dengan pereaksi Fehling Aldehid + P. Fehling â endapan merah bata Keton + P. Fehling â - Dengan pereaksi Tollens Aldehid + P. Tollens â cermin perak Keton + P. Tollens â
- 32. Tata nama Asam karboksilat HC O OH asammetanoat/ asamformat CH3C O OH asametanoat/ asamasetat CH3CH2C O OH asam propanoat/ asam propionat
- 33. Pembuatan asam karboksilat Reaksi oksidasi aldehida R C O H + O R C O O H
- 35. Pembuatan ester Reaksi esterifikasi R C O O H + R C O O R ' R ' - O H + H 2 O
- 36. Tata nama Amina sederhana diberi nama berdasarkan sistem gugus fungsional. Gugus alkil disebut terlebih dahulu kemudian ditambah akhiran âamina. Contoh : Amina C H 3 C H 2 C H 2 N H 2 p r o p i l a m i n a N H 2 s i k l o h e k s i l a m i n a
- 37. Pembuatan amina Reaksi substitusi nukleofilik Contoh : R X + N H 3 R N H 3 + X - R N H 2 C H 3 C l + N H 3 C H 3 N H 3 + C l - C H 3 N H 2
- 39. Reaksi pada alkil halida - Reaksi substitusi nukleofilik Reaksi SN2 â substitusi nukleofilik bimolekular. Alkil halida primer apa saja bereaksi SN2 dengan nukleofil agak kuat seperti OH- dan CN- serta nukleofil lemah seperti H2O. Alkil halida sekunder dapat bereaksi SN2 namun alkil halida tersier tidak dapat. Reaksi SN1 â substitusi nukleofilik unimolekular. Alkil halida tersier bereaksi SN1 dengan nukleofil berupa basa yg sangat lemah seperti H2O atau CH3CH2OH. Reaksi ini kadang juga disebut reaksi solvolisis. - Reaksi eliminasi Reaksi E2 â eliminasi bimolekular. Dominan bila digunakan basa kuat seperti OH- dan OR- dengan temperatur tinggi. Reaksi E1 â eliminasi unimolekular. Dicirikan dengan terbentuknya karbokation.
- 40. Struktur benzena Sifat-sifat benzena - Tidak reaktif - Bersifat nonpolar - Sukar mengalami adisi - Mudah mengalami substitusi Benzena dan turunannya (C6H6)
- 41. Turunan benzena 1. Satu subtituen O H h id r o k s i b e n z e n a / f e n o l N H 2 C l a m in o b e n z e n a / a n ilin k lo r o b e n z e n a C H 3 m e til b e n z e n a / to lu e n a N O 2 C O O H n itr o b e n z e n a a s a m b e n z o a t
- 42. 2. Dua subtituen - Orto (o) - Para (p) - Meta (m) C l 1 ,2 - d ik lo r o b e n z e n a / o - d ik lo r o b e n z e n a C l F 1 ,3 -d iflo ro b e n z en a / m -d iflo ro b e n ze n a F 1,4-diflorobenzena/ p-diflorobenzena F F
- 43. Apabila substitusi lebih dari dua atom H maka penomoran didasarkan pada kereaktifan gugus-gugusnya. Gugus dengan kereaktifan lebih tinggi diberi nomor terkecil. Urutan kereaktifan gugus -COOH > -SO3H > -COH > -CN > -NH3 > -OH > -R> -NO2 > -X N O 2 C H 3 N O 2 N O 2 2 , 4 , 6 - t r i n i t r o t u l u e n a
- 44. Tuliskan struktur dari a. Propil benzena b. 3,4-dikloroanisola c. p-nitrofenol d. m-kloroanilina e. p-bromonitrobenzena f. 3,5-diklorofenol
- 45. Substitusi elektrofilik pada benzena Terdapat 4 tahap : 1. Pembentukan elektrofil, dengan katalis asam Lewis, dimana asam Lewis ini akan bereaksi dengan reagensia (misal X2, HNO3) untuk menghasilkan elektrofil 2. Pembentukan ion benzenonium 3. Deprotonasi 4. Pembentukan kembali asam lewis
- 46. Reaksi halogenasi a. Tahap I = pembentukan elektrofil Br+ b. Tahap II = pembentukan ion benzenonium (serangan elektrofil Br+) c. Tahap III = deprotonasi ion benzenonium d. Tahap IV = pembentukan kembali katalis asam Lewis
- 47. Reaksi nitrasi a. Tahap I = pembentukan elektrofil NO2 + b. Tahap II = pembentukan ion benzenonium (serangan elektrofil NO2 + ) c. Tahap III = deprotonasi ion benzenonium d. Tahap IV = pembentukan kembali katalis asam Lewis
- 48. Reaksi alkilasi a. Tahap I = pembentukan elektrofil R+ b. Tahap II = pembentukan ion benzenonium (serangan elektrofil R+ ) c. Tahap III = deprotonasi ion benzenonium d. Tahap IV = pembentukan kembali katalis asam Lewis
- 49. Reaksi asilasi a. Tahap I = pembentukan elektrofil RC+=O (ion asilium) b. Tahap II = pembentukan ion benzenonium (serangan elektrofil RC+=O ) c. Tahap III = deprotonasi ion benzenonium d. Tahap IV = pembentukan kembali katalis asam Lewis
- 50. Substitusi kedua Posisi serangan kedua
- 51. Tuliskan bagaimana mensintesis senyawa berikut dari benzena a. p-klorotoluena b. m-bromonitrobenzena Apa produk yang dihasilkan dari substitusi kedua untuk a. C6H5OH + Br2 b. C6H5NO2 + CH3Cl c. C6H5COOH + CH3Cl
- 52. Substitusi ketiga 1. Jika dua substituen itu mengarahkan suatu gugus masuk ke satu posisi, maka posisi ini akan merupakan posisi utama (dari) substitusi ketiga. 2. Jika dua gugus bertentangan dalam efek-efek pengarahan mereka, maka aktivator yang lebih kuat akan lebih diturut pengarahannya. 3. Jika dua gugus deaktivasi berada pada cincin, terlepas dari di mana posisi mereka, dapat menyukarkan substitusi ketiga. 4. Jika dua gugus pada cincin berposisi-meta satu sama lain, biasanya cincin itu tidak menjalani substitusi pada posisi yang mereka apit, meskipun mungkin cincin itu teraktifkan (pada posisi itu). Tidak reakstifnya posisi ini agaknya disebabkan oleh rintangan sterik.
- 53. Polimer adalah molekul raksasa atau makromolekul yang disusun dari monomer-monomer melalui peristiwa polimerisasi. Macam-macam polimer Berdasarkan asalnya - Polimer alam, contohnya karbohidrat, protein, lemak - Polimer buatan , contohnya plastik, dakron, teflon Berdasarkan monomer-monomer - Homopolimer / sejenis - Kopolimer / berlainan jenis Berdasarkan sifat terhadap panas - Termoplas - Termoset Berdasarkan reaksi pembentukan - Adisi - Kondensasi Polimer
- 54. â Biomolekul yang paling banyak ditemukan di alam â Dari namanya ï molekul yang terdiri dari carbon (C) dan hydrate (air ï H2O) â Mempunyai rumus molekul (CH2O)n untuk monosakarida â Disintesis dari CO2 dan H2O dlm proses fotosintesis â Dikenal juga sebagai sakarida Karbohidrat
- 55. Berdasar kompleksitasnya, dapat dibagi menjadi 3 golongan - Monosakarida ï karbohidrat tunggal Contoh : glukosa, fruktosa, galaktosa - Oligosakarida ï karbohidrat yang tersusun dari 2 sampai 10 monosakarida Contoh : maltosa, sukrosa, laktosa - Polisakarida ï karbohidrat yang tersusun dari lebih dari 10 monosakarida Contoh : amilum, glikogen, selulosa
- 56. Monosakarida Berdasarkan jenis gugus fungsinya dibedakan menjadi aldosa dan ketosa. Aldosa â gugus fungsi aldehid Ketosa â gugus fungsi keton Berdasar jumlah karbon penyusunnya
- 59. Oligosakarida - Maltosa Hidrolisis maltosa menghasilkan 2 molekul glukosa. Bereaksi positif terhadap pereaksi fehling, benedict, dan tollens. - Laktosa Hidrolisis laktosa menghasilkan molekul glukosa dan galaktosa. Hanya terdapat pada binatang mamalia dan manusia. Bereaksi positif terhadap pereaksi fehling, benedict, dan tollens. - Sukrosa Hidrolisis sukrosa menghasilkan molekul glukosa dan fruktosa. Bereaksi negatif terhadap pereaksi fehling, benedict, dan tollens.
- 60. Polisakarida - Amilum Amilum terhidrolisis pada suhu tinggi menghasilkan molekul-molekul glukosa. Penambahan iodium ke dalam amilum akan memberikan warna biru. - Selulosa Selulosa merupakan unsur utama pembentuk serat kayu. Selulosa selalu bergabung dengan polisakarida lain seperti lignin, pektin, hemiselulosa, dan xilan. Selulosa sukar mengalami hidrolisis. - Glikogen Dikenal sebagai gula darah dan terdapat pada otot dan hati sebagai cadangan energi.
- 61. Asam amino Asam amino merupakan senyawa karboksilat yang mempunyai gugus amina pada rantai karbonnya. Penggolongan asam amino berdasarkan nilai nutrisi - Esensial, tidak dapat disintesis dalam tubuh manusia - Non esensial, dapat disintesis dalam tubuh manusia Sifat-sifat asam amino - Dapat membentuk ion zwitter - Bersifat amfoter - Dapat bergabung dengan asam amino lain membentuk polimer Asam amino dan protein
- 62. Semua asam amino termasuk senyawa optis aktif kecuali glisin.
- 63. Protein konjugasi - Nukleoprotein, protein yang terikat dengan asam nukleat. Terdapat pada inti sel dan biji-bijian - Glikoprotein, terikat dengan karbohidrat. Terdapat pada hati dan tendon - Fosfoprotein, terikat dengan fosfat. Terdapat pada susu dan kuning telur - Lipoprotein, terikat dengan lipid/lemak. Terdapat pada serum darah, kuning telur, susu - Kromoprotein/ metaloprotein, terikat dengan ion logam misalnya hemoglobin
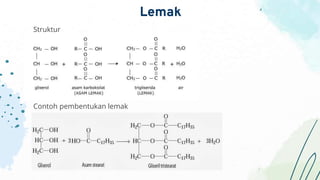
- 66. Penggolongan lemak Berdasarkan panjang rantai karbon - Lemak rantai pendek, jika asam lemaknya mempunyai atom karbon antara 2 sampai 6 - Lemak rantai sedang, jika atom karbonnya antara 8 sampai 12 - Lemak rantai panjang, jika atom karbonnya lebih dari 14 Berdasarkan jenis ikatan - Lemak jenuh - Lemak tidak jenuh