о─о┤н╡ 2-о┘н╢о│н©нЁн©н╫н╠н╫н╦о│н╠н╨н╣о┌
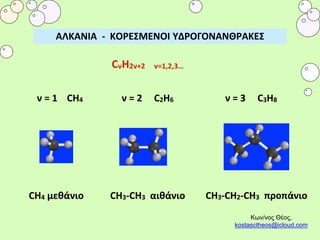
- 1. н▒н⌡н н▒н²н≥н▒ - н н÷н║н∙нён°н∙н²н÷н≥ н╔н■н║н÷н⌠н÷н²н▒н²н≤н║н▒н н∙нё CH4 н╪н╣н╦н╛н╫н╧н© CH3-CH3 н╠н╧н╦н╛н╫н╧н© CH3-Cн≈2-CH3 о─о│н©о─н╛н╫н╧н© н╫ = 1 CH4 н╫ = 3 C3H8н╫ = 2 C2H6 н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com CvH2v+2 v=1,2,3Б─╕
- 2. CH3CH2CH2CH3 н╡н©о┘о└н╛н╫н╧н© н╫ = 4 C4H10 CH3CHCH3 н╪н╜н╦о┘н╩н©-о─о│н©о─н╛н╫н╧н© | Cн≈3 н╓н© н╡н©о┘о└н╛н╫н╧н© н╨н╠н╧ о└н© н╪н╜н╦о┘н╩н©-о─о│н©о─н╛н╫н╧н© н╜о┤н©о┘н╫ н╞н╢н╧н© н╪н©о│н╧н╠н╨о▄ о└о█о─н© н╨н╠н╧ н╢н╧н╠о├н©о│н╣о└н╧н╨о▄ о┐о┘н╫о└н╠н╨о└н╧н╨о▄, н╛о│н╠ н╣н╪о├н╠н╫н╞н╤н©о┘н╫ н╧о┐н©н╪н╜о│н╣н╧н╠. н÷н╧ о┐о┘н╫о└н╠н╨о└н╧н╨н©н╞ о└о█о─н©н╧ н╢н╧н╠о├н╜о│н©о┘н╫ о┐о└н╥ н╪н©о│о├н╝ о└н╥о┌ н╠н╫н╦о│н╠н╨н╧н╨н╝о┌ н╠н╩о┘о┐н╞н╢н╠о┌, н╨н╠н╧ н╥ н╧о┐н©н╪н╜о│н╣н╧н╠ н╩н╜нЁн╣о└н╠н╧ н╧о┐н©н╪н╜о│н╣н╧н╠ н╠н╩о┘о┐н╞н╢н╠о┌. н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 3. н▒о│н╧н╦н╪о▄о┌ о┐о┘н╫о└н╠н╨о└н╧н╨н╛ н╧о┐н©н╪н╣о│о▌н╫ н╠н╩н╨н╠н╫н╞о┴н╫ н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 4. н╖н╥н╪н╧н╨н╜о┌ н╧н╢н╧о▄о└н╥о└н╣о┌ о└о┴н╫ н╠н╩н╨н╠н╫н╞о┴н╫ 1. н н╠о█о┐н╥ CvH2V+2 + O2 Б├▓ CO2 + H2Ov v+1 3v+1 2 CH4 + O2 Б├▓ CO2 + H2O C4H10 + O2 Б├▓ CO2 + H2O н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 5. 2. н═о┘о│о▄н╩о┘о┐н╥ н≈ о─о┘о│о▄н╩о┘о┐н╥ н╣н╞н╫н╠н╧ н╪н╧н╠ н╦н╣о│н╪н╧н╨н╝ н╢н╧н╠н╢н╧н╨н╠о┐н╞н╠ н╪н╣ о└н╥н╫ н©о─н©н╞н╠ н╠н╩н╨н╛н╫н╧н╠ о─н©о┘ н╜о┤н©о┘н╫ н╪н╣нЁн╛н╩н© н╪н©о│н╧н╠н╨о▄ н╡н╛о│н©о┘о┌ н╪н╣о└н╠о└о│н╜о─н©н╫о└н╠н╧ о┐н╣ н╪н╞нЁн╪н╠о└н╠ н╨н©о│н╣о┐н╪н╜н╫о┴н╫ н╨н╠н╧ н╠н╨о▄о│н╣о┐о└о┴н╫ о┘н╢о│н©нЁн©н╫н╠н╫н╦о│н╛н╨о┴н╫ н╪н╧н╨о│о▄о└н╣о│н©о┘ н╪н©о│н╧н╠н╨н©о█ н╡н╛о│н©о┘о┌. н∙о─н╞о┐н╥о┌ о─н╠о│н╛нЁн©н╫о└н╠н╧ о┘н╢о│н©нЁо▄н╫н© н╨н╠н╧ н╧о┐н©н╪н╣о│н╝ н╠н╩н╨н╛н╫н╧н╠. н⌠н╞н╫н╣о└н╠н╧ н╠о─н©о┘о┐н╞н╠ н╠н╜о│н╠, о─н╠о│н©о┘о┐н╞н╠ н╨н╠о└н╠н╩о┘о└о▌н╫ о┐н╣ о┘о┬н╥н╩н╜о┌ н╦н╣о│н╪н©н╨о│н╠о┐н╞н╣о┌ 400 - 500 б╟C н┬о└о┐н╧ о─н╠о│н╛нЁн╣о└н╠н╧ н╡н╣н╫н╤н╞н╫н╥ н╠о─о▄ н╡н╠о│н╧н╛ н╨н╩н╛о┐н╪н╠о└н╠ о└н©о┘ о─н╣о└о│н╜н╩н╠н╧н©о┘ о─н©о┘ н╢н╣н╫ н╣н╞н╫н╠н╧ о└о▄о┐н© о┤о│н╝о┐н╧н╪н╠ н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 6. 3. н▒н╩н©нЁо▄н╫о┴о┐н╥ н╓н╠ н╠н╩н╨н╛н╫н╧н╠ н╠н╫о└н╧н╢о│н©о█н╫ н╨о┘о│н╞о┴о┌ н╪н╣ Cl2 н╝ Br2 о┐н╣ н╢н╧н╛о┤о┘о└н© о├о┴о┌ н╨н╠н╧ н╠н╫о└н╧н╨н╠н╦н╞о┐о└н╠н╫о└н╠н╧ о┐о└н╠н╢н╧н╠н╨н╛ о▄н╩н╠ о└н╠ о┘н╢о│н©нЁо▄н╫н╠ о└н©о┘о┌ н╠о─о▄ Cl н╝ н▓r н⌠н╧н╠ о─н╠о│н╛н╢н╣н╧нЁн╪н╠ о└н© н╠н╧н╦н╛н╫н╧н© о┐н╣ о─о│о▌о└н╥ о├н╛о┐н╥ н╪н╣о└н╠о└о│н╜о─н╣о└н╠н╧ о┐н╣ о┤н╩о┴о│н©н╠н╧н╦н╛н╫н╧н© + Cl2C CH H H H H H C CH Cl H H H H + HCl н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 7. CH4 + Cl2 Б├▓ н▒о─о▄ о└н© н╪н╣н╦н╛н╫н╧н© о─н╠о│н╛нЁн©н╫о└н╠н╧ о└н╜о┐о┐н╣о│н╠ о┤н╩о┴о│н©о─н╠о│н╛нЁо┴нЁн╠ CH3Cl + HCl о┤н╩о┴о│н©н╪н╣н╦н╛н╫н╧н© CH3Cl + Cl2 Б├▓ CH2Cl2 + HCl н╢н╧о┤н╩о┴о│н©н╪н╣н╦н╛н╫н╧н© CH2Cl2 + Cl2 Б├▓ CHCl3 + HCl о└о│н╧о┤н╩о┴о│н©н╪н╣н╦н╛н╫н╧н© н╝ о┤н╩о┴о│н©о├о▄о│н╪н╧н© CHCl3 + Cl2 Б├▓ CCl4 + HCl о└н╣о└о│н╠о┤н╩о┴о│н©н╪н╣н╦н╛н╫н╧н© н╝ о└н╣о└о│н╠о┤н╩о┴о│н╛н╫н╦о│н╠н╨н╠о┌ н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 8. CH2=Cн≈2 н╠н╧н╦н╜н╫н╧н© CH3-Cн≈=CH2 о─о│н©о─н╜н╫н╧н© н╫ = 2 C2H4 н╫ = 3 C3H6 н╫ = 4 C4H8 1-н╡н©о┘о└н╜н╫н╧н© 2-н╡н©о┘о└н╜н╫н╧н© 2-н╡н©о┘о└н╜н╫н╧н© н╪н╜н╦о┘н╩н©-о─о│н©о─н╜н╫н╧н© н▒н⌡н н∙н²н≥н▒ - н▒н н÷н║н∙нён╓н÷н≥ н╔н■н║/н н∙нё н°н∙ 1 н■н≥н═н⌡н÷ н■н∙нён°н÷ н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com CvH2v v=2,3Б─╕
- 9. н╖н╥н╪н╧н╨н╜о┌ н╧н╢н╧о▄о└н╥о└н╣о┌ о└о┴н╫ н╠н╩н╨н╣н╫н╞о┴н╫ 1. н н╠о█о┐н╥ CvH2V + O2 Б├▓ CO2 + H2Ov v3v 2 C2H4 + O2 Б├▓ CO2 + H2O C3H6 + O2 Б├▓ CO2 + H2O н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 10. 2. н▒н╫о▄о│н╦о┴о┐н╥ о└н©о┘ н╢н╧о─н╩н©о█ н╢н╣о┐н╪н©о█ (н╠н╫о└н╧н╢о│н╛о┐н╣н╧о┌ о─о│н©о┐н╦н╝н╨н╥о┌) н╓н╠ н╠н╩н╨н╜н╫н╧н╠ н╠н╫о└н╧н╢о│н©о█н╫ н╪н╣ н≈2, Br2, HX (X=Cl, Br, I), H2O н╨н╠н╧ н© н╢н╧о─н╩о▄о┌ н╢н╣о┐н╪о▄о┌ нЁн╞н╫н╣о└н╠н╧ н╠о─н╩о▄о┌ CH3-CH=CH2 + H-H Б├▓ CH3-CH2-CH3 CH3-CH=CH2 + Br-Br Б├▓ CH3-CHBr-CH2Br Ni CCl4 н╓o н╢н╧н╛н╩о┘н╪н╠ Br2/CCl4 н╣н╞н╫н╠н╧ н╨о▄н╨н╨н╧н╫н©. н╓н© о─о│н©о┼о▄н╫ о└н╥о┌ н╠н╫о└н╞н╢о│н╠о┐н╥о┌ н╣н╞н╫н╠н╧ н╛о┤о│о┴н╪н© н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 11. CH3-CH=CH2 + H-н▓r Б├▓ CH3-CH-CH3 | Br CH3-CH=CH2 + н≈-н÷н≈ Б├▓ о└н© о┘н╢о│н©нЁо▄н╫н© Б─°о─о│н©о└н╧н╪н╛Б─² н╫н╠ о┐о┘н╫н╢н╣н╦н╣н╞ н╪н╣ о└н©н╫ н╛н╫н╦о│н╠н╨н╠ о─н©о┘ н╜о┤н╣н╧ о─н╣о│н╧о┐о┐о▄о└н╣о│н╠ о┘н╢о│н©нЁо▄н╫н╠ н н╠н╫о▄н╫н╠о┌ о└н©о┘ н°н╠о│н╨н©н╫н╧н╨о┴о├ н╨о█о│н╧н© о─о│н©о┼о▄н╫ CH3-CH-CH3 | н÷н≈ н╨о█о│н╧н© о─о│н©о┼о▄н╫ н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 12. 3. н═н©н╩о┘н╪н╣о│н╧о┐н╪о▄о┌ н═н©н╩н╩н╛ н╪о▄о│н╧н╠ о└н©о┘ н╞н╢н╧н©о┘ н╠н╩н╨н╠н╫н╞н©о┘ (о└н╠ н╩н╜н╪н╣ н╪н©н╫н©н╪н╣о│н╝) н╣н╫о▌н╫н©н╫о└н╠н╧ о┐н╣ н╨н╠о└н╛н╩н╩н╥н╩н╣о┌ о┐о┘н╫н╦н╝н╨н╣о┌ о─н╞н╣о┐н╥о┌ - н╦н╣о│н╪н©н╨о│н╠о┐н╞н╠о┌ н╨н╠н╧ о┐о┤н╥н╪н╠о└н╞н╤н©о┘н╫ н╜н╫н╠ н╪н╣нЁн╠н╩н©н╪о▄о│н╧н© о└н© о─н©н╩о┘н╪н╣о│н╜о┌ о─н©о┘ н╜о┤н╣н╧ о─н©н╩н╩н╠о─н╩н╛о┐н╧н© н╪н©о│н╧н╠н╨о▄ н╡н╛о│н©о┌ v CH=CH2 | Б├▓ A (-CH-CH2-)v | A н╪н©н╫н©н╪н╣о│н╜о┌ о─н©н╩о┘н╪н╣о│н╜о┌ н╪н╣ о└н© нЁо│н╛н╪н╪н╠ н▒- о┐о┘н╪н╡н©н╩н╞н╤н©о┘н╪н╣ н╜н╫н╠ н╠о─о▄ о└н╠ о─н╠о│н╠н╨н╛о└о┴ н≈-, Cl-, CH3-, C6H5- н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 13. CHБ┴║Cн≈ н╠н╧н╦н╞н╫н╧н© CH3-CБ┴║CH о─о│н©о─н╞н╫н╧н© н╫ = 2 C2H2 н╫ = 3 C3H6 н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com н▒н⌡н н≥н²н≥н▒ - н▒н н÷н║н∙нён╓н÷н≥ н╔н■н║/н н∙нё н°н∙ 1 н╓н║н≥н═н⌡н÷ н■н∙нён°н÷ CvH2v-2 v=2,3Б─╕
- 14. н╖н╥н╪н╧н╨н╜о┌ н╧н╢н╧о▄о└н╥о└н╣о┌ о└о┴н╫ н╠н╩н╨н╧н╫н╞о┴н╫ 1. н н╠о█о┐н╥ CvH2V-2 + O2 Б├▓ CO2 + H2Ov v-13v-1 2 C2H2 + O2 Б├▓ CO2 + H2O C3H4 + O2 Б├▓ CO2 + H2O н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 15. 2. н▒н╫о▄о│н╦о┴о┐н╥ о└н©о┘ о└о│н╧о─н╩н©о█ н╢н╣о┐н╪н©о█ (н╠н╫о└н╧н╢о│н╛о┐н╣н╧о┌ о─о│н©о┐н╦н╝н╨н╥о┌) н╓н╠ н╠н╩н╨н╞н╫н╧н╠ н╠н╫о└н╧н╢о│н©о█н╫ н╪н╣ н≈2, Br2, HX (X=Cl, Br, I), H2O н╨н╠н╧ н© о└о│н╧о─н╩о▄о┌ н╢н╣о┐н╪о▄о┌ н╪н╣о└н╠о└о│н╜о─н╣о└н╠н╧ н╠о│о┤н╧н╨н╛ о┐н╣ н╢н╧о─н╩о▄ н╨н╠н╧ н╪н╣о└н╛ о┐н╣ н╠о─н╩о▄ CH3-CБ┴║CH + H-H Б├▓ CH3-CH=CH2 CH3-CBr=CHBr Ni CCl4 Б├▓ +H2 CH3-CH2-CH3 CH3-CБ┴║CH + н▓r-Br Б├▓ +Br2 Б├▓ CH3-CBr2-CHBr2 CH3-CBr=CH2CH3-CБ┴║CH + H-Br Б├▓ +HBr Б├▓ CH3-CBr2-CH3 н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 16. Cн≈Б┴║CH + H-OH Б├▓ CH2=CH-н÷н≈ н╠о┐о└н╠н╦н╝о┌ CH3-C=CH2 I OH н╠о┐о└н╠н╦н╝о┌ н≈g, HgSO4 H2SO4 Б├▓ CH3-CH=н÷ CH3-CБ┴║CH + н≈-н÷н≈ Б├▓ Б├▓ н°н╣ о└н© н╫н╣о│о▄ о─н╠о│н©о┘о┐н╞н╠ Hg, HgSO4, H2SO4 о└н╠ н╠н╩н╨н╞н╫н╧н╠ о┐о┤н╥н╪н╠о└н╞н╤н©о┘н╫ н╠о│о┤н╧н╨н╛ н╠о┐о└н╠н╦н╣н╞о┌ н╣н╫о▌о┐н╣н╧о┌ (о└н╧о┌ н╣н╫о▄н╩н╣о┌) н╨н╠н╧ о┐о└н╥ о┐о┘н╫н╜о┤н╣н╧н╠ н╨н╠о│н╡н©н╫н╧н╨н╜о┌ н╣н╫о▌о┐н╣н╧о┌. н╓н© н╠н╧н╦н╞н╫н╧н© о┐о┤н╥н╪н╠о└н╞н╤н╣н╧ о└н╥н╫ н╠н╧н╦н╠н╫н╛н╩н╥ н╨н╠н╧ о▄н╩н╠ о└н╠ о┘о─о▄н╩н©н╧о─н╠ н╨н╣о└о▄н╫н╣о┌ н≈g, HgSO4 H2SO4 CH3-C-CH3|| O н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com
- 17. 3. н╔о─н©н╨н╠о└н╛о┐о└н╠о┐н╥ н╓н╠ н╠н╩н╨н╞н╫н╧н╠ о─н©о┘ н╜о┤н©о┘н╫ о└н©н╫ о└о│н╧о─н╩о▄ н╢н╣о┐н╪о▄ о┐о└н╥н╫ н╛н╨о│н╥ (1-н╠н╩н╨н╞н╫н╧н╠) н╠н╫о└н╧н╢о│н©о█н╫ н╪н╣ Na н╝ K н╨н╠н╧ о└н© о┘н╢о│н©нЁо▄н╫н© о┘о─н©н╨н╠н╦н╞о┐о└н╠о└н╠н╧ н╠о─о▄ о└н╠ н╪н╜о└н╠н╩н╩н╠ (о└н© о┘н╢о│н©нЁо▄н╫н© о┤н╠о│н╠н╨о└н╥о│н╞н╤н╣о└н╠н╧ о┴о┌ о▄н╬н╧н╫н©) CH3-CБ┴║CH + н²a Б├▓ CH3-CБ┴║CNa + 1/2 H2Б├▒ н╓н© н╠н╧н╦н╞н╫н╧н© н╜о┤н╣н╧ н╢о█н© о▄н╬н╧н╫н╠ о┘н╢о│н©нЁо▄н╫н╠ CHБ┴║CH + н²a Б├▓ CHБ┴║CNa + H2Б├▒ н о┴н╫/н╫н©о┌ н≤н╜н©о┌, kostasctheos@icloud.com CHБ┴║CH + 2 н²a Б├▓ н²aCБ┴║CNa + H2Б├▒