3. –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л (sivolgin.com). v1
0 likes771 views
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л, –≤–Ї–ї—О—З–∞—П –Є–Ј–Њ–±–∞—А–љ—Л–µ, –Є–Ј–Њ—Е–Њ—А–љ—Л–µ –Є –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л, –Њ—Б–љ–Њ–≤—Л–≤–∞—П—Б—М –љ–∞ —Г—А–∞–≤–љ–µ–љ–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П –Љ–∞–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –і–∞–≤–ї–µ–љ–Є–µ, –Њ–±—К–µ–Љ, —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –Є –Љ–Њ–ї—П—А–љ–∞—П –Љ–∞—Б—Б–∞, –≤ –Ї–Њ–љ—В–µ–Ї—Б—В–µ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –Я—А–Є–≤–Њ–і—П—В—Б—П –≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Є –Њ–±—К—П—Б–љ–µ–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤–Њ –≤—А–µ–Љ—П —Н—В–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.
1 of 15
Download to read offline









Ad
Recommended
2. –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ (sivolgin.com). v1
2. –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ (sivolgin.com). v1Victor Sivolgin
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —Г—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞, –Є–Ј–≤–µ—Б—В–љ–Њ–µ –Ї–∞–Ї —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞, –Є –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є–љ—Ж–Є–њ—Л –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ–Њ—А–Є–Є (–Ь–Ъ–Ґ). –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –њ–∞—А–∞–Љ–µ—В—А—Л, –≤–ї–Є—П—О—Й–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –≥–∞–Ј–∞, —В–∞–Ї–Є–µ –Ї–∞–Ї –і–∞–≤–ї–µ–љ–Є–µ, –Њ–±—К–µ–Љ, —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –Є –Љ–Њ–ї—П—А–љ–∞—П –Љ–∞—Б—Б–∞, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–Њ–і—П—В—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Љ–µ—А—Л –≤—Л—З–Є—Б–ї–µ–љ–Є–є. –Ґ–∞–Ї–ґ–µ –њ—А–µ–і–Њ—Б—В–∞–≤–ї–µ–љ–∞ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П –Њ —Б–Њ—Б—В–∞–≤–µ –Є –њ–ї–Њ—В–љ–Њ—Б—В–Є –≥–∞–Ј–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Њ –њ—А–µ–њ–Њ–і–∞–≤–∞—В–µ–ї–µ, –Ї–Њ—В–Њ—А—Л–є –Њ–±—Г—З–∞–µ—В —Д–Є–Ј–Є–Ї–µ –Є –Є–Љ–µ–µ—В –љ–∞—Г—З–љ—Л–µ –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є.1. –Ю—Б–љ–Њ–≤–љ–Њ–µ –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ (sivolgin.com). v1
1. –Ю—Б–љ–Њ–≤–љ–Њ–µ –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ (sivolgin.com). v1Victor Sivolgin
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–±—Б—Г–ґ–і–∞–µ—В –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї—Г—О —В–µ–Њ—А–Є—О (–Ь–Ъ–Ґ), –Њ–њ–Є—Б—Л–≤–∞—П –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є–љ—Ж–Є–њ—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –і–≤–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Є—Ж, –Є–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Є –Љ–Њ–ї—П—А–љ—Л–µ –µ–і–Є–љ–Є—Ж—Л –Є–Ј–Љ–µ—А–µ–љ–Є—П. –£–њ–Њ–Љ–Є–љ–∞—О—В—Б—П –Ї–ї—О—З–µ–≤—Л–µ —Г—А–∞–≤–љ–µ–љ–Є—П, –≤–Ї–ї—О—З–∞—П —Г—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞ –Є —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —В–µ–Љ–њ–µ—А–∞—В—Г—А–Њ–є –Є –і–∞–≤–ї–µ–љ–Є–µ–Љ –≥–∞–Ј–∞. –Ґ–∞–Ї–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Љ–Њ–ї—П –Є –Љ–Њ–ї—П—А–љ–Њ–є –Љ–∞—Б—Б—Л, –∞ —В–∞–Ї–ґ–µ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–ї—П –≤—Л—З–Є—Б–ї–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≥–∞–Ј–Њ–≤.–Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П —Д–Є–Ј–Є–Ї–∞ –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞. –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞
–Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П —Д–Є–Ј–Є–Ї–∞ –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞. –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞Victor Sivolgin
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —Г—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞, —Б–≤—П–Ј—Л–≤–∞—О—Й–µ–µ –і–∞–≤–ї–µ–љ–Є–µ, –Њ–±—К–µ–Љ, —В–µ–Љ–њ–µ—А–∞—В—Г—А—Г, –Љ–∞—Б—Б—Г –Є –Љ–Њ–ї—П—А–љ—Г—О –Љ–∞—Б—Б—Г –≥–∞–Ј–∞. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л –≥–∞–Ј–∞ –Є –Љ–Є–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Є –µ–≥–Њ —Б–≤—П–Ј—М —Б –Љ–Њ–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є. –Ґ–∞–Ї–ґ–µ —Г–њ–Њ–Љ–Є–љ–∞–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Г—А–∞–≤–љ–µ–љ–Є—П –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –≤ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–µ.–ї–µ–Ї—Ж–Є—П6
–ї–µ–Ї—Ж–Є—П6afersh
ћэ
–Ы–µ–Ї—Ж–Є—П —А–∞—Б–Ї—А—Л–≤–∞–µ—В —Д–Є–Ј–Є—З–µ—Б–Ї–Є–є —Б–Љ—Л—Б–ї —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Ї–∞–Ї —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–≤–љ–Њ–≤–µ—Б–Є—П –Љ–∞–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е —Б–Є—Б—В–µ–Љ –Є –µ–µ —Б–≤—П–Ј—М —Б —Б—А–µ–і–љ–µ–є –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —Н–љ–µ—А–≥–Є–µ–є —З–∞—Б—В–Є—Ж. –Ґ–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —З–µ—А–µ–Ј —В–µ–њ–ї–Њ–њ–µ—А–µ–і–∞—З—Г –Є —П–≤–ї—П–µ—В—Б—П –∞–±—Б–Њ–ї—О—В–љ–Њ–є –≤–µ–ї–Є—З–Є–љ–Њ–є, –Є–Ј–Љ–µ—А—П–µ–Љ–Њ–є —З–µ—А–µ–Ј —В–µ—А–Љ–Њ–Љ–µ—В—А—Л. –Ґ–∞–Ї–ґ–µ –Њ—Б–≤–µ—Й–∞—О—В—Б—П —И–Ї–∞–ї—Л –Є–Ј–Љ–µ—А–µ–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —И–Ї–∞–ї–∞ –Ъ–µ–ї—М–≤–Є–љ–∞ –Є –¶–µ–ї—М—Б–Є—П, –∞ —В–∞–Ї–ґ–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Ї–Њ–љ–≤–µ—А—В–Є—А–Њ–≤–∞–љ–Є—П –Љ–µ–ґ–і—Г –љ–Є–Љ–Є.–Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П —Д–Є–Ј–Є–Ї–∞ –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞. –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Є –Є–Ј–Њ–њ—А–Њ...
–Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П —Д–Є–Ј–Є–Ї–∞ –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞. –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Є –Є–Ј–Њ–њ—А–Њ...Victor Sivolgin
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ—Е–≤–∞—В—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤—Л –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Д–Є–Ј–Є–Ї–Є –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –≤–Ї–ї—О—З–∞—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–µ—Й–µ—Б—В–≤–∞, –Љ–Њ–ї—М –Є –Љ–Њ–ї—П—А–љ—Г—О –Љ–∞—Б—Б—Г, –∞ —В–∞–Ї–ґ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞. –Ю–љ –Њ–±—К—П—Б–љ—П–µ—В —А–∞–Ј–ї–Є—З–љ—Л–µ –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л (–Є–Ј–Њ–±–∞—А–∞, –Є–Ј–Њ—Е–Њ—А–∞, –Є–Ј–Њ—В–µ—А–Љ–∞) –Є –Є—Е –≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ, —Б–≤—П–Ј—Л–≤–∞—П –Љ–Є–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А—Л –Є –Љ–∞–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А—Л. –Я—А–µ–Ј–µ–љ—В–∞—Ж–Є—П —Б–Њ–і–µ—А–ґ–Є—В –њ—А–Є–Љ–µ—А—Л –≤—Л—З–Є—Б–ї–µ–љ–Є–є –Є –Є–ї–ї—О—Б—В—А–∞—Ж–Є–Є, –њ–Њ–Љ–Њ–≥–∞—О—Й–Є–µ –њ–Њ–љ—П—В—М —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–љ—Ж–Є–њ—Л.—В–µ–Љ–њ–µ—А–∞—В—Г—А–∞
—В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ Maria-96
ћэ
–Ґ–µ–Љ–њ–µ—А–∞—В—Г—А–∞ вАУ —Н—В–Њ —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –≤–µ–ї–Є—З–Є–љ–∞, –Њ–њ—А–µ–і–µ–ї—П—О—Й–∞—П —Б—А–µ–і–љ—О—О –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї—Г—О —Н–љ–µ—А–≥–Є—О —З–∞—Б—В–Є—Ж –≤ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–Љ —А–∞–≤–љ–Њ–≤–µ—Б–Є–Є, –Є –Є–Ј–Љ–µ—А—П–µ—В—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О —А–∞–Ј–ї–Є—З–љ—Л—Е —В–µ—А–Љ–Њ–Љ–µ—В—А–Њ–≤. –Ш—Б—В–Њ—А–Є—П —В–µ—А–Љ–Њ–Љ–µ—В—А—Л –≤–Њ—Б—Е–Њ–і–Є—В –Ї –У–∞–ї–Є–ї–µ—О –Є –≤–Ї–ї—О—З–∞–µ—В —И–Ї–∞–ї—Л –§–∞—А–µ–љ–≥–µ–є—В–∞ –Є –¶–µ–ї—М—Б–Є—П, –Ї–Њ—В–Њ—А—Л–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ—А–µ–љ–Є–є. –°—Г—Й–µ—Б—В–≤—Г—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ —И–Ї–∞–ї—Л –і–ї—П –Є–Ј–Љ–µ—А–µ–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –≤–Ї–ї—О—З–∞—П –Ъ–µ–ї—М–≤–Є–љ–∞, –¶–µ–ї—М—Б–Є—П –Є –§–∞—А–µ–љ–≥–µ–є—В–∞, –∞ —В–∞–Ї–ґ–µ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –∞–±—Б–Њ–ї—О—В–љ–Њ–≥–Њ –љ—Г–ї—П –Ї–∞–Ї –њ—А–µ–і–µ–ї—М–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л.–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л
–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Лqwertymasha
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Є –Є—Е –Љ–∞–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–µ –Є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л, –≤–Ї–ї—О—З–∞—П –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л –Є —Г—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞. –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ —В–Є–њ—Л –њ—А–Њ—Ж–µ—Б—Б–Њ–≤: –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є, –Є–Ј–Њ–±–∞—А–љ—Л–є –Є –Є–Ј–Њ—Е–Њ—А–љ—Л–є, –∞ —В–∞–Ї–ґ–µ –Ј–∞–Ї–Њ–љ—Л, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–µ –Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є —Г—З–µ–љ—Л–Љ–Є. –£—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞, –≤–њ–µ—А–≤—Л–µ –Ј–∞–њ–Є—Б–∞–љ–љ–Њ–µ –Ф.–Ш. –Ь–µ–љ–і–µ–ї–µ–µ–≤—Л–Љ, —Б–≤—П–Ј—Л–≤–∞–µ—В —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –і–∞–≤–ї–µ–љ–Є—П –Є –Њ–±—К–µ–Љ –≥–∞–Ј–∞.–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П –Ї —Г—А–Њ–Ї—Г —Б –¶–Ю–† —Д–Є–Ј–Є–Ї–Є 10 –Ї–ї–∞—Б—Б –љ–∞ —В–µ–Љ—Г"–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л"
–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П –Ї —Г—А–Њ–Ї—Г —Б –¶–Ю–† —Д–Є–Ј–Є–Ї–Є 10 –Ї–ї–∞—Б—Б –љ–∞ —В–µ–Љ—Г"–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л"Yulia Zakharova
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–±—Б—Г–ґ–і–∞–µ—В –Њ—Б–љ–Њ–≤–љ—Л–µ –Љ–∞–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А—Л –≥–∞–Ј–∞, —В–∞–Ї–Є–µ –Ї–∞–Ї –і–∞–≤–ї–µ–љ–Є–µ, –Њ–±—К–µ–Љ –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞, –∞ —В–∞–Ї–ґ–µ –Ј–∞–Ї–Њ–љ—Л, –Њ–њ–Є—Б—Л–≤–∞—О—Й–Є–µ –Є—Е –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М. –£–њ–Њ–Љ–Є–љ–∞—О—В—Б—П —Г—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞, –≤–Ї–ї—О—З–∞—П —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–њ–µ–є—А–Њ–љ–∞ –Є –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–ї—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Ґ–∞–Ї–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л –Є –≥—А–∞—Д–Є—З–µ—Б–Ї–∞—П –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ–±—К–µ–Љ–∞ –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –≥–∞–Ј–∞.–Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є
–Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л–µ —А–µ–∞–Ї—Ж–Є–ЄAlex Sarsenova
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —А–µ–∞–Ї—Ж–Є–Є –Њ–Ї–Є—Б–ї–µ–љ–Є—П –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П, –≤–Ї–ї—О—З–∞—П –њ—А–Њ—Ж–µ—Б—Б—Л –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б—В–µ–њ–µ–љ–µ–є –Њ–Ї–Є—Б–ї–µ–љ–Є—П –∞—В–Њ–Љ–Њ–≤. –£–њ–Њ–Љ–Є–љ–∞—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Њ–Ї–Є—Б–ї–Є—В–µ–ї–µ–є –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї–µ–є, –∞ —В–∞–Ї–ґ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Љ–µ—В–Њ–і—Л –∞–љ–∞–ї–Є–Ј–∞ —А–µ–∞–Ї—Ж–Є–є. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Є–њ–Њ–≤ —А–µ–∞–Ї—Ж–Є–є, –≤–Ї–ї—О—З–∞—П –Љ–µ–ґ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Є –≤–љ—Г—В—А–Є–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л.111
111ssusera868ff
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —Б–Њ–і–µ—А–ґ–Є—В –Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ —А–µ—И–µ–љ–Є—О –Ј–∞–і–∞—З, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –≥–∞–Ј–Њ–≤—Л–Љ–Є –Ј–∞–Ї–Њ–љ–∞–Љ–Є, –≤ –Ї–Њ–љ—В–µ–Ї—Б—В–µ —И–Ї–Њ–ї—М–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —Д–Є–Ј–Є–Ї–Є. –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ —Г—А–∞–≤–љ–µ–љ–Є—П, —В–∞–Ї–Є–µ –Ї–∞–Ї —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–њ–µ–є—А–Њ–љ–∞ –Є –Ј–∞–Ї–Њ–љ—Л –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞, –У–µ–є-–Ы—О—Б–∞–Ї–∞ –Є –®–∞—А–ї—П, –∞ —В–∞–Ї–ґ–µ —Н—В–∞–њ—Л —А–µ—И–µ–љ–Є—П –Ј–∞–і–∞—З, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Љ–Њ–≥–∞—О—В —Г—З–∞—Й–Є–Љ—Б—П —Г—Б–≤–Њ–Є—В—М –Њ—Б–љ–Њ–≤–љ—Л–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Ј–∞–Ї–Њ–љ—Л. –Я—А–Є–≤–Њ–і—П—В—Б—П –њ—А–Є–Љ–µ—А—Л –Ј–∞–і–∞—З —Б –њ–Њ—И–∞–≥–Њ–≤—Л–Љ–Є —А–µ—И–µ–љ–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –і–ї—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П.–§–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є
–§–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–ЄS-Petersburg University of Fire State Service
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Є—Б—Б–ї–µ–і—Г–µ—В —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –Њ—Е–≤–∞—В—Л–≤–∞—П –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Г—О —Д–Є–Ј–Є–Ї—Г –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л. –Ю–њ–Є—Б–∞–љ—Л –і–≤–∞ –њ–Њ–і—Е–Њ–і–∞ –Ї –Є–Ј—Г—З–µ–љ–Є—О –Љ–∞–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е —П–≤–ї–µ–љ–Є–є: —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є –Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є. –Ґ–∞–Ї–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —Г—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –і–ї—П –Є–і–µ–∞–ї—М–љ—Л—Е –Є —А–µ–∞–ї—М–љ—Л—Е –≥–∞–Ј–Њ–≤, –≤–Ї–ї—О—З–∞—П —Г—А–∞–≤–љ–µ–љ–Є–µ –Т–∞–љ-–і–µ—А-–Т–∞–∞–ї—М—Б–∞ –Є –≤–ї–Є—П–љ–Є–µ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤–µ—Й–µ—Б—В–≤.35598 f343a7a6acf4b3f5bca04acdc9f002ee
35598 f343a7a6acf4b3f5bca04acdc9f002eerobinbad123100
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б–±–Њ—А–љ–Є–Ї —А–µ—И–µ–љ–Є–є —В–Є–њ–Њ–≤—Л—Е —В–µ—Б—В–Њ–≤—Л—Е –Ј–∞–і–∞–љ–Є–є –њ–Њ —Д–Є–Ј–Є–Ї–µ –і–ї—П –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –Ї –Х–У–≠ 2016 –≥–Њ–і–∞, —Б–Њ–і–µ—А–ґ–∞—Й–Є–є 20 –≤–∞—А–Є–∞–љ—В–Њ–≤ –Ј–∞–і–∞—З —Б –њ–Њ–і—А–Њ–±–љ—Л–Љ–Є —А–µ—И–µ–љ–Є—П–Љ–Є. –†–∞–±–Њ—В–∞ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ –њ—А–µ–њ–Њ–і–∞–≤–∞—В–µ–ї—П–Љ–Є –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ —Н–Ї–Ј–∞–Љ–µ–љ–∞, –≤–Ї–ї—О—З–∞—П –љ–Њ–≤—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П. –Ю—Б–љ–Њ–≤–љ–∞—П —Ж–µ–ї—М —Б–±–Њ—А–љ–Є–Ї–∞ - –њ–Њ–Љ–Њ—З—М —Б—В–∞—А—И–µ–Ї–ї–∞—Б—Б–љ–Є–Ї–∞–Љ –Њ–≤–ї–∞–і–µ—В—М –Љ–µ—В–Њ–і–Є–Ї–∞–Љ–Є —А–µ—И–µ–љ–Є—П –Ј–∞–і–∞—З –≤ —А–∞–Љ–Ї–∞—Е –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–µ –Ї –Х–У–≠.—В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞
—В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞ocsumoron
ћэ
–Ґ–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞ –Є–Ј—Г—З–∞–µ—В –≤–љ—Г—В—А–µ–љ–љ—О—О —Н–љ–µ—А–≥–Є—О, —А–∞–±–Њ—В—Г –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В–µ–њ–ї–Њ—В—Л –≤ —Б–Є—Б—В–µ–Љ–∞—Е. –Я–µ—А–≤—Л–є –Ј–∞–Ї–Њ–љ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Б–≤—П–Ј—Л–≤–∞–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –≤–љ—Г—В—А–µ–љ–љ–µ–є —Н–љ–µ—А–≥–Є–Є —Б —В–µ–њ–ї–Њ—В–Њ–є –Є —А–∞–±–Њ—В–Њ–є –≤–љ–µ—И–љ–Є—Е —Б–Є–ї, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤—В–Њ—А–Њ–є –Ј–∞–Ї–Њ–љ —Г—В–≤–µ—А–ґ–і–∞–µ—В –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–µ—А–µ–і–∞—З–Є —В–µ–њ–ї–∞ –Њ—В —Е–Њ–ї–Њ–і–љ–Њ–≥–Њ —В–µ–ї–∞ –Ї –≥–Њ—А—П—З–µ–Љ—Г. –Ґ–µ–њ–ї–Њ–≤—Л–µ –і–≤–Є–≥–∞—В–µ–ї–Є –Є–ї–ї—О—Б—В—А–Є—А—Г—О—В –њ—А–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –і–≤–Є–ґ—Г—Й–µ–є —Б–Є–ї—Л –≤ —В–µ–њ–ї–Њ –Є –љ–∞–Њ–±–Њ—А–Њ—В.–Ч–∞–і–∞–љ–Є–µ 10
–Ч–∞–і–∞–љ–Є–µ 10–Ь–Є—Е–∞–Є–ї –І–µ—А–∞–Ї—И–µ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –≤–Ї–ї—О—З–∞—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –≤–љ—Г—В—А–µ–љ–љ–µ–є —Н–љ–µ—А–≥–Є–Є, —В–µ–њ–ї–Њ—В –Є —А–∞–±–Њ—В—Г, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–ї–Є—З–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є –Є –Є–Ј–Њ–±–∞—А–љ—Л–є. –Я–Њ–і—А–Њ–±–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Љ–µ—В–Њ–і—Л —А–∞—Б—З–µ—В–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В–µ–њ–ї–Њ—В—Л, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –≤–µ—Й–µ—Б—В–≤–∞, –Є –љ—О–∞–љ—Б—Л —А–∞–±–Њ—В—Л —В–µ–њ–ї–Њ–≤—Л—Е –і–≤–Є–≥–∞—В–µ–ї–µ–є. –Ґ–∞–Ї–ґ–µ –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П –њ–Њ–љ—П—В–Є—П –∞–±—Б–Њ–ї—О—В–љ–Њ–є –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –≤–ї–∞–ґ–љ–Њ—Б—В–Є –≤–Њ–Ј–і—Г—Е–∞.—Д–∞–Ј–Њ–≤—Л–µ –њ–µ—А–µ—Е–Њ–і—Л
—Д–∞–Ј–Њ–≤—Л–µ –њ–µ—А–µ—Е–Њ–і—ЛYerin_Constantine
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤–љ—Л–µ –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є —Д–Є–Ј–Є–Ї–Є, –≤–Ї–ї—О—З–∞—П —Д–∞–Ј–Њ–≤—Л–µ –њ–µ—А–µ—Е–Њ–і—Л –Є —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ –Љ–µ–ґ–і—Г –ґ–Є–і–Ї–Њ—Б—В—М—О –Є –љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ –њ–∞—А–Њ–Љ. –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —Г—А–∞–≤–љ–µ–љ–Є–µ –Ъ–ї–∞–њ–µ–є—А–Њ–љ–∞-–Ъ–ї–∞—Г–Ј–Є—Г—Б–∞ –Є —Д–∞–Ј–Њ–≤—Л–µ –і–Є–∞–≥—А–∞–Љ–Љ—Л, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ—А—Л —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є –Є—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ–ї–∞–≤–ї–µ–љ–Є—П –Є –Ї–Є–њ–µ–љ–Є—П. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П –Њ—В–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –њ–µ—А–≤–Њ–є –Є –≤—В–Њ—А–Њ–є —А–Њ–і–∞–Љ–Є —Д–∞–Ј–Њ–≤—Л—Е –њ–µ—А–µ—Е–Њ–і–Њ–≤ –Є –њ—А–Є–Љ–µ—А—Л –Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –≤–µ—Й–µ—Б—В–≤–∞.–ї–µ–Ї—Ж–Є—П 2 –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–Њ–љ—П—В–Є—П –Є –Ј–∞–Ї–Њ–љ—Л —Е–Є–Љ–Є–Є
–ї–µ–Ї—Ж–Є—П 2 –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–Њ–љ—П—В–Є—П –Є –Ј–∞–Ї–Њ–љ—Л —Е–Є–Љ–Є–Є–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –ї–µ–Ї—Ж–Є—О, –Њ—Е–≤–∞—В—Л–≤–∞—О—Й—Г—О —В–µ–Љ—Л –∞—В–Њ–Љ–љ—Л—Е –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—Б—Б, –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б—Л –Є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Љ–Њ–ї—М. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П –Є–Ј–Њ—В–Њ–њ—Л, —Б—А–µ–і–љ–Є–µ –∞—В–Њ–Љ–љ—Л–µ –Љ–∞—Б—Б—Л, –∞ —В–∞–Ї–ґ–µ –Ј–∞–Ї–Њ–љ —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –Љ–∞—Б—Б—Л –Є —Н–љ–µ—А–≥–Є–Є, —Б—В–µ—Е–Є–Њ–Љ–µ—В—А–Є—П –Є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В—Л –≤–µ—Й–µ—Б—В–≤. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л —А–∞—Б—З–µ—В–Њ–≤, –Є–ї–ї—О—Б—В—А–Є—А—Г—О—Й–Є–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–љ—Ж–µ–њ—Ж–Є–є –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ.–ї–µ–Ї—Ж–Є—П 3 —Н–Ї–≤ –љ—В. –Њ–њ—А–µ–і–µ–ї –Љ(r), a
–ї–µ–Ї—Ж–Є—П 3 —Н–Ї–≤ –љ—В. –Њ–њ—А–µ–і–µ–ї –Љ(r), a–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤–љ—Л–µ –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є —Е–Є–Љ–Є–Є, –≤–Ї–ї—О—З–∞—П —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В—Л —Б–ї–Њ–ґ–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –Ј–∞–Ї–Њ–љ—Л –Ї—А–∞—В–љ—Л—Е –Є –Њ–±—К–µ–Љ–љ—Л—Е –Њ—В–љ–Њ—И–µ–љ–Є–є, –∞ —В–∞–Ї–ґ–µ –Ј–∞–Ї–Њ–љ –Р–≤–Њ–≥–∞–і—А–Њ. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П —В–∞–Ї–Є–µ –њ–Њ–љ—П—В–Є—П, –Ї–∞–Ї —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–∞—П –Љ–∞—Б—Б–∞, –Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –Є –њ–Њ—Б—В–Њ—П–љ—Б—В–≤–Њ —Б–Њ—Б—В–∞–≤–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–µ—В–Њ–і—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –Є –∞—В–Њ–Љ–љ—Л—Е –Љ–∞—Б—Б. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л —А–∞—Б—З–µ—В–Њ–≤ –Є –Њ–±—К—П—Б–љ–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–∞–Ї—Ж–Є—П–Љ–Є –Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –≥–∞–Ј–Њ–≤.–њ–Ј (–ї.5) —Б—В—А–Њ–µ–љ–Є–µ –∞—В–Њ–Љ–∞
–њ–Ј (–ї.5) —Б—В—А–Њ–µ–љ–Є–µ –∞—В–Њ–Љ–∞–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —Б–Њ–і–µ—А–ґ–Є—В –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ–Њ —Б–Њ—Б—В–∞–≤–ї–µ–љ–Є—О —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л—Е –Ї–Њ–љ—Д–Є–≥—Г—А–∞—Ж–Є–є –∞—В–Њ–Љ–Њ–≤ –±–µ–Ј –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —В–∞–±–ї–Є—Ж—Л –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞, –≤–Ї–ї—О—З–∞—П –њ—А–∞–≤–Є–ї–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–µ—А–Є–Њ–і–Њ–≤, –≥—А—Г–њ–њ—Л –Є —В–Є–њ–Њ–≤ —Н–ї–µ–Љ–µ–љ—В–Њ–≤. –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –њ—А–Є–Љ–µ—А—Л —А–µ—И–µ–љ–Є–є, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Б—В—А—Г–Ї—В—Г—А—Л —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤, —Б —А–∞—Б—З–µ—В–∞–Љ–Є –Є –Њ–±—К—П—Б–љ–µ–љ–Є—П–Љ–Є –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤. –Ґ–∞–Ї–ґ–µ –њ—А–µ–і–ї–∞–≥–∞—О—В—Б—П –Ј–∞–і–∞—З–Є –і–ї—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–≥–Њ —А–µ—И–µ–љ–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ –Ј–∞–Ї—А–µ–њ–ї–µ–љ–Є–µ –њ–Њ–љ–Є–Љ–∞–љ–Є—П —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л—Е –Ї–Њ–љ—Д–Є–≥—Г—А–∞—Ж–Є–є –Є –Ї–≤–∞–љ—В–Њ–≤—Л—Е —З–Є—Б–µ–ї.Uravnenie sostoyania idealnogo_gaza
Uravnenie sostoyania idealnogo_gazailina05
ћэ
–£—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞ —Б–≤—П–Ј—Л–≤–∞–µ—В –і–∞–≤–ї–µ–љ–Є–µ, –Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К—С–Љ –Є –∞–±—Б–Њ–ї—О—В–љ—Г—О —В–µ–Љ–њ–µ—А–∞—В—Г—А—Г –≥–∞–Ј–∞ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ–є –≥–∞–Ј–Њ–≤–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є. –Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —А–∞–Ј–ї–Є—З–љ—Л–µ –Ј–∞–Ї–Њ–љ—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –Ј–∞–Ї–Њ–љ –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞ –Є –Ј–∞–Ї–Њ–љ –У–µ–є-–Ы—О—Б—Б–∞–Ї–∞, –∞ —В–∞–Ї–ґ–µ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е –≥–∞–Ј–Њ–≤–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є. –Ґ–∞–Ї–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –≤–ї–Є—П–љ–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –і–∞–≤–ї–µ–љ–Є–є –љ–∞ –њ–Њ–≤–µ–і–µ–љ–Є–µ –≥–∞–Ј–Њ–≤ –Є –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –Њ—В –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П.9-11 –Ї–ї–∞—Б—Б. –Ю—Б–љ–Њ–≤—Л —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є
9-11 –Ї–ї–∞—Б—Б. –Ю—Б–љ–Њ–≤—Л —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Єozlmgouru
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ—Е–≤–∞—В—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤—Л —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –≤–Ї–ї—О—З–∞—П —В–µ–њ–ї–Њ–µ–Љ–Ї–Њ—Б—В—М —Б–Є—Б—В–µ–Љ, —В–µ–њ–ї–Њ–≤—Л–µ —Н—Д—Д–µ–Ї—В—Л —А–µ–∞–Ї—Ж–Є–є –Є –Ј–∞–Ї–Њ–љ –У–µ—Б—Б–∞. –Т –љ–µ–Љ –њ–Њ–і—А–Њ–±–љ–Њ –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П —Н–Ї–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–µ –Є —Н–љ–і–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є, –∞ —В–∞–Ї–ґ–µ —А–∞—Б—З–µ—В—Л —В–µ–њ–ї–Њ–≤—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є —Б—В–µ—Е–Є–Њ–Љ–µ—В—А–Є–Є. –Ш—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –і–ї—П –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –Є –Є—Е —Г—Б–ї–Њ–≤–Є–є —Б–∞–Љ–Њ–њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—В–µ–Ї–∞–љ–Є—П.—Г–і–µ–ї—М–љ–∞—П —В–µ–њ–ї–Њ—В–∞ –њ–ї–∞–≤–ї–µ–љ–Є—П
—Г–і–µ–ї—М–љ–∞—П —В–µ–њ–ї–Њ—В–∞ –њ–ї–∞–≤–ї–µ–љ–Є—ПAdamovaT88
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В —А–∞–Ј–ї–Є—З–Є—П –≤ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –≤–µ—Й–µ—Б—В–≤ –≤ —А–∞–Ј–љ—Л—Е –∞–≥—А–µ–≥–∞—В–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –Є –Њ–њ–Є—Б—Л–≤–∞–µ—В —Б–Ї–Њ—А–Њ—Б—В—М, —А–∞—Б—Б—В–Њ—П–љ–Є–µ –Є –≤–Ј–∞–Є–Љ–љ–Њ–µ –њ—А–Є—В—П–ґ–µ–љ–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї –≤ –≥–∞–Ј–µ, –ґ–Є–і–Ї–Њ—Б—В–Є –Є —В–≤–µ—А–і–Њ–Љ —В–µ–ї–µ. –£–і–µ–ї—П–µ—В—Б—П –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—М–љ–Њ–є —В–µ–њ–ї–Њ—В–µ –њ–ї–∞–≤–ї–µ–љ–Є—П, –Њ–±–Њ–Ј–љ–∞—З–∞–µ–Љ–Њ–є –≥—А–µ—З–µ—Б–Ї–Њ–є –±—Г–Ї–≤–Њ–є ¬Ђ–ї—П–Љ–±–і–∞¬ї, –Є —А–∞—Б—З–µ—В–∞–Љ —Н–љ–µ—А–≥–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–є –і–ї—П –њ–ї–∞–≤–ї–µ–љ–Є—П —Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≤–µ—Й–µ—Б—В–≤–∞. –Ґ–∞–Ї–ґ–µ –њ—А–Є–≤–Њ–і–Є—В—Б—П —Д–Њ—А–Љ—Г–ї–∞ q = ќїm –і–ї—П —А–∞—Б—З–µ—В–∞ —В–µ–њ–ї–Њ—В—Л, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–є –і–ї—П –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П —В–≤–µ—А–і–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≤ –ґ–Є–і–Ї–Њ–µ.–Ш—Б—В–µ—З–µ–љ–Є–µ –≥–∞–Ј–Њ–≤ –Є –ґ–Є–і–Ї–Њ—Б—В–µ–є
–Ш—Б—В–µ—З–µ–љ–Є–µ –≥–∞–Ј–Њ–≤ –Є –ґ–Є–і–Ї–Њ—Б—В–µ–єS-Petersburg University of Fire State Service
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ–Њ—Б–≤—П—Й–µ–љ –Њ—Б–љ–Њ–≤–∞–Љ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—В–Њ—А–Њ–Љ—Г –Ј–∞–Ї–Њ–љ—Г, –Ї–Њ—В–Њ—А—Л–є —Г—В–≤–µ—А–ґ–і–∞–µ—В, —З—В–Њ –≤—Б–µ —А–µ–∞–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –љ–µ–Њ–±—А–∞—В–Є–Љ—Л –Є –њ—А–Є–≤–Њ–і—П—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Н–љ—В—А–Њ–њ–Є–Є. –Ю–њ–Є—Б—Л–≤–∞—О—В—Б—П —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ —Ж–Є–Ї–ї—Л, –≤–Ї–ї—О—З–∞—П —Ж–Є–Ї–ї –Ъ–∞—А–љ–Њ, –Є –µ–≥–Њ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –њ–Њ–ї–µ–Ј–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —В–µ–њ–ї–Њ–≤—Л—Е –Љ–∞—И–Є–љ. –Я–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–ї–љ–Њ–≥–Њ –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П —В–µ–њ–ї–Њ—В—Л –≤ —А–∞–±–Њ—В—Г –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —А–∞–Ј–љ–Њ—Б—В–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А –і–ї—П –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—П —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.Chem kinetics new lecture
Chem kinetics new lectureKonstantin German
ћэ
–Ъ–Є–љ–µ—В–Є–Ї–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –Є—Б—Б–ї–µ–і—Г–µ—В —Б–Ї–Њ—А–Њ—Б—В—М –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–≤—А–∞—Й–µ–љ–Є–є, —З—В–Њ –Є–Љ–µ–µ—В –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –љ–∞—Г—З–љ—Л—Е –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–є, –≤–Ї–ї—О—З–∞—П –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є—О –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ–Њ—Б—В–Є. –°–Ї–Њ—А–Њ—Б—В—М —А–µ–∞–Ї—Ж–Є–Є –Ј–∞–≤–Є—Б–Є—В –Њ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —А–µ–∞–≥–µ–љ—В–Њ–≤, —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Є –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї —З–∞—Б—В–Њ—В–∞ —Б—В–Њ–ї–Ї–љ–Њ–≤–µ–љ–Є–є –Є —Н–љ–µ—А–≥–Є—П –∞–Ї—В–Є–≤–∞—Ж–Є–Є. –Ч–∞–Ї–Њ–љ –і–µ–є—Б—В–≤–Є—П –Љ–∞—Б—Б –Њ–њ—А–µ–і–µ–ї—П–µ—В, —З—В–Њ —Б–Ї–Њ—А–Њ—Б—В—М —А–µ–∞–Ї—Ж–Є–Є –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є —А–µ–∞–≥–Є—А—Г—О—Й–Є—Е –≤–µ—Й–µ—Б—В–≤, –Є –≠–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н–љ–µ—А–≥–Є–Є –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П.–ї–µ–Ї—Ж–Є—П10
–ї–µ–Ї—Ж–Є—П10afersh
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –≤ –≤–Є–і–µ –ї–µ–Ї—Ж–Є–Є –њ–Њ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–Љ—Г —Б–Љ—Л—Б–ї—Г —Н–љ—В–∞–ї—М–њ–Є–Є –Є —Н–љ—В—А–Њ–њ–Є–Є, –≤ –Ї–Њ—В–Њ—А–Њ–є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–µ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–љ—П—В–Є—П, —В–∞–Ї–Є–µ –Ї–∞–Ї —Н–љ—В–∞–ї—М–њ–Є—П –Ї–∞–Ї —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–є —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б–Є—Б—В–µ–Љ—Л, –Є —Н–љ—В—А–Њ–њ–Є—П –Ї–∞–Ї –Љ–µ—А–∞ –љ–µ–Њ–±—А–∞—В–Є–Љ–Њ–≥–Њ —А–∞—Б—Б–µ–Є–≤–∞–љ–Є—П —Н–љ–µ—А–≥–Є–Є. –Т –љ—С–Љ —В–∞–Ї–ґ–µ –њ—А–Є–≤–µ–і–µ–љ—Л —Д–Њ—А–Љ—Г–ї—Л –і–ї—П —А–∞—Б—З–µ—В–∞ —Н–љ—В–∞–ї—М–њ–Є–Є –Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–љ—В—А–Њ–њ–Є–Є –Є–і–µ–∞–ї—М–љ—Л—Е –≥–∞–Ј–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Є—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є–є —Б–Љ—Л—Б–ї –Є –≤–ї–Є—П–љ–Є–µ –љ–∞ –њ—А–Њ—Ж–µ—Б—Б—Л —В–µ–њ–ї–Њ–Њ–±–Љ–µ–љ–∞. –Ю—Б–љ–Њ–≤–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—П–µ—В—Б—П —В–Њ–Љ—Г, –Ї–∞–Ї –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Н–љ—В—А–Њ–њ–Є–Є —Б–≤—П–Ј–∞–љ–Њ —Б –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.–Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –≥–∞–Ј–Њ–≤
–Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –≥–∞–Ј–Њ–≤ulaevanadin123
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В –Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –≥–∞–Ј–Њ–≤, –Њ–њ—А–µ–і–µ–ї—П—П –µ–≥–Њ –Ї–∞–Ї –Њ–±—К–µ–Љ, –Ј–∞–љ–Є–Љ–∞–µ–Љ—Л–є 1 –Љ–Њ–ї—М –≥–∞–Ј–∞ –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, —А–∞–≤–љ—Л–є 22,4 –ї. –Я—А–Є–≤–µ–і–µ–љ—Л —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ —А–∞—Б—З–µ—В—Г —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–Њ—А–Љ—Г–ї –њ–ї–Њ—В–љ–Њ—Б—В–Є –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≤–µ—Й–µ—Б—В–≤–∞, –∞ —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ—А–Є—В–µ–ї—М–љ—Л–Љ –µ–і–Є–љ–Є—Ж–∞–Љ. –Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П, —З—В–Њ –Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –Њ–±–Њ–Ј–љ–∞—З–∞–µ—В—Б—П –Ї–∞–Ї vm –Є –Ј–∞–≤–Є—Б–Є—В –Њ—В –і–∞–≤–ї–µ–љ–Є—П –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л.–ї–µ–Ї. 15 —В–µ–Њ—А–Є—П –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є
–ї–µ–Ї. 15 —В–µ–Њ—А–Є—П –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —А–∞–Ј–ї–Є—З–љ—Л–µ —В–µ–Њ—А–Є–Є –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є, –≤–Ї–ї—О—З–∞—П —В–µ–Њ—А–Є—О –Р—А—А–µ–љ–Є—Г—Б–∞, –њ—А–Њ—В–Њ–љ–љ—Г—О —В–µ–Њ—А–Є—О –С—А–µ–љ—Б—В–µ–і–∞-–Ы–Њ—Г—А–Є –Є —Н–ї–µ–Ї—В—А–Њ–љ–љ—Г—О —В–µ–Њ—А–Є—О –Ы—М—О–Є—Б–∞. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є, –Є—Е –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –≤ –≤–Њ–і–љ—Л—Е —А–∞—Б—В–≤–Њ—А–∞—Е, –∞ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б–Є–ї—Л –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є —З–µ—А–µ–Ј –Ї–Њ–љ—Б—В–∞–љ—В—Л –Є–Њ–љ–Є–Ј–∞—Ж–Є–Є. –Ґ–∞–Ї–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є, –Њ–±—К—П—Б–љ—П—О—Й–Є–µ –≤–ї–Є—П–љ–Є–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –Є —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –∞–љ–Є–Њ–љ–Њ–≤ –љ–∞ –Ї–Є—Б–ї–Њ—В–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –≤–µ—Й–µ—Б—В–≤.–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Ъ–∞–ї–Є–љ–Є—З –Т–ї–∞–і–∞
–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Ъ–∞–ї–Є–љ–Є—З –Т–ї–∞–і–∞Jimmy_ZigZag
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л, –≤–Ї–ї—О—З–∞—П –Є–Ј–Њ–±–∞—А–љ—Л–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є –Є –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б—Л. –≠—В–Є –њ—А–Њ—Ж–µ—Б—Б—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –љ–µ–Є–Ј–Љ–µ–љ–љ—Л–Љ–Є –њ–∞—А–∞–Љ–µ—В—А–∞–Љ–Є —Б–Њ—Б—В–Њ—П–љ–Є—П: –і–∞–≤–ї–µ–љ–Є–µ–Љ, –Њ–±—К–µ–Љ–Њ–Љ –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–Њ–є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Я—А–Є–≤–Њ–і—П—В—Б—П –Ј–∞–Ї–Њ–љ—Л, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–µ –і–∞–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –Ј–∞–Ї–Њ–љ –У–µ–є-–Ы—О—Б—Б–∞–Ї–∞ –Є –Ј–∞–Ї–Њ–љ –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞.–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Ъ–∞–ї–Є–љ–Є—З –Т–ї–∞–і–∞
–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Ъ–∞–ї–Є–љ–Є—З –Т–ї–∞–і–∞Jimmy_ZigZag
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Є–Ј–Њ–±–∞—А–љ—Л–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є –Є –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б—Л, –Ї–∞–ґ–і—Л–є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –њ–Њ—Б—В–Њ—П–љ—Б—В–≤–Њ–Љ –Њ–і–љ–Њ–≥–Њ –Є–Ј –њ–∞—А–∞–Љ–µ—В—А–Њ–≤: –і–∞–≤–ї–µ–љ–Є—П, –Њ–±—К—С–Љ–∞ –Є–ї–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л. –Я—А–Є–≤–µ–і–µ–љ—Л —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Ј–∞–Ї–Њ–љ—Л: –Ј–∞–Ї–Њ–љ –У–µ–є-–Ы—О—Б—Б–∞–Ї–∞ –і–ї—П –Є–Ј–Њ–±–∞—А–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –Ј–∞–Ї–Њ–љ –®–∞—А–ї—П –і–ї—П –Є–Ј–Њ—Е–Њ—А–љ–Њ–≥–Њ –Є –Ј–∞–Ї–Њ–љ –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞ –і–ї—П –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ. –Ґ–∞–Ї–ґ–µ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –Ј–љ–∞—З–µ–љ–Є–µ –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є –Є—Е –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П –љ–∞ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –і–Є–∞–≥—А–∞–Љ–Љ–∞—Е.—Д–Є–Ј–Є–Ї–∞
—Д–Є–Ј–Є–Ї–∞Fizika-234
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Є –Є—Е –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞, –≤–Ї–ї—О—З–∞—П –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л (–Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–µ, –Є–Ј–Њ–±–∞—А–љ—Л–µ –Є –Є–Ј–Њ—Е–Њ—А–љ—Л–µ) –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є —Ж–Є–Ї–ї. –Ю–љ –Њ–±—К—П—Б–љ—П–µ—В, –Ї–∞–Ї –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –њ–∞—А–∞–Љ–µ—В—А—Л –≥–∞–Ј–∞ –Є –Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, –∞ —В–∞–Ї–ґ–µ –Њ–њ–Є—Б—Л–≤–∞–µ—В —Ж–Є–Ї–ї—Л –Ъ–∞—А–љ–Њ –Є —А–∞–±–Њ—В—Г —В–µ–њ–ї–Њ–≤—Л—Е –і–≤–Є–≥–∞—В–µ–ї–µ–є. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–∞–Ј–Њ–≤—Л—Е –Ј–∞–Ї–Њ–љ–Њ–≤ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е.–Я–µ—А–≤–∞—П –њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П
–Я–µ—А–≤–∞—П –њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—ПDimass11
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —В—А–Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞: –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є –Є –Є–Ј–Њ–±–∞—А–љ—Л–є, –њ—А–Є–≤–Њ–і—П –Є—Е —Г—А–∞–≤–љ–µ–љ–Є—П, –Ј–∞–Ї–Њ–љ—Л –Є –Є—Б—В–Њ—А–Є—З–µ—Б–Ї–Є–µ —Б–њ—А–∞–≤–Ї–Є –Њ descubr–µ–љ–Є–Є. –£–Ї–∞–Ј–∞–љ—Л –Ї–ї—О—З–µ–≤—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –њ–Њ—Б—В–Њ—П–љ–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ, –Њ–±—К–µ–Љ –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ґ–∞–Ї–ґ–µ –і–Њ–Ї—Г–Љ–µ–љ—В –≤–Ї–ї—О—З–∞–µ—В –≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ —Н—В–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–µ –Є–Ј–Њ—В–µ—А–Љ–Њ–є, –Є–Ј–Њ—Е–Њ—А–Њ–є –Є –Є–Ј–Њ–±–∞—А–Њ–є.More Related Content
What's hot (18)
–Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є
–Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Л–µ —А–µ–∞–Ї—Ж–Є–ЄAlex Sarsenova
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —А–µ–∞–Ї—Ж–Є–Є –Њ–Ї–Є—Б–ї–µ–љ–Є—П –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П, –≤–Ї–ї—О—З–∞—П –њ—А–Њ—Ж–µ—Б—Б—Л –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б—В–µ–њ–µ–љ–µ–є –Њ–Ї–Є—Б–ї–µ–љ–Є—П –∞—В–Њ–Љ–Њ–≤. –£–њ–Њ–Љ–Є–љ–∞—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Њ–Ї–Є—Б–ї–Є—В–µ–ї–µ–є –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї–µ–є, –∞ —В–∞–Ї–ґ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Љ–µ—В–Њ–і—Л –∞–љ–∞–ї–Є–Ј–∞ —А–µ–∞–Ї—Ж–Є–є. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л —А–∞–Ј–ї–Є—З–љ—Л—Е —В–Є–њ–Њ–≤ —А–µ–∞–Ї—Ж–Є–є, –≤–Ї–ї—О—З–∞—П –Љ–µ–ґ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Є –≤–љ—Г—В—А–Є–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л.111
111ssusera868ff
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —Б–Њ–і–µ—А–ґ–Є—В –Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ —А–µ—И–µ–љ–Є—О –Ј–∞–і–∞—З, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –≥–∞–Ј–Њ–≤—Л–Љ–Є –Ј–∞–Ї–Њ–љ–∞–Љ–Є, –≤ –Ї–Њ–љ—В–µ–Ї—Б—В–µ —И–Ї–Њ–ї—М–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —Д–Є–Ј–Є–Ї–Є. –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–µ —Г—А–∞–≤–љ–µ–љ–Є—П, —В–∞–Ї–Є–µ –Ї–∞–Ї —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–њ–µ–є—А–Њ–љ–∞ –Є –Ј–∞–Ї–Њ–љ—Л –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞, –У–µ–є-–Ы—О—Б–∞–Ї–∞ –Є –®–∞—А–ї—П, –∞ —В–∞–Ї–ґ–µ —Н—В–∞–њ—Л —А–µ—И–µ–љ–Є—П –Ј–∞–і–∞—З, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Љ–Њ–≥–∞—О—В —Г—З–∞—Й–Є–Љ—Б—П —Г—Б–≤–Њ–Є—В—М –Њ—Б–љ–Њ–≤–љ—Л–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Ј–∞–Ї–Њ–љ—Л. –Я—А–Є–≤–Њ–і—П—В—Б—П –њ—А–Є–Љ–µ—А—Л –Ј–∞–і–∞—З —Б –њ–Њ—И–∞–≥–Њ–≤—Л–Љ–Є —А–µ—И–µ–љ–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –і–ї—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П.–§–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є
–§–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–ЄS-Petersburg University of Fire State Service
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Є—Б—Б–ї–µ–і—Г–µ—В —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –Њ—Е–≤–∞—В—Л–≤–∞—П –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Г—О —Д–Є–Ј–Є–Ї—Г –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л. –Ю–њ–Є—Б–∞–љ—Л –і–≤–∞ –њ–Њ–і—Е–Њ–і–∞ –Ї –Є–Ј—Г—З–µ–љ–Є—О –Љ–∞–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е —П–≤–ї–µ–љ–Є–є: —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є –Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є. –Ґ–∞–Ї–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —Г—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –і–ї—П –Є–і–µ–∞–ї—М–љ—Л—Е –Є —А–µ–∞–ї—М–љ—Л—Е –≥–∞–Ј–Њ–≤, –≤–Ї–ї—О—З–∞—П —Г—А–∞–≤–љ–µ–љ–Є–µ –Т–∞–љ-–і–µ—А-–Т–∞–∞–ї—М—Б–∞ –Є –≤–ї–Є—П–љ–Є–µ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤–µ—Й–µ—Б—В–≤.35598 f343a7a6acf4b3f5bca04acdc9f002ee
35598 f343a7a6acf4b3f5bca04acdc9f002eerobinbad123100
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б–±–Њ—А–љ–Є–Ї —А–µ—И–µ–љ–Є–є —В–Є–њ–Њ–≤—Л—Е —В–µ—Б—В–Њ–≤—Л—Е –Ј–∞–і–∞–љ–Є–є –њ–Њ —Д–Є–Ј–Є–Ї–µ –і–ї—П –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –Ї –Х–У–≠ 2016 –≥–Њ–і–∞, —Б–Њ–і–µ—А–ґ–∞—Й–Є–є 20 –≤–∞—А–Є–∞–љ—В–Њ–≤ –Ј–∞–і–∞—З —Б –њ–Њ–і—А–Њ–±–љ—Л–Љ–Є —А–µ—И–µ–љ–Є—П–Љ–Є. –†–∞–±–Њ—В–∞ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ –њ—А–µ–њ–Њ–і–∞–≤–∞—В–µ–ї—П–Љ–Є –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ —Н–Ї–Ј–∞–Љ–µ–љ–∞, –≤–Ї–ї—О—З–∞—П –љ–Њ–≤—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П. –Ю—Б–љ–Њ–≤–љ–∞—П —Ж–µ–ї—М —Б–±–Њ—А–љ–Є–Ї–∞ - –њ–Њ–Љ–Њ—З—М —Б—В–∞—А—И–µ–Ї–ї–∞—Б—Б–љ–Є–Ї–∞–Љ –Њ–≤–ї–∞–і–µ—В—М –Љ–µ—В–Њ–і–Є–Ї–∞–Љ–Є —А–µ—И–µ–љ–Є—П –Ј–∞–і–∞—З –≤ —А–∞–Љ–Ї–∞—Е –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–µ –Ї –Х–У–≠.—В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞
—В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞ocsumoron
ћэ
–Ґ–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞ –Є–Ј—Г—З–∞–µ—В –≤–љ—Г—В—А–µ–љ–љ—О—О —Н–љ–µ—А–≥–Є—О, —А–∞–±–Њ—В—Г –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В–µ–њ–ї–Њ—В—Л –≤ —Б–Є—Б—В–µ–Љ–∞—Е. –Я–µ—А–≤—Л–є –Ј–∞–Ї–Њ–љ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Б–≤—П–Ј—Л–≤–∞–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –≤–љ—Г—В—А–µ–љ–љ–µ–є —Н–љ–µ—А–≥–Є–Є —Б —В–µ–њ–ї–Њ—В–Њ–є –Є —А–∞–±–Њ—В–Њ–є –≤–љ–µ—И–љ–Є—Е —Б–Є–ї, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤—В–Њ—А–Њ–є –Ј–∞–Ї–Њ–љ —Г—В–≤–µ—А–ґ–і–∞–µ—В –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–µ—А–µ–і–∞—З–Є —В–µ–њ–ї–∞ –Њ—В —Е–Њ–ї–Њ–і–љ–Њ–≥–Њ —В–µ–ї–∞ –Ї –≥–Њ—А—П—З–µ–Љ—Г. –Ґ–µ–њ–ї–Њ–≤—Л–µ –і–≤–Є–≥–∞—В–µ–ї–Є –Є–ї–ї—О—Б—В—А–Є—А—Г—О—В –њ—А–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –і–≤–Є–ґ—Г—Й–µ–є —Б–Є–ї—Л –≤ —В–µ–њ–ї–Њ –Є –љ–∞–Њ–±–Њ—А–Њ—В.–Ч–∞–і–∞–љ–Є–µ 10
–Ч–∞–і–∞–љ–Є–µ 10–Ь–Є—Е–∞–Є–ї –І–µ—А–∞–Ї—И–µ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –≤–Ї–ї—О—З–∞—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –≤–љ—Г—В—А–µ–љ–љ–µ–є —Н–љ–µ—А–≥–Є–Є, —В–µ–њ–ї–Њ—В –Є —А–∞–±–Њ—В—Г, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–ї–Є—З–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є –Є –Є–Ј–Њ–±–∞—А–љ—Л–є. –Я–Њ–і—А–Њ–±–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Љ–µ—В–Њ–і—Л —А–∞—Б—З–µ—В–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В–µ–њ–ї–Њ—В—Л, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –≤–µ—Й–µ—Б—В–≤–∞, –Є –љ—О–∞–љ—Б—Л —А–∞–±–Њ—В—Л —В–µ–њ–ї–Њ–≤—Л—Е –і–≤–Є–≥–∞—В–µ–ї–µ–є. –Ґ–∞–Ї–ґ–µ –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П –њ–Њ–љ—П—В–Є—П –∞–±—Б–Њ–ї—О—В–љ–Њ–є –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –≤–ї–∞–ґ–љ–Њ—Б—В–Є –≤–Њ–Ј–і—Г—Е–∞.—Д–∞–Ј–Њ–≤—Л–µ –њ–µ—А–µ—Е–Њ–і—Л
—Д–∞–Ј–Њ–≤—Л–µ –њ–µ—А–µ—Е–Њ–і—ЛYerin_Constantine
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤–љ—Л–µ –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є —Д–Є–Ј–Є–Ї–Є, –≤–Ї–ї—О—З–∞—П —Д–∞–Ј–Њ–≤—Л–µ –њ–µ—А–µ—Е–Њ–і—Л –Є —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ –Љ–µ–ґ–і—Г –ґ–Є–і–Ї–Њ—Б—В—М—О –Є –љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ –њ–∞—А–Њ–Љ. –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —Г—А–∞–≤–љ–µ–љ–Є–µ –Ъ–ї–∞–њ–µ–є—А–Њ–љ–∞-–Ъ–ї–∞—Г–Ј–Є—Г—Б–∞ –Є —Д–∞–Ј–Њ–≤—Л–µ –і–Є–∞–≥—А–∞–Љ–Љ—Л, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ—А—Л —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є –Є—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ–ї–∞–≤–ї–µ–љ–Є—П –Є –Ї–Є–њ–µ–љ–Є—П. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П –Њ—В–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –њ–µ—А–≤–Њ–є –Є –≤—В–Њ—А–Њ–є —А–Њ–і–∞–Љ–Є —Д–∞–Ј–Њ–≤—Л—Е –њ–µ—А–µ—Е–Њ–і–Њ–≤ –Є –њ—А–Є–Љ–µ—А—Л –Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –≤–µ—Й–µ—Б—В–≤–∞.–ї–µ–Ї—Ж–Є—П 2 –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–Њ–љ—П—В–Є—П –Є –Ј–∞–Ї–Њ–љ—Л —Е–Є–Љ–Є–Є
–ї–µ–Ї—Ж–Є—П 2 –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–Њ–љ—П—В–Є—П –Є –Ј–∞–Ї–Њ–љ—Л —Е–Є–Љ–Є–Є–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –ї–µ–Ї—Ж–Є—О, –Њ—Е–≤–∞—В—Л–≤–∞—О—Й—Г—О —В–µ–Љ—Л –∞—В–Њ–Љ–љ—Л—Е –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л—Е –Љ–∞—Б—Б, –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б—Л –Є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Љ–Њ–ї—М. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П –Є–Ј–Њ—В–Њ–њ—Л, —Б—А–µ–і–љ–Є–µ –∞—В–Њ–Љ–љ—Л–µ –Љ–∞—Б—Б—Л, –∞ —В–∞–Ї–ґ–µ –Ј–∞–Ї–Њ–љ —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –Љ–∞—Б—Б—Л –Є —Н–љ–µ—А–≥–Є–Є, —Б—В–µ—Е–Є–Њ–Љ–µ—В—А–Є—П –Є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В—Л –≤–µ—Й–µ—Б—В–≤. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л —А–∞—Б—З–µ—В–Њ–≤, –Є–ї–ї—О—Б—В—А–Є—А—Г—О—Й–Є–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–љ—Ж–µ–њ—Ж–Є–є –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ.–ї–µ–Ї—Ж–Є—П 3 —Н–Ї–≤ –љ—В. –Њ–њ—А–µ–і–µ–ї –Љ(r), a
–ї–µ–Ї—Ж–Є—П 3 —Н–Ї–≤ –љ—В. –Њ–њ—А–µ–і–µ–ї –Љ(r), a–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤–љ—Л–µ –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є —Е–Є–Љ–Є–Є, –≤–Ї–ї—О—З–∞—П —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В—Л —Б–ї–Њ–ґ–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –Ј–∞–Ї–Њ–љ—Л –Ї—А–∞—В–љ—Л—Е –Є –Њ–±—К–µ–Љ–љ—Л—Е –Њ—В–љ–Њ—И–µ–љ–Є–є, –∞ —В–∞–Ї–ґ–µ –Ј–∞–Ї–Њ–љ –Р–≤–Њ–≥–∞–і—А–Њ. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П —В–∞–Ї–Є–µ –њ–Њ–љ—П—В–Є—П, –Ї–∞–Ї —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–∞—П –Љ–∞—Б—Б–∞, –Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –Є –њ–Њ—Б—В–Њ—П–љ—Б—В–≤–Њ —Б–Њ—Б—В–∞–≤–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–µ—В–Њ–і—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –Є –∞—В–Њ–Љ–љ—Л—Е –Љ–∞—Б—Б. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л —А–∞—Б—З–µ—В–Њ–≤ –Є –Њ–±—К—П—Б–љ–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–∞–Ї—Ж–Є—П–Љ–Є –Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –≥–∞–Ј–Њ–≤.–њ–Ј (–ї.5) —Б—В—А–Њ–µ–љ–Є–µ –∞—В–Њ–Љ–∞
–њ–Ј (–ї.5) —Б—В—А–Њ–µ–љ–Є–µ –∞—В–Њ–Љ–∞–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —Б–Њ–і–µ—А–ґ–Є—В –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ–Њ —Б–Њ—Б—В–∞–≤–ї–µ–љ–Є—О —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л—Е –Ї–Њ–љ—Д–Є–≥—Г—А–∞—Ж–Є–є –∞—В–Њ–Љ–Њ–≤ –±–µ–Ј –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —В–∞–±–ї–Є—Ж—Л –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞, –≤–Ї–ї—О—З–∞—П –њ—А–∞–≤–Є–ї–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–µ—А–Є–Њ–і–Њ–≤, –≥—А—Г–њ–њ—Л –Є —В–Є–њ–Њ–≤ —Н–ї–µ–Љ–µ–љ—В–Њ–≤. –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –њ—А–Є–Љ–µ—А—Л —А–µ—И–µ–љ–Є–є, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Б—В—А—Г–Ї—В—Г—А—Л —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤, —Б —А–∞—Б—З–µ—В–∞–Љ–Є –Є –Њ–±—К—П—Б–љ–µ–љ–Є—П–Љ–Є –і–ї—П —А–∞–Ј–ї–Є—З–љ—Л—Е —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤. –Ґ–∞–Ї–ґ–µ –њ—А–µ–і–ї–∞–≥–∞—О—В—Б—П –Ј–∞–і–∞—З–Є –і–ї—П —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–≥–Њ —А–µ—И–µ–љ–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ –Ј–∞–Ї—А–µ–њ–ї–µ–љ–Є–µ –њ–Њ–љ–Є–Љ–∞–љ–Є—П —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л—Е –Ї–Њ–љ—Д–Є–≥—Г—А–∞—Ж–Є–є –Є –Ї–≤–∞–љ—В–Њ–≤—Л—Е —З–Є—Б–µ–ї.Uravnenie sostoyania idealnogo_gaza
Uravnenie sostoyania idealnogo_gazailina05
ћэ
–£—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞ —Б–≤—П–Ј—Л–≤–∞–µ—В –і–∞–≤–ї–µ–љ–Є–µ, –Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К—С–Љ –Є –∞–±—Б–Њ–ї—О—В–љ—Г—О —В–µ–Љ–њ–µ—А–∞—В—Г—А—Г –≥–∞–Ј–∞ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ–є –≥–∞–Ј–Њ–≤–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є. –Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —А–∞–Ј–ї–Є—З–љ—Л–µ –Ј–∞–Ї–Њ–љ—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –Ј–∞–Ї–Њ–љ –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞ –Є –Ј–∞–Ї–Њ–љ –У–µ–є-–Ы—О—Б—Б–∞–Ї–∞, –∞ —В–∞–Ї–ґ–µ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е –≥–∞–Ј–Њ–≤–Њ–є –і–Є–љ–∞–Љ–Є–Ї–Є. –Ґ–∞–Ї–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –≤–ї–Є—П–љ–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –і–∞–≤–ї–µ–љ–Є–є –љ–∞ –њ–Њ–≤–µ–і–µ–љ–Є–µ –≥–∞–Ј–Њ–≤ –Є –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –Њ—В –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П.9-11 –Ї–ї–∞—Б—Б. –Ю—Б–љ–Њ–≤—Л —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є
9-11 –Ї–ї–∞—Б—Б. –Ю—Б–љ–Њ–≤—Л —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Єozlmgouru
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ—Е–≤–∞—В—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤—Л —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –≤–Ї–ї—О—З–∞—П —В–µ–њ–ї–Њ–µ–Љ–Ї–Њ—Б—В—М —Б–Є—Б—В–µ–Љ, —В–µ–њ–ї–Њ–≤—Л–µ —Н—Д—Д–µ–Ї—В—Л —А–µ–∞–Ї—Ж–Є–є –Є –Ј–∞–Ї–Њ–љ –У–µ—Б—Б–∞. –Т –љ–µ–Љ –њ–Њ–і—А–Њ–±–љ–Њ –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П —Н–Ї–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–µ –Є —Н–љ–і–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є, –∞ —В–∞–Ї–ґ–µ —А–∞—Б—З–µ—В—Л —В–µ–њ–ї–Њ–≤—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є —Б—В–µ—Е–Є–Њ–Љ–µ—В—А–Є–Є. –Ш—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –і–ї—П –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –Є –Є—Е —Г—Б–ї–Њ–≤–Є–є —Б–∞–Љ–Њ–њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—В–µ–Ї–∞–љ–Є—П.—Г–і–µ–ї—М–љ–∞—П —В–µ–њ–ї–Њ—В–∞ –њ–ї–∞–≤–ї–µ–љ–Є—П
—Г–і–µ–ї—М–љ–∞—П —В–µ–њ–ї–Њ—В–∞ –њ–ї–∞–≤–ї–µ–љ–Є—ПAdamovaT88
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В —А–∞–Ј–ї–Є—З–Є—П –≤ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –≤–µ—Й–µ—Б—В–≤ –≤ —А–∞–Ј–љ—Л—Е –∞–≥—А–µ–≥–∞—В–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –Є –Њ–њ–Є—Б—Л–≤–∞–µ—В —Б–Ї–Њ—А–Њ—Б—В—М, —А–∞—Б—Б—В–Њ—П–љ–Є–µ –Є –≤–Ј–∞–Є–Љ–љ–Њ–µ –њ—А–Є—В—П–ґ–µ–љ–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї –≤ –≥–∞–Ј–µ, –ґ–Є–і–Ї–Њ—Б—В–Є –Є —В–≤–µ—А–і–Њ–Љ —В–µ–ї–µ. –£–і–µ–ї—П–µ—В—Б—П –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—М–љ–Њ–є —В–µ–њ–ї–Њ—В–µ –њ–ї–∞–≤–ї–µ–љ–Є—П, –Њ–±–Њ–Ј–љ–∞—З–∞–µ–Љ–Њ–є –≥—А–µ—З–µ—Б–Ї–Њ–є –±—Г–Ї–≤–Њ–є ¬Ђ–ї—П–Љ–±–і–∞¬ї, –Є —А–∞—Б—З–µ—В–∞–Љ —Н–љ–µ—А–≥–Є–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–є –і–ї—П –њ–ї–∞–≤–ї–µ–љ–Є—П —Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≤–µ—Й–µ—Б—В–≤–∞. –Ґ–∞–Ї–ґ–µ –њ—А–Є–≤–Њ–і–Є—В—Б—П —Д–Њ—А–Љ—Г–ї–∞ q = ќїm –і–ї—П —А–∞—Б—З–µ—В–∞ —В–µ–њ–ї–Њ—В—Л, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–є –і–ї—П –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П —В–≤–µ—А–і–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≤ –ґ–Є–і–Ї–Њ–µ.–Ш—Б—В–µ—З–µ–љ–Є–µ –≥–∞–Ј–Њ–≤ –Є –ґ–Є–і–Ї–Њ—Б—В–µ–є
–Ш—Б—В–µ—З–µ–љ–Є–µ –≥–∞–Ј–Њ–≤ –Є –ґ–Є–і–Ї–Њ—Б—В–µ–єS-Petersburg University of Fire State Service
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ–Њ—Б–≤—П—Й–µ–љ –Њ—Б–љ–Њ–≤–∞–Љ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—В–Њ—А–Њ–Љ—Г –Ј–∞–Ї–Њ–љ—Г, –Ї–Њ—В–Њ—А—Л–є —Г—В–≤–µ—А–ґ–і–∞–µ—В, —З—В–Њ –≤—Б–µ —А–µ–∞–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –љ–µ–Њ–±—А–∞—В–Є–Љ—Л –Є –њ—А–Є–≤–Њ–і—П—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Н–љ—В—А–Њ–њ–Є–Є. –Ю–њ–Є—Б—Л–≤–∞—О—В—Б—П —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ —Ж–Є–Ї–ї—Л, –≤–Ї–ї—О—З–∞—П —Ж–Є–Ї–ї –Ъ–∞—А–љ–Њ, –Є –µ–≥–Њ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –њ–Њ–ї–µ–Ј–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —В–µ–њ–ї–Њ–≤—Л—Е –Љ–∞—И–Є–љ. –Я–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–ї–љ–Њ–≥–Њ –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П —В–µ–њ–ї–Њ—В—Л –≤ —А–∞–±–Њ—В—Г –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —А–∞–Ј–љ–Њ—Б—В–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А –і–ї—П –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—П —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.Chem kinetics new lecture
Chem kinetics new lectureKonstantin German
ћэ
–Ъ–Є–љ–µ—В–Є–Ї–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –Є—Б—Б–ї–µ–і—Г–µ—В —Б–Ї–Њ—А–Њ—Б—В—М –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–≤—А–∞—Й–µ–љ–Є–є, —З—В–Њ –Є–Љ–µ–µ—В –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –љ–∞—Г—З–љ—Л—Е –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–є, –≤–Ї–ї—О—З–∞—П –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є—О –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ–Њ—Б—В–Є. –°–Ї–Њ—А–Њ—Б—В—М —А–µ–∞–Ї—Ж–Є–Є –Ј–∞–≤–Є—Б–Є—В –Њ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —А–µ–∞–≥–µ–љ—В–Њ–≤, —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Є –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї —З–∞—Б—В–Њ—В–∞ —Б—В–Њ–ї–Ї–љ–Њ–≤–µ–љ–Є–є –Є —Н–љ–µ—А–≥–Є—П –∞–Ї—В–Є–≤–∞—Ж–Є–Є. –Ч–∞–Ї–Њ–љ –і–µ–є—Б—В–≤–Є—П –Љ–∞—Б—Б –Њ–њ—А–µ–і–µ–ї—П–µ—В, —З—В–Њ —Б–Ї–Њ—А–Њ—Б—В—М —А–µ–∞–Ї—Ж–Є–Є –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є —А–µ–∞–≥–Є—А—Г—О—Й–Є—Е –≤–µ—Й–µ—Б—В–≤, –Є –≠–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н–љ–µ—А–≥–Є–Є –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П.–ї–µ–Ї—Ж–Є—П10
–ї–µ–Ї—Ж–Є—П10afersh
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –≤ –≤–Є–і–µ –ї–µ–Ї—Ж–Є–Є –њ–Њ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–Љ—Г —Б–Љ—Л—Б–ї—Г —Н–љ—В–∞–ї—М–њ–Є–Є –Є —Н–љ—В—А–Њ–њ–Є–Є, –≤ –Ї–Њ—В–Њ—А–Њ–є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–µ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–љ—П—В–Є—П, —В–∞–Ї–Є–µ –Ї–∞–Ї —Н–љ—В–∞–ї—М–њ–Є—П –Ї–∞–Ї —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–є —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б–Є—Б—В–µ–Љ—Л, –Є —Н–љ—В—А–Њ–њ–Є—П –Ї–∞–Ї –Љ–µ—А–∞ –љ–µ–Њ–±—А–∞—В–Є–Љ–Њ–≥–Њ —А–∞—Б—Б–µ–Є–≤–∞–љ–Є—П —Н–љ–µ—А–≥–Є–Є. –Т –љ—С–Љ —В–∞–Ї–ґ–µ –њ—А–Є–≤–µ–і–µ–љ—Л —Д–Њ—А–Љ—Г–ї—Л –і–ї—П —А–∞—Б—З–µ—В–∞ —Н–љ—В–∞–ї—М–њ–Є–Є –Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–љ—В—А–Њ–њ–Є–Є –Є–і–µ–∞–ї—М–љ—Л—Е –≥–∞–Ј–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –Є—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є–є —Б–Љ—Л—Б–ї –Є –≤–ї–Є—П–љ–Є–µ –љ–∞ –њ—А–Њ—Ж–µ—Б—Б—Л —В–µ–њ–ї–Њ–Њ–±–Љ–µ–љ–∞. –Ю—Б–љ–Њ–≤–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—П–µ—В—Б—П —В–Њ–Љ—Г, –Ї–∞–Ї –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Н–љ—В—А–Њ–њ–Є–Є —Б–≤—П–Ј–∞–љ–Њ —Б –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤.–Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –≥–∞–Ј–Њ–≤
–Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –≥–∞–Ј–Њ–≤ulaevanadin123
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В –Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –≥–∞–Ј–Њ–≤, –Њ–њ—А–µ–і–µ–ї—П—П –µ–≥–Њ –Ї–∞–Ї –Њ–±—К–µ–Љ, –Ј–∞–љ–Є–Љ–∞–µ–Љ—Л–є 1 –Љ–Њ–ї—М –≥–∞–Ј–∞ –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, —А–∞–≤–љ—Л–є 22,4 –ї. –Я—А–Є–≤–µ–і–µ–љ—Л —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ —А–∞—Б—З–µ—В—Г —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Д–Њ—А–Љ—Г–ї –њ–ї–Њ—В–љ–Њ—Б—В–Є –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≤–µ—Й–µ—Б—В–≤–∞, –∞ —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ—А–Є—В–µ–ї—М–љ—Л–Љ –µ–і–Є–љ–Є—Ж–∞–Љ. –Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П, —З—В–Њ –Љ–Њ–ї—П—А–љ—Л–є –Њ–±—К–µ–Љ –Њ–±–Њ–Ј–љ–∞—З–∞–µ—В—Б—П –Ї–∞–Ї vm –Є –Ј–∞–≤–Є—Б–Є—В –Њ—В –і–∞–≤–ї–µ–љ–Є—П –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л.–ї–µ–Ї. 15 —В–µ–Њ—А–Є—П –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є
–ї–µ–Ї. 15 —В–µ–Њ—А–Є—П –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —А–∞–Ј–ї–Є—З–љ—Л–µ —В–µ–Њ—А–Є–Є –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є, –≤–Ї–ї—О—З–∞—П —В–µ–Њ—А–Є—О –Р—А—А–µ–љ–Є—Г—Б–∞, –њ—А–Њ—В–Њ–љ–љ—Г—О —В–µ–Њ—А–Є—О –С—А–µ–љ—Б—В–µ–і–∞-–Ы–Њ—Г—А–Є –Є —Н–ї–µ–Ї—В—А–Њ–љ–љ—Г—О —В–µ–Њ—А–Є—О –Ы—М—О–Є—Б–∞. –Ю–±—Б—Г–ґ–і–∞—О—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є, –Є—Е –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –≤ –≤–Њ–і–љ—Л—Е —А–∞—Б—В–≤–Њ—А–∞—Е, –∞ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б–Є–ї—Л –Ї–Є—Б–ї–Њ—В –Є –Њ—Б–љ–Њ–≤–∞–љ–Є–є —З–µ—А–µ–Ј –Ї–Њ–љ—Б—В–∞–љ—В—Л –Є–Њ–љ–Є–Ј–∞—Ж–Є–Є. –Ґ–∞–Ї–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є, –Њ–±—К—П—Б–љ—П—О—Й–Є–µ –≤–ї–Є—П–љ–Є–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –Є —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –∞–љ–Є–Њ–љ–Њ–≤ –љ–∞ –Ї–Є—Б–ї–Њ—В–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –≤–µ—Й–µ—Б—В–≤.–§–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є
–§–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–ЄS-Petersburg University of Fire State Service
ћэ
–ї–µ–Ї—Ж–Є—П 2 –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–Њ–љ—П—В–Є—П –Є –Ј–∞–Ї–Њ–љ—Л —Е–Є–Љ–Є–Є
–ї–µ–Ї—Ж–Є—П 2 –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–Њ–љ—П—В–Є—П –Є –Ј–∞–Ї–Њ–љ—Л —Е–Є–Љ–Є–Є–Р—А–Ї–∞–і–Є–є –Ч–∞—Е–∞—А–Њ–≤
ћэ
Similar to 3. –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л (sivolgin.com). v1 (12)
–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Ъ–∞–ї–Є–љ–Є—З –Т–ї–∞–і–∞
–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Ъ–∞–ї–Є–љ–Є—З –Т–ї–∞–і–∞Jimmy_ZigZag
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л, –≤–Ї–ї—О—З–∞—П –Є–Ј–Њ–±–∞—А–љ—Л–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є –Є –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б—Л. –≠—В–Є –њ—А–Њ—Ж–µ—Б—Б—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –љ–µ–Є–Ј–Љ–µ–љ–љ—Л–Љ–Є –њ–∞—А–∞–Љ–µ—В—А–∞–Љ–Є —Б–Њ—Б—В–Њ—П–љ–Є—П: –і–∞–≤–ї–µ–љ–Є–µ–Љ, –Њ–±—К–µ–Љ–Њ–Љ –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–Њ–є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Я—А–Є–≤–Њ–і—П—В—Б—П –Ј–∞–Ї–Њ–љ—Л, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–µ –і–∞–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –Ј–∞–Ї–Њ–љ –У–µ–є-–Ы—О—Б—Б–∞–Ї–∞ –Є –Ј–∞–Ї–Њ–љ –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞.–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Ъ–∞–ї–Є–љ–Є—З –Т–ї–∞–і–∞
–≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Ъ–∞–ї–Є–љ–Є—З –Т–ї–∞–і–∞Jimmy_ZigZag
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Є–Ј–Њ–±–∞—А–љ—Л–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є –Є –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б—Л, –Ї–∞–ґ–і—Л–є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –њ–Њ—Б—В–Њ—П–љ—Б—В–≤–Њ–Љ –Њ–і–љ–Њ–≥–Њ –Є–Ј –њ–∞—А–∞–Љ–µ—В—А–Њ–≤: –і–∞–≤–ї–µ–љ–Є—П, –Њ–±—К—С–Љ–∞ –Є–ї–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л. –Я—А–Є–≤–µ–і–µ–љ—Л —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Ј–∞–Ї–Њ–љ—Л: –Ј–∞–Ї–Њ–љ –У–µ–є-–Ы—О—Б—Б–∞–Ї–∞ –і–ї—П –Є–Ј–Њ–±–∞—А–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –Ј–∞–Ї–Њ–љ –®–∞—А–ї—П –і–ї—П –Є–Ј–Њ—Е–Њ—А–љ–Њ–≥–Њ –Є –Ј–∞–Ї–Њ–љ –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞ –і–ї—П –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ. –Ґ–∞–Ї–ґ–µ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П –Ј–љ–∞—З–µ–љ–Є–µ –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є –Є—Е –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П –љ–∞ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –і–Є–∞–≥—А–∞–Љ–Љ–∞—Е.—Д–Є–Ј–Є–Ї–∞
—Д–Є–Ј–Є–Ї–∞Fizika-234
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В –≥–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л –Є –Є—Е –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞, –≤–Ї–ї—О—З–∞—П –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л (–Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–µ, –Є–Ј–Њ–±–∞—А–љ—Л–µ –Є –Є–Ј–Њ—Е–Њ—А–љ—Л–µ) –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є —Ж–Є–Ї–ї. –Ю–љ –Њ–±—К—П—Б–љ—П–µ—В, –Ї–∞–Ї –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –њ–∞—А–∞–Љ–µ—В—А—Л –≥–∞–Ј–∞ –Є –Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, –∞ —В–∞–Ї–ґ–µ –Њ–њ–Є—Б—Л–≤–∞–µ—В —Ж–Є–Ї–ї—Л –Ъ–∞—А–љ–Њ –Є —А–∞–±–Њ—В—Г —В–µ–њ–ї–Њ–≤—Л—Е –і–≤–Є–≥–∞—В–µ–ї–µ–є. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–∞–Ј–Њ–≤—Л—Е –Ј–∞–Ї–Њ–љ–Њ–≤ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е.–Я–µ—А–≤–∞—П –њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П
–Я–µ—А–≤–∞—П –њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—ПDimass11
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ–њ–Є—Б—Л–≤–∞–µ—В —В—А–Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞: –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є –Є –Є–Ј–Њ–±–∞—А–љ—Л–є, –њ—А–Є–≤–Њ–і—П –Є—Е —Г—А–∞–≤–љ–µ–љ–Є—П, –Ј–∞–Ї–Њ–љ—Л –Є –Є—Б—В–Њ—А–Є—З–µ—Б–Ї–Є–µ —Б–њ—А–∞–≤–Ї–Є –Њ descubr–µ–љ–Є–Є. –£–Ї–∞–Ј–∞–љ—Л –Ї–ї—О—З–µ–≤—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї –њ–Њ—Б—В–Њ—П–љ–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ, –Њ–±—К–µ–Љ –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ґ–∞–Ї–ґ–µ –і–Њ–Ї—Г–Љ–µ–љ—В –≤–Ї–ї—О—З–∞–µ—В –≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ —Н—В–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–µ –Є–Ј–Њ—В–µ—А–Љ–Њ–є, –Є–Ј–Њ—Е–Њ—А–Њ–є –Є –Є–Ј–Њ–±–∞—А–Њ–є.2
2elvira051267
ћэ
–Ш–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ. –Т –і–Њ–Ї—Г–Љ–µ–љ—В–µ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П —Г—А–∞–≤–љ–µ–љ–Є–µ –С–Њ–є–ї—П –Є –Ј–∞–Ї–Њ–љ –С–Њ–є–ї—П-–Ь–∞—А–Є–Њ—В—В–∞, —Б–≤—П–Ј—Л–≤–∞—О—Й–µ–µ –і–∞–≤–ї–µ–љ–Є–µ –Є –Њ–±—К–µ–Љ –≥–∞–Ј–∞ –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ. –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–њ–µ–є—А–Њ–љ–∞ —В–∞–Ї–ґ–µ —Г–њ–Њ–Љ–Є–љ–∞–µ—В—Б—П –Ї–∞–Ї —З–∞—Б—В—М –∞–љ–∞–ї–Є–Ј–∞ –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞.–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П –њ–Њ —Д–Є–Ј–Є–Ї–µ 10 –Ї–ї–∞—Б—Б –љ–∞ —В–µ–Љ—Г "–У–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л"
–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П –њ–Њ —Д–Є–Ј–Є–Ї–µ 10 –Ї–ї–∞—Б—Б –љ–∞ —В–µ–Љ—Г "–У–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л"Yulia Zakharova
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В —Б–Њ–і–µ—А–ґ–Є—В –≤–Њ–њ—А–Њ—Б—Л –Є –Њ–±—К—П—Б–љ–µ–љ–Є—П –Њ –≥–∞–Ј–∞—Е, –≤–Ї–ї—О—З–∞—П –Љ–∞–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А—Л —Б–Њ—Б—В–Њ—П–љ–Є—П –≥–∞–Ј–∞, —Г—А–∞–≤–љ–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞ –Є —А–∞–Ј–ї–Є—З–љ—Л–µ –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л. –Ю–љ –Њ–±—Б—Г–ґ–і–∞–µ—В –Ј–∞–Ї–Њ–љ—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—П–Љ–Є –Љ–µ–ґ–і—Г –і–∞–≤–ї–µ–љ–Є–µ–Љ, –Њ–±—К–µ–Љ–Њ–Љ –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–Њ–є, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ–љ—П–µ—В —Г—А–∞–≤–љ–µ–љ–Є—П –Ї –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≥–∞–Ј–∞ —Б –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –Љ–∞—Б—Б–Њ–є. –Я—А–Є–≤–µ–і–µ–љ—Л –њ—А–Є–Љ–µ—А—Л –Ј–∞–і–∞—З –Є –≥—А–∞—Д–Є–Ї–Њ–≤, –Є–ї–ї—О—Б—В—А–Є—А—Г—О—Й–Є—Е —А–∞–Ј–ї–Є—З–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л —Б –Є–і–µ–∞–ї—М–љ—Л–Љ –≥–∞–Ј–Њ–Љ.–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П
–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—ПSmolyakov
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ—Б–≤–µ—Й–∞–µ—В –Њ—Б–љ–Њ–≤–љ—Л–µ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Є–і–µ–∞–ї—М–љ—Л—Е –≥–∞–Ј–Њ–≤, –≤–Ї–ї—О—З–∞—П –Є–Ј–Њ–±–∞—А–љ—Л–є, –Є–Ј–Њ—Е–Њ—А–љ—Л–є, –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є, –∞–і–Є–∞–±–∞—В–љ—Л–є –Є –њ–Њ–ї–Є—В—А–Њ–њ–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б—Л. –Ю–њ–Є—Б—Л–≤–∞—О—В—Б—П —Г—А–∞–≤–љ–µ–љ–Є—П, —А–∞–±–Њ—В–∞ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В–µ–њ–ї–Њ—В—Л, —Г—З–∞—Б—В–≤—Г—О—Й–Є–µ –≤ –Ї–∞–ґ–і–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–µ, –∞ —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н–љ—В—А–Њ–њ–Є–Є. –Ю—Б–љ–Њ–≤–љ–∞—П —Ж–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ–∞—А–∞–Љ–µ—В—А–∞–Љ–Є –≥–∞–Ј–Њ–≤.—В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞
—В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–∞Yerin_Constantine
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ—Е–≤–∞—В—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –≤–Ї–ї—О—З–∞—П –≤–љ—Г—В—А–µ–љ–љ—О—О —Н–љ–µ—А–≥–Є—О, –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —В–µ–њ–ї–Њ—В—Л –Є —А–∞–±–Њ—В—Г –≥–∞–Ј–∞, –∞ —В–∞–Ї–ґ–µ –Њ—Б–љ–Њ–≤–љ—Л–µ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л. –†–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ј–∞–Ї–Њ–љ—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, —В–∞–Ї–Є–µ –Ї–∞–Ї –љ—Г–ї–µ–≤–Њ–µ –Є –њ–µ—А–≤–Њ–µ –љ–∞—З–∞–ї–∞, –∞ —В–∞–Ї–ґ–µ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б–∞–Љ –Є –∞–і–Є–∞–±–∞—В–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—Ж–µ—Б—Б–∞–Љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П —В–µ–њ–ї–Њ–µ–Љ–Ї–Њ—Б—В—М –Є —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–∞–є–µ—А–∞, –њ–Њ–і—З–µ—А–Ї–Є–≤–∞—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ —В–µ–њ–ї–Њ–Њ–±–Љ–µ–љ–∞ –≤ –∞–і–Є–∞–±–∞—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–∞—Е.–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П1
–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П1aries001
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ–Њ—Б–≤—П—Й–µ–љ –Є–Ј—Г—З–µ–љ–Є—О –≥–∞–Ј–Њ–≤—Л—Е –Ј–∞–Ї–Њ–љ–Њ–≤ –Є –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –Њ–±—Б—Г–ґ–і–∞—П –Љ–∞—В–µ–Љ–∞—В–Є—З–µ—Б–Ї—Г—О –Ї—А–∞—Б–Њ—В—Г —В–µ–Њ—А–Є–Є. –Т –љ–µ–Љ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —Г—Б–ї–Њ–≤–Є—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є –њ—А–µ–і–ї–∞–≥–∞—О—В—Б—П –Ј–∞–і–∞—З–Є –і–ї—П —А–µ—И–µ–љ–Є—П —Б –њ—А–Є–Љ–µ—А–∞–Љ–Є —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –љ–∞–±–ї—О–і–µ–љ–Є–є. –Ґ–∞–Ї–ґ–µ —Г–њ–Њ–Љ–Є–љ–∞–µ—В—Б—П –Њ —А–Њ–ї–Є —Г—З–Є—В–µ–ї—П –Љ–∞—В–≤–µ–µ–≤–∞ –≠–ї—М–Ј—Л –Т–∞–ї–µ—А–Є–µ–≤–љ—Л –≤ –Њ–±—А–∞–Ј–Њ–≤–∞—В–µ–ї—М–љ–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–µ –Є –µ–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П—Е.–Ч–∞–і–∞–љ–Є–µ 8
–Ч–∞–і–∞–љ–Є–µ 8–Ь–Є—Е–∞–Є–ї –І–µ—А–∞–Ї—И–µ–≤
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –Њ—Е–≤–∞—В—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤—Л –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ–Њ—А–Є–Є, –≤–Ї–ї—О—З–∞—П —Б—В—А—Г–Ї—В—Г—А—Г –≤–µ—Й–µ—Б—В–≤–∞, –і–≤–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Є—Ж, –Є—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ –Є –Њ—Б–љ–Њ–≤–љ—Л–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞. –Ю–љ —В–∞–Ї–ґ–µ –Њ–±—Б—Г–ґ–і–∞–µ—В —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л, –Ј–∞–Ї–Њ–љ—Л –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞ –Є –њ–µ—А–µ—Е–Њ–і—Л –Љ–µ–ґ–і—Г –∞–≥—А–µ–≥–∞—В–љ—Л–Љ–Є —Б–Њ—Б—В–Њ—П–љ–Є—П–Љ–Є. –Я–Њ–і—А–Њ–±–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В—Л –Є –Є—Е —А–µ–Ј—Г–ї—М—В–∞—В—Л, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–Є–µ —В–µ–Њ—А–Є—О, –∞ —В–∞–Ї–ґ–µ –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П –Љ–µ—В–Њ–і—Л –Є–Ј–Љ–µ—А–µ–љ–Є—П –Љ–Њ–ї–µ–Ї—Г–ї –Є –≤–ї–∞–ґ–љ–Њ—Б—В–Є –≤–Њ–Ј–і—Г—Е–∞.–Ч–∞–і–∞–љ–Є–µ 11
–Ч–∞–і–∞–љ–Є–µ 11–Ь–Є—Е–∞–Є–ї –І–µ—А–∞–Ї—И–µ–≤
ћэ
–Ф–∞–љ–љ—Л–є –і–Њ–Ї—Г–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ–Њ—Б–Њ–±–Є–µ –њ–Њ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Д–Є–Ј–Є–Ї–µ –Є —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–µ, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–µ –і–ї—П –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –Ї –Х–У–≠ –њ–Њ —Д–Є–Ј–Є–Ї–µ. –Ю–љ –Њ—Е–≤–∞—В—Л–≤–∞–µ—В —В–µ–Љ—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї —В–µ–њ–ї–Њ–≤–Њ–µ –і–≤–Є–ґ–µ–љ–Є–µ, –Љ–Њ–і–µ–ї–Є –≥–∞–Ј–Њ–≤, –ґ–Є–і–Ї–Њ—Б—В–µ–є –Є —В–≤–µ—А–і—Л—Е —В–µ–ї, —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Є –Њ—Б–љ–Њ–≤–љ—Л–µ –Ј–∞–Ї–Њ–љ—Л —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є. –Я–Њ—Б–Њ–±–Є–µ –≤–Ї–ї—О—З–∞–µ—В —В–∞–Ї–ґ–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї, –≤—Л—Е–Њ–і—П—Й–Є–є –Ј–∞ —А–∞–Љ–Ї–Є –Ї–Њ–і–Є—Д–Є–Ї–∞—В–Њ—А–∞, —З—В–Њ–±—Л —Г–≥–ї—Г–±–Є—В—М –њ–Њ–љ–Є–Љ–∞–љ–Є–µ –Ї–ї—О—З–µ–≤—Л—Е —В–µ–Љ.Rubely
RubelyTommyAdam111
ћэ
–Ф–Њ–Ї—Г–Љ–µ–љ—В –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –љ–∞–±–Њ—А –≤–Њ–њ—А–Њ—Б–Њ–≤ –Є –Њ—В–≤–µ—В–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Њ–є –Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ—Е–∞–љ–Є–Ї–Њ–є, –≥–і–µ –њ–Њ–ї—М–Ј–Њ–≤–∞—В–µ–ї—О –њ—А–µ–і–Њ—Б—В–∞–≤–ї–µ–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ –Ј–∞–і–∞—З–Є –Є –Є—Е —А–µ—И–µ–љ–Є—П. –Т–Њ–њ—А–Њ—Б—Л –Њ—Е–≤–∞—В—Л–≤–∞—О—В —В–µ–Љ—Л, —В–∞–Ї–Є–µ –Ї–∞–Ї —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –С–Њ–ї—М—Ж–Љ–∞–љ–∞, —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–µ —Ж–Є–Ї–ї—Л, —Б–≤–Њ–є—Б—В–≤–∞ –Є–і–µ–∞–ї—М–љ—Л—Е –≥–∞–Ј–Њ–≤ –Є —Д–∞–Ј–Њ–≤—Л–µ –њ–µ—А–µ—Е–Њ–і—Л. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –≤–Њ–њ—А–Њ—Б—Л –±—Л–ї–Є –Њ—В–≤–µ—З–µ–љ—Л –≤–µ—А–љ–Њ, –і—А—Г–≥–Є–µ вАФ –љ–µ–≤–µ—А–љ–Њ, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ —Б–ї–Њ–ґ–љ–Њ—Б—В—М –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≥–ї—Г–±–ґ–µ –Є–Ј—Г—З–Є—В—М —В–µ–Љ—Г.–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П –њ–Њ —Д–Є–Ј–Є–Ї–µ 10 –Ї–ї–∞—Б—Б –љ–∞ —В–µ–Љ—Г "–У–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л"
–њ—А–µ–Ј–µ–љ—В–∞—Ж–Є—П –њ–Њ —Д–Є–Ј–Є–Ї–µ 10 –Ї–ї–∞—Б—Б –љ–∞ —В–µ–Љ—Г "–У–∞–Ј–Њ–≤—Л–µ –Ј–∞–Ї–Њ–љ—Л"Yulia Zakharova
ћэ
Ad
3. –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л (sivolgin.com). v1
- 1. –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л –Ь–∞—А—В 2015 вАҐ –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ вАҐ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л –£—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞ –Ґ–Њ—З–љ—Л–µ –љ–∞—Г–Ї–Є. –Я–Њ-–љ–Њ–≤–Њ–Љ—Г. | www.sivolgin.com | vk.com/victor.sivolgin
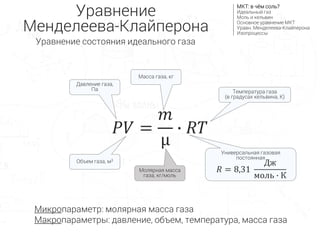
- 2. –Ґ–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –≥–∞–Ј–∞ (–≤ –≥—А–∞–і—Г—Б–∞—Е –Ї–µ–ї—М–≤–Є–љ–∞, –Ъ) –Ь–∞—Б—Б–∞ –≥–∞–Ј–∞, –Ї–≥ –Ь–Њ–ї—П—А–љ–∞—П –Љ–∞—Б—Б–∞ –≥–∞–Ј–∞, –Ї–≥/–Љ–Њ–ї—М –Ю–±—К–µ–Љ –≥–∞–Ј–∞, –Љ3 –Ф–∞–≤–ї–µ–љ–Є–µ –≥–∞–Ј–∞, –Я–∞ –£—А–∞–≤–љ–µ–љ–Є–µ –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л –Ь–Є–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А: –Љ–Њ–ї—П—А–љ–∞—П –Љ–∞—Б—Б–∞ –≥–∞–Ј–∞ –Ь–∞–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А—Л: –і–∞–≤–ї–µ–љ–Є–µ, –Њ–±—К–µ–Љ, —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞, –Љ–∞—Б—Б–∞ –≥–∞–Ј–∞ –£–љ–Є–≤–µ—А—Б–∞–ї—М–љ–∞—П –≥–∞–Ј–Њ–≤–∞—П –њ–Њ—Б—В–Њ—П–љ–љ–∞—П рЭСЕ = 8,31 –Ф–ґ –Љ–Њ–ї—М вИЩ –Ъ рЭСГрЭСЙ = рЭСЪ ќЉ вИЩ рЭСЕрЭСЗ –£—А–∞–≤–љ–µ–љ–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–і–µ–∞–ї—М–љ–Њ–≥–Њ –≥–∞–Ј–∞
- 3. –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б вАФ —В–µ—А–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –љ–∞–і –≥–∞–Ј–Њ–Љ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Њ–і–Є–љ –Є–Ј –Љ–∞–Ї—А–Њ–њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –љ–µ–Є–Ј–Љ–µ–љ–µ–љ P вИЩ V = ќљR вИЩ T
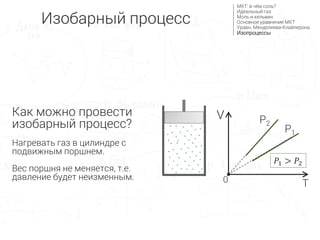
- 4. –Ш–Ј–Њ–±–∞—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Я—А–Њ—Ж–µ—Б—Б –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ –і–∞–≤–ї–µ–љ–Є–Є: P=const
- 5. –У—А–∞—Д–Є–Ї –≤ –Ї–Њ–Њ—А–і–Є–љ–∞—В–∞—Е VT вАФ –њ—А—П–Љ–∞—П, –њ—А–Њ—Е–Њ–і—П—Й–µ–є —З–µ—А–µ–Ј –љ–∞—З–∞–ї–Њ –Ї–Њ–Њ—А–і–Є–љ–∞—В (–∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ –≥—А–∞—Д–Є–Ї—Г y = kx ) P1 P2 V T0 рЭСГрЭСЙ = ќљрЭСЕрЭСЗ рЭСЙ = ќљрЭСЕ рЭСГ вИЩ рЭСЗ рЭСЙ = рЭЫЉ вИЩ рЭСЗ рЭСГ1 > рЭСГ2 –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–µ—Й–µ—Б—В–≤–∞ (ќљ), —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–∞—П –≥–∞–Ј–Њ–≤–∞—П –њ–Њ—Б—В–Њ—П–љ–љ–∞—П (R) –Є –і–∞–≤–ї–µ–љ–Є–µ (P) –љ–µ –Є–Ј–Љ–µ–љ—П—О—В—Б—П, —В.–µ. –њ–µ—А–µ–і —В–µ–Љ–њ–µ—А–∞—В—Г—А–Њ–є T —Б—В–Њ–Є—В –њ–Њ—Б—В–Њ—П–љ–љ—Л–є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –∞–ї—М—Д–∞ (рЭЫЉ). вЖТ | —А–∞–Ј–і–µ–ї–Є–Љ –Њ–±–µ —З–∞—Б—В–Є —Г—А–∞–≤–љ–µ–љ–Є—П –љ–∞ –і–∞–≤–ї–µ–љ–Є–µ P (1) –њ–Њ—А—И–µ–љ—М –Ш–Ј–Њ–±–∞—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л P вИЩ V = ќљR вИЩ T
- 6. –Ъ–∞–Ї –Љ–Њ–ґ–љ–Њ –њ—А–Њ–≤–µ—Б—В–Є –Є–Ј–Њ–±–∞—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б? –Э–∞–≥—А–µ–≤–∞—В—М –≥–∞–Ј –≤ —Ж–Є–ї–Є–љ–і—А–µ —Б –њ–Њ–і–≤–Є–ґ–љ—Л–Љ –њ–Њ—А—И–љ–µ–Љ. –Т–µ—Б –њ–Њ—А—И–љ—П –љ–µ –Љ–µ–љ—П–µ—В—Б—П, —В.–µ. –і–∞–≤–ї–µ–љ–Є–µ –±—Г–і–µ—В –љ–µ–Є–Ј–Љ–µ–љ–љ—Л–Љ. P1 P2 V T0 рЭСГ1 > рЭСГ2 –Ш–Ј–Њ–±–∞—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л
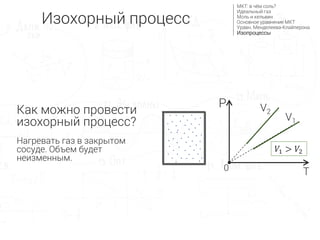
- 7. –Ш–Ј–Њ—Е–Њ—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Я—А–Њ—Ж–µ—Б—Б –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ –Њ–±—К–µ–Љ–µ: V=const –Э–∞ –і—А–µ–≤–љ–µ–≥—А–µ—З–µ—Б–Ї–Њ–Љ: ¬Ђ–Є–Ј–Њ¬ї вАФ —А–∞–≤–љ—Л–є, ¬Ђ—Е–Њ—А–Њ—Б¬ї - –Љ–µ—Б—В–Њ
- 8. –У—А–∞—Д–Є–Ї –≤ –Ї–Њ–Њ—А–і–Є–љ–∞—В–∞—Е PT вАФ –њ—А—П–Љ–∞—П, –њ—А–Њ—Е–Њ–і—П—Й–µ–є —З–µ—А–µ–Ј –љ–∞—З–∞–ї–Њ –Ї–Њ–Њ—А–і–Є–љ–∞—В (–∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ –≥—А–∞—Д–Є–Ї—Г y = kx ) рЭСГрЭСЙ = ќљрЭСЕрЭСЗ рЭСГ = ќљрЭСЕ рЭСЙ вИЩ рЭСЗ рЭСГ = рЭЫЉ вИЩ рЭСЗ | —А–∞–Ј–і–µ–ї–Є–Љ –Њ–±–µ —З–∞—Б—В–Є —Г—А–∞–≤–љ–µ–љ–Є—П –љ–∞ –Њ–±—К–µ–Љ V –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–µ—Й–µ—Б—В–≤–∞ (ќљ), —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–∞—П –≥–∞–Ј–Њ–≤–∞—П –њ–Њ—Б—В–Њ—П–љ–љ–∞—П (R) –Є –Њ–±—К–µ–Љ (V) –љ–µ –Є–Ј–Љ–µ–љ—П—О—В—Б—П, —В.–µ. –њ–µ—А–µ–і —В–µ–Љ–њ–µ—А–∞—В—Г—А–Њ–є T —Б—В–Њ–Є—В –њ–Њ—Б—В–Њ—П–љ–љ—Л–є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –∞–ї—М—Д–∞ (рЭЫЉ). вЖТ(2) V1 V2 P T0 рЭСЙ1 > рЭСЙ2 –Ш–Ј–Њ—Е–Њ—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л P вИЩ V = ќљR вИЩ T
- 9. –Ъ–∞–Ї –Љ–Њ–ґ–љ–Њ –њ—А–Њ–≤–µ—Б—В–Є –Є–Ј–Њ—Е–Њ—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б? –Э–∞–≥—А–µ–≤–∞—В—М –≥–∞–Ј –≤ –Ј–∞–Ї—А—Л—В–Њ–Љ —Б–Њ—Б—Г–і–µ. –Ю–±—К–µ–Љ –±—Г–і–µ—В –љ–µ–Є–Ј–Љ–µ–љ–љ—Л–Љ. V1 V2 P T0 рЭСЙ1 > рЭСЙ2 –Ш–Ј–Њ—Е–Њ—А–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л
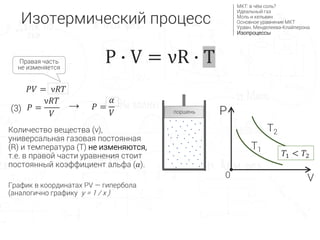
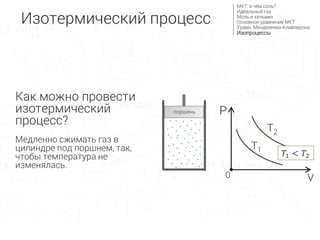
- 10. –Ш–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –Я—А–Њ—Ж–µ—Б—Б –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ: T=const
- 11. –У—А–∞—Д–Є–Ї –≤ –Ї–Њ–Њ—А–і–Є–љ–∞—В–∞—Е PV вАФ –≥–Є–њ–µ—А–±–Њ–ї–∞ (–∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ –≥—А–∞—Д–Є–Ї—Г y = 1 / x ) –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–µ—Й–µ—Б—В–≤–∞ (ќљ), —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–∞—П –≥–∞–Ј–Њ–≤–∞—П –њ–Њ—Б—В–Њ—П–љ–љ–∞—П (R) –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ (T) –љ–µ –Є–Ј–Љ–µ–љ—П—О—В—Б—П, —В.–µ. –≤ –њ—А–∞–≤–Њ–є —З–∞—Б—В–Є —Г—А–∞–≤–љ–µ–љ–Є—П —Б—В–Њ–Є—В –њ–Њ—Б—В–Њ—П–љ–љ—Л–є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –∞–ї—М—Д–∞ (рЭЫЉ). (3) –Я—А–∞–≤–∞—П —З–∞—Б—В—М –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П рЭСГрЭСЙ = ќљрЭСЕрЭСЗ рЭСГ = ќљрЭСЕрЭСЗ рЭСЙ вЖТ рЭСГ = рЭЫЉ рЭСЙ P V0 T1 T2 рЭСЗ1 < рЭСЗ2 –њ–Њ—А—И–µ–љ—М –Ш–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л P вИЩ V = ќљR вИЩ T
- 12. –Ъ–∞–Ї –Љ–Њ–ґ–љ–Њ –њ—А–Њ–≤–µ—Б—В–Є –Є–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б? –Ь–µ–і–ї–µ–љ–љ–Њ —Б–ґ–Є–Љ–∞—В—М –≥–∞–Ј –≤ —Ж–Є–ї–Є–љ–і—А–µ –њ–Њ–і –њ–Њ—А—И–љ–µ–Љ, —В–∞–Ї, —З—В–Њ–±—Л —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –љ–µ –Є–Ј–Љ–µ–љ—П–ї–∞—Б—М. P V0 T1 T2 рЭСЗ1 < рЭСЗ2 –њ–Њ—А—И–µ–љ—М –Ш–Ј–Њ—В–µ—А–Љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л
- 13. –Ш–Ј–Њ–±–∞—А–∞: P = const P —Б—В–Њ–Є—В –≤ –Ј–љ–∞–Љ–µ–љ–∞—В–µ–ї–µ вЖТ —З–µ–Љ –Љ–µ–љ—М—И–µ P, —В–µ–Љ –Ї—А—Г—З–µ –≥—А–∞—Д–Є–Ї –Ю–±—К–µ–Љ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –±—Л—Б—В—А–µ–µ –њ—А–Є –Љ–∞–ї–Њ–Љ –і–∞–≤–ї–µ–љ–Є–Є. P V P1 P2 0 –Я—А–∞–≤–∞—П —З–∞—Б—В—М –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П V T0 –Ш–Ј–Њ—В–µ—А–Љ–∞: T = const–Ш–Ј–Њ—Е–Њ—А–∞: V = const рЭСГрЭСЙ = ќљрЭСЕрЭСЗ рЭСЙ = ќљрЭСЕ рЭСГ вИЩ рЭСЗ рЭСЙ = рЭЫЉ вИЩ рЭСЗ рЭСГ1 > рЭСГ2 вЖТ | –і–µ–ї–Є–Љ –Њ–±–µ —З–∞—Б—В–Є –љ–∞ P (–њ—А—П–Љ–∞—П: y = kx ) V1 V2 P T0 рЭСЙ1 > рЭСЙ2 рЭСГрЭСЙ = ќљрЭСЕрЭСЗ рЭСГ = ќљрЭСЕ рЭСЙ вИЩ рЭСЗ рЭСГ = рЭЫЉ вИЩ рЭСЗвЖТ | –і–µ–ї–Є–Љ –Њ–±–µ —З–∞—Б—В–Є –љ–∞ V (–њ—А—П–Љ–∞—П: y = kx ) рЭСГрЭСЙ = ќљрЭСЕрЭСЗ рЭСГ = ќљрЭСЕрЭСЗ рЭСЙ вЖТ (–≥–Є–њ–µ—А–±–Њ–ї–∞: y = 1 / x ) V —Б—В–Њ–Є—В –≤ –Ј–љ–∞–Љ–µ–љ–∞—В–µ–ї–µ вЖТ —З–µ–Љ –Љ–µ–љ—М—И–µ V, —В–µ–Љ –Ї—А—Г—З–µ –≥—А–∞—Д–Є–Ї –Ф–∞–≤–ї–µ–љ–Є–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –±—Л—Б—В—А–µ–µ –≤ –Љ–∞–ї–Њ–Љ –Њ–±—К–µ–Љ–µ. рЭСГ = рЭЫЉ рЭСЙ T1 T2 –І–µ–Љ –±–Њ–ї—М—И–µ –Њ–±—К–µ–Љ –Є –і–∞–≤–ї–µ–љ–Є–µ, —В–µ–Љ –≤—Л—И–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ TвИљ P вИЩ V (—В–µ–Љ–њ. –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ –і–∞–≤–ї–µ–љ–Є—О –Є –Њ–±—К–µ–Љ—Г) рЭСЗ1 < рЭСЗ2 –Ґ—А–Є –Є–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б–∞ –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л
- 14. –Т–Є–Ї—В–Њ—А –°–Є–≤–Њ–ї–≥–Є–љ –Ю–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ: —Д–Є–Ј–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—Г–ї—М—В–µ—В –Ь–У–£ –Є–Љ. –Ь.–Т. –Ы–Њ–Љ–Њ–љ–Њ—Б–Њ–≤–∞ –Я—А–Є–Ј—С—А –Њ–±–ї–∞—Б—В–љ—Л—Е –Є —А–µ–≥–Є–Њ–љ–∞–ї—М–љ—Л—Е –Њ–ї–Є–Љ–њ–Є–∞–і –њ–Њ —Д–Є–Ј–Є–Ї–µ –Ы–∞—Г—А–µ–∞—В –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –љ–∞—Г—З–љ—Л—Е –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є–є. –Ш–Љ–µ–µ—В 6 –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є –Я—А–µ–њ–Њ–і–∞—С—В —Д–Є–Ј–Є–Ї—Г вАҐ –ї–Є—З–љ–Њ вАФ —Б 2006 –≥–Њ–і–∞ вАҐ –≤ –≥—А—Г–њ–њ–∞—Е вАФ —Б 2009 –≥–Њ–і–∞ –Ю –њ—А–µ–њ–Њ–і–∞–≤–∞—В–µ–ї–µ >> –Ъ—В–Њ –≤—Б—С —А–∞—Б—Б–Ї–∞–ґ–µ—В? –Ь–Ъ–Ґ: –≤ —З—С–Љ —Б–Њ–ї—М? –Ш–і–µ–∞–ї—М–љ—Л–є –≥–∞–Ј –Ь–Њ–ї—М –Є –Ї–µ–ї—М–≤–Є–љ –Ю—Б–љ–Њ–≤–љ–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –Ь–Ъ–Ґ –£—А–∞–≤–љ. –Ь–µ–љ–і–µ–ї–µ–µ–≤–∞-–Ъ–ї–∞–є–њ–µ—А–Њ–љ–∞ –Ш–Ј–Њ–њ—А–Њ—Ж–µ—Б—Б—Л
- 15. –°—В–∞—А—В 27 –Љ–∞—А—В–∞ | www.sivolgin.com | vk.com/victor.sivolgin
