1. –û—Å–Ω–æ–≤–Ω–æ–µ –£—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ (sivolgin.com). v1
- 1. Основное уравнение МКТ Март 2015 • МКТ: в чём соль? • Идеальный газ • Моль и кельвин • Основное уравнение МКТ Молекулярно-кинетическая теория строения вещества Точные науки. По-новому. | www.sivolgin.com | vk.com/victor.sivolgin
- 2. –ú–ö–¢: —á—Ç–æ —ç—Ç–æ? –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –ú–ö–¢ = –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ-–∫–∏–Ω–µ—Ç–∏—á–µ—Å–∫–∞—è —Ç–µ–æ—Ä–∏—è –í–µ—â–µ—Å—Ç–≤–æ —Å–æ—Å—Ç–æ–∏—Ç –∏–∑ —á–∞—Å—Ç–∏—Ü: –∞—Ç–æ–º–æ–≤ –∏ –º–æ–ª–µ–∫—É–ª –ß–∞—Å—Ç–∏—Ü—ã –≤–µ—â–µ—Å—Ç–≤–∞ –Ω–∞—Ö–æ–¥—è—Ç—Å—è –≤ –ø–æ—Å—Ç–æ—è–Ω–Ω–æ–º —Ö–∞–æ—Ç–∏—á–µ—Å–∫–æ–º –¥–≤–∏–∂–µ–Ω–∏–∏ (–æ–±–ª–∞–¥–∞—é—Ç –∫–∏–Ω–µ—Ç–∏—á–µ—Å–∫–æ–π —ç–Ω–µ—Ä–≥–∏–µ–π) –ö–∞–∫ –≤ –ª—é–±–æ–π —Ç–µ–æ—Ä–∏–∏, –≤ –ú–ö–¢ —É–ø—Ä–æ—â—ë–Ω–Ω—ã–µ –º–æ–¥–µ–ª–∏ (–º–æ–¥–µ–ª—å –∏–¥–µ–∞–ª—å–Ω–æ–≥–æ –≥–∞–∑–∞)
- 3. • Диффузия [что это?] • Испарение и конденсация • Броуновское движение [что это?] Какие эксперименты натолкнули на мысль о молекулярно-кинетической теории? МКТ: как о ней догадались? МКТ: в чём соль? Идеальный газ Моль и кельвин Основное уравнение МКТ Уравн. Менделеева-Клайперона Изопроцессы
- 4. • Все тела состоят из частиц: атомов и молекул • Частицы вещества взаимодействуют между собой: притягиваются и отталкиваются. • Частицы вещества находятся в непрерывном хаотическом движении. Основные положения МКТ МКТ: в чём соль? Идеальный газ Моль и кельвин Основное уравнение МКТ Уравн. Менделеева-Клайперона Изопроцессы
- 6. –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –î–ª—è –æ–ø–∏—Å–∞–Ω–∏—è –∑–∞–∫–æ–Ω–æ–≤, –∫–æ—Ç–æ—Ä—ã–º –ø–æ–¥—á–∏–Ω—è–µ—Ç—Å—è –≥–∞–∑, –º—ã –±—É–¥–µ–º –∏—Å–ø–æ–ª—å–∑–æ–≤–∞—Ç—å –º–æ–¥–µ–ª—å –∏–¥–µ–∞–ª—å–Ω–æ–≥–æ –≥–∞–∑–∞
- 7. ‚Ä¢ –Ý–∞—Å—Å—Ç–æ—è–Ω–∏–µ –º–µ–∂–¥—É —á–∞—Å—Ç–∏—Ü–∞–º–∏ –≥–∞–∑–∞ –º–Ω–æ–≥–æ –±–æ–ª—å—à–µ —Ä–∞–∑–º–µ—Ä–∞ —á–∞—Å—Ç–∏—Ü ‚Ä¢ –ß–∞—Å—Ç–∏—Ü—ã –≥–∞–∑–∞ –Ω–µ –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤—É—é—Ç –Ω–∞ —Ä–∞—Å—Å—Ç–æ—è–Ω–∏–∏ (–Ω–µ –ø—Ä–∏—Ç—è–≥–∏–≤–∞—é—Ç—Å—è, –Ω–µ –æ—Ç—Ç–∞–ª–∫–∏–≤–∞—é—Ç—Å—è) ‚Ä¢ –ß–∞—Å—Ç–∏—Ü—ã –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤—É—é—Ç —Ç–æ–ª—å–∫–æ –ø–æ—Å—Ä–µ–¥—Å—Ç–≤–æ–º –∞–±—Å–æ–ª—é—Ç–Ω–æ —É–ø—Ä—É–≥–∏—Ö —Å–æ—É–¥–∞—Ä–µ–Ω–∏–π –ö–∞–∫–æ–π –≥–∞–∑ –º–æ–∂–Ω–æ —Å—á–∏—Ç–∞—Ç—å –∏–¥–µ–∞–ª—å–Ω—ã–º? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –î–ª—è –æ–ø–∏—Å–∞–Ω–∏—è –∑–∞–∫–æ–Ω–æ–≤, –∫–æ—Ç–æ—Ä—ã–º –ø–æ–¥—á–∏–Ω—è–µ—Ç—Å—è –≥–∞–∑, –º—ã –±—É–¥–µ–º –∏—Å–ø–æ–ª—å–∑–æ–≤–∞—Ç—å –º–æ–¥–µ–ª—å –∏–¥–µ–∞–ª—å–Ω–æ–≥–æ –≥–∞–∑–∞ *–±—É–¥–µ–º —Å—á–∏—Ç–∞—Ç—å –≤–æ–∑–¥—É—Ö –∏–¥–µ–∞–ª—å–Ω—ã–º –≥–∞–∑–æ–º. –ü—Ä–∏ –Ω–µ –æ—á–µ–Ω—å –±–æ–ª—å—à–∏—Ö –¥–∞–≤–ª–µ–Ω–∏—è—Ö –∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞—Ö —ç—Ç–æ –æ—á–µ–Ω—å –±–ª–∏–∑–∫–æ –∫ –¥–µ–π—Å—Ç–≤–∏—Ç–µ–ª—å–Ω–æ—Å—Ç–∏
- 9. ùëÅùê¥ = 6,02 ‚àô 1023 –ó–∞ –µ–¥–∏–Ω–∏—Ü—É –∏–∑–º–µ—Ä–µ–Ω–∏—è –ø—Ä–∏–Ω—è–ª–∏ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ —á–∞—Å—Ç–∏—Ü –≤–µ—â–µ—Å—Ç–≤–∞, –∫–æ—Ç–æ—Ä–æ–µ —Å–æ–¥–µ—Ä–∂–∏—Ç—Å—è –≤ 12 –≥—Ä–∞–º–º–∞—Ö —É–≥–ª–µ—Ä–æ–¥–∞. –≠—Ç–æ —á–∏—Å–ª–æ –Ω–∞–∑–≤–∞–ª–∏ –ø–æ—Å—Ç–æ—è–Ω–Ω–æ–π –ê–≤–æ–≥–∞–¥—Ä–æ (—á–∏—Å–ª–æ–º –ê–≤–æ–≥–∞–¥—Ä–æ). 1 –º–æ–ª—å –≤–µ—â–µ—Å—Ç–≤–∞ ‚Äî —ç—Ç–æ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω–æ–µ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ —á–∞—Å—Ç–∏—Ü –≤–µ—â–µ—Å—Ç–≤–∞ (–∞—Ç–æ–º–æ–≤ –∏–ª–∏ –º–æ–ª–µ–∫—É–ª), –∞ –∏–º–µ–Ω–Ω–æ 6,02‚àô1023 —à—Ç—É–∫. –ö–æ–ª–∏—á–µ—Å—Ç–≤–æ –≤–µ—â–µ—Å—Ç–≤–∞ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –ö–∞–∫ —É–¥–æ–±–Ω–µ–π –∏–∑–º–µ—Ä—è—Ç—å –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–æ–ª–µ–∫—É–ª? –û–ø—Ä–µ–¥–µ–ª–µ–Ω–∏–µ. –ü–æ—Å—Ç–æ—è–Ω–Ω–∞—è –ê–≤–æ–≥–∞–¥—Ä–æ ‚Äì –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ —á–∞—Å—Ç–∏—Ü, —Å–æ–¥–µ—Ä–∂–∞—â–µ–µ—Å—è –≤ –æ–¥–Ω–æ–º –º–æ–ª–µ –≤–µ—â–µ—Å—Ç–≤–∞, –∏ —Ä–∞–≤–Ω–æ–µ 6,02‚àô1023.
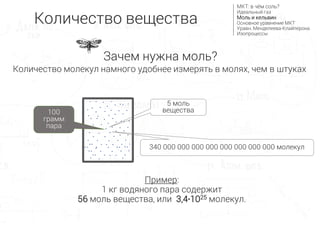
- 10. 5 –º–æ–ª—å –≤–µ—â–µ—Å—Ç–≤–∞ 340 000 000 000 000 000 000 000 000 –º–æ–ª–µ–∫—É–ª –ü—Ä–∏–º–µ—Ä: 1 –∫–≥ –≤–æ–¥—è–Ω–æ–≥–æ –ø–∞—Ä–∞ —Å–æ–¥–µ—Ä–∂–∏—Ç 56 –º–æ–ª—å –≤–µ—â–µ—Å—Ç–≤–∞, –∏–ª–∏ 3,4‚àô1025 –º–æ–ª–µ–∫—É–ª. –ö–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–æ–ª–µ–∫—É–ª –Ω–∞–º–Ω–æ–≥–æ —É–¥–æ–±–Ω–µ–µ –∏–∑–º–µ—Ä—è—Ç—å –≤ –º–æ–ª—è—Ö, —á–µ–º –≤ —à—Ç—É–∫–∞—Ö 100 –≥—Ä–∞–º–º –ø–∞—Ä–∞ –ö–æ–ª–∏—á–µ—Å—Ç–≤–æ –≤–µ—â–µ—Å—Ç–≤–∞ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –ó–∞—á–µ–º –Ω—É–∂–Ω–∞ –º–æ–ª—å?
- 11. 6,02‚àô1023 —á–∞—Å—Ç–∏—Ü –≤–µ—â–µ—Å—Ç–≤–∞ = 1 –º–æ–ª—å 1 –º–æ–ª—å ‚Äî —ç—Ç–æ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ —á–∞—Å—Ç–∏—Ü (–≤ —à—Ç—É–∫–∞—Ö!), —Ä–∞–≤–Ω–æ–µ —á–∏—Å–ª—É –ê–≤–æ–≥–∞–¥—Ä–æ (NA = 6,02‚àô1023) –ö–∞–∫ ¬´–º–æ–ª–∏¬ª —Å–≤—è–∑–∞–Ω—ã —Å –º–∞—Å—Å–æ–π –≤–µ—â–µ—Å—Ç–≤–∞? –ï—Å–ª–∏ –∏–∑–≤–µ—Å—Ç–Ω–∞ –º–∞—Å—Å–∞ –æ–¥–Ω–æ–π –º–æ–ª–µ–∫—É–ª—ã (m0), —Ç–æ –º–æ–∂–Ω–æ –≤—ã—á–∏—Å–ª–∏—Ç—å –º–∞—Å—Å—É –æ–¥–Ω–æ–≥–æ –º–æ–ª—è –≤–µ—â–µ—Å—Ç–≤–∞ ‚Äî –º–æ–ª—è—Ä–Ω—É—é –º–∞—Å—Å—É (Œº). –£–º–Ω–æ–∂–∏–º –º–∞—Å—Å—É –æ–¥–Ω–æ–π –º–æ–ª–µ–∫—É–ª—ã –Ω–∞ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–æ–ª–µ–∫—É–ª –≤ 1 –º–æ–ª–µ (—á–∏—Å–ª–æ –ê–≤–æ–≥–∞–¥—Ä–æ): Œº = ùëö0 ‚àô ùëÅùê¥ –º–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ = [–∫–∏–ª–æ–≥—Ä–∞–º–º] [1 –º–æ–ª—å] –ú–æ–ª—å –∏ –º–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã
- 12. Где узнать молярную массу вещества? Молярная масса — масса одного моля вещества —указана в таблице Менделеева* *В таблице Менделеева указана молярная масса в граммах на моль; для расчетов необходимо переводить в кг/моль. грамм/моль Моль и молярная масса МКТ: в чём соль? Идеальный газ Моль и кельвин Основное уравнение МКТ Уравн. Менделеева-Клайперона Изопроцессы
- 13. ùùÇ = ùëÅ ùëÅùê¥ = ùëö0 ‚àô ùëÅ ùëö0 ‚àô ùëÅùê¥ = ùíé ùùÅ –ö–∞–∫ –≤—ã—á–∏—Å–ª–∏—Ç—å –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–æ–ª–µ–π? –ù–∞–¥–æ —É–∑–Ω–∞—Ç—å, —Å–∫–æ–ª—å–∫–æ —Ä–∞–∑ –º–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ ¬´—Å–æ–¥–µ—Ä–∂–∏—Ǘŗ謪 –≤ –º–∞—Å—Å–µ –≤–µ—â–µ—Å—Ç–≤–∞. ŒΩ = 80 –≥ 16 –≥/–º–æ–ª—å = 5 –º–æ–ª—å –ü—Ä–∏–º–µ—Ä. 48 –≥—Ä–∞–º–º –≤–æ–¥–æ—Ä–æ–¥–∞ —Å–æ–¥–µ—Ä–∂–∏—Ç 3 –º–æ–ª—è –≤–µ—â–µ—Å—Ç–≤–∞: –ú–æ–ª—å –∏ –º–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã
- 14. 0 ¬∞–° ‚Äì –∑–∞–º–µ—Ä–∑–∞–Ω–∏–µ –≤–æ–¥—ã 100 ¬∞–° ‚Äì –∫–∏–ø–µ–Ω–∏–µ –≤–æ–¥—ã –®–∫–∞–ª–∞ –¶–µ–ª—å—Å–∏—è (¬∞C) –®–∫–∞–ª–∞ –§–∞—Ä–µ–Ω–≥–µ–π—Ç–∞ (¬∞F) –®–∫–∞–ª–∞ –ö–µ–ª—å–≤–∏–Ω–∞ (K) ùíï = ùüé¬∞ùë™ ‚Ķ ‚Ķ ùüèùüéùüé ¬∞ùë™ 0 ùêæ = ‚àí273,15 ¬∞ùê∂ ùëª = ùíï + ùüêùüïùüë,15 ùë≠ = ùüó ùüì ùíï + ùüëùüê –¢–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –ö–∞–∫ –∏–∑–º–µ—Ä–∏—Ç—å —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É? –í—ã–±–∏—Ä–∞–µ–º –≤–µ—â–µ—Å—Ç–≤–æ, –∏—â–µ–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –∑–∞–º–µ—Ä–∑–∞–Ω–∏—è, –∏—â–µ–º —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –∫–∏–ø–µ–Ω–∏—è. –î–µ–ª–∏–º –Ω–∞ 100 –¥–µ–ª–µ–Ω–∏–π. –ü–æ–ª—É—á–∞–µ–º —à–∫–∞–ª—É. t ‚Äî —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –ø–æ –¶–µ–ª—å—Å–∏—é –ì—Ä–∞–¥—É—Å –ø–æ –ö–µ–ª—å–≤–∏–Ω—É —Ä–∞–≤–µ–Ω –≥—Ä–∞–¥—É—Å—É –ø–æ —à–∫–∞–ª–µ –¶–µ–ª—å—Å–∏—è, –Ω–æ (!) —à–∫–∞–ª–∞ —Å–º–µ—â–µ–Ω–∞ –Ω–∞ 273 –≥—Ä–∞–¥—É—Å–∞! t ‚Äì —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –ø–æ –¶–µ–ª—å—Å–∏—é 0 ¬∞F - —Ç–æ—á–∫–∞ –∑–∞–º–µ—Ä–∑–∞–Ω–∏—è —Å–º–µ—Å–∏ –≤–æ–¥—ã, –ª—å–¥–∞ –∏ –Ω–∞—à–∞—Ç—ã—Ä—è 96 ¬∞F ‚Äî –Ω–æ—Ä–º–∞–ª—å–Ω–∞—è —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ —Ç–µ–ª–∞
- 15. –ê–±—Å–æ–ª—é—Ç–Ω–∞—è —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ ‚Äî –≤ –∫–µ–ª—å–≤–∏–Ω–∞—Ö –ù–æ–ª—å –ø–æ –ö–µ–ª—å–≤–∏–Ω—É (0 ùêæ) ‚Äî —ç—Ç–æ –∞–±—Å–æ–ª—é—Ç–Ω—ã–π –Ω–æ–ª—å: —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞, –ø—Ä–∏ –∫–æ—Ç–æ—Ä–æ–π –ø—Ä–µ–∫—Ä–∞—â–∞–µ—Ç—Å—è —Ç–µ–ø–ª–æ–≤–æ–µ –¥–≤–∏–∂–µ–Ω–∏–µ –º–æ–ª–µ–∫—É–ª. ùëª = ùíï + ùüêùüïùüë –¢–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã 0 ¬∞–° ‚Äì –∑–∞–º–µ—Ä–∑–∞–Ω–∏–µ –≤–æ–¥—ã 100 ¬∞–° ‚Äì –∫–∏–ø–µ–Ω–∏–µ –≤–æ–¥—ã –®–∫–∞–ª–∞ –¶–µ–ª—å—Å–∏—è (¬∞C) –®–∫–∞–ª–∞ –§–∞—Ä–µ–Ω–≥–µ–π—Ç–∞ (¬∞F) –®–∫–∞–ª–∞ –ö–µ–ª—å–≤–∏–Ω–∞ (K) ùíï = ùüé¬∞ùë™ ‚Ķ ‚Ķ ùüèùüéùüé ¬∞ùë™ 0 ùêæ = ‚àí273,15 ¬∞ùê∂ ùëª = ùíï + ùüêùüïùüë,15 ùë≠ = ùüó ùüì ùíï + ùüëùüê t ‚Äî —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –ø–æ –¶–µ–ª—å—Å–∏—é –ì—Ä–∞–¥—É—Å –ø–æ –ö–µ–ª—å–≤–∏–Ω—É —Ä–∞–≤–µ–Ω –≥—Ä–∞–¥—É—Å—É –ø–æ —à–∫–∞–ª–µ –¶–µ–ª—å—Å–∏—è, –Ω–æ (!) —à–∫–∞–ª–∞ —Å–º–µ—â–µ–Ω–∞ –Ω–∞ 273 –≥—Ä–∞–¥—É—Å–∞! t ‚Äì —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ –ø–æ –¶–µ–ª—å—Å–∏—é 0 ¬∞F - —Ç–æ—á–∫–∞ –∑–∞–º–µ—Ä–∑–∞–Ω–∏—è —Å–º–µ—Å–∏ –≤–æ–¥—ã, –ª—å–¥–∞ –∏ –Ω–∞—à–∞—Ç—ã—Ä—è 96 ¬∞F ‚Äî –Ω–æ—Ä–º–∞–ª—å–Ω–∞—è —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ —Ç–µ–ª–∞
- 16. –ù–∞–π—Ç–∏ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–æ–ª–µ–∫—É–ª –ø—Ä–∏—Ä–æ–¥–Ω–æ–≥–æ –≥–∞–∑–∞ CH4 –≤ –∂–µ–ª–µ–∑–Ω–æ–¥–æ—Ä–æ–∂–Ω–æ–π —Ü–∏—Å—Ç–µ—Ä–Ω–µ. 1. –Ý–∞–∑–º–µ—Ä—ã —Ü–∏—Å—Ç–µ—Ä–Ω—ã –û–±—ä—ë–º 80 –º, –º–∞—Å—Å–∞ –≥–∞–∑–∞ 60 —Ç. 2. –ú–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ –≥–∞–∑–∞ ¬µ =12 –≥/–º–æ–ª—å + 2√ó1 –≥/–º–æ–ª—å = 14 –≥/–º–æ–ª—å 3. –ö–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–æ–ª–µ–π ŒΩ = m Œº = 60 000 –∫–≥ 0,014 –∫–≥/–º–æ–ª—å = = 4285714 ‚âà 4,3 ‚àô 106 –º–æ–ª—å 4. –ö–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–æ–ª–µ–∫—É–ª N = ŒΩ ‚àô NA = 4,3 ‚àô 106 √ó 6,02 ‚àô 1023 = = 25.886 ‚àô 1029 ‚âà 29,9 ‚àô 1029 —à—Ç—É–∫ –ó–∞–¥–∞—á–∞: –º–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ –∏ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –≤–µ—â–µ—Å—Ç–≤–∞ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã
- 17. Основное уравнение МКТ МКТ: в чём соль? Идеальный газ Моль и кельвин Основное уравнение МКТ Уравн. Менделеева-Клайперона Изопроцессы Если рассматривать газ как упругие шары, то давление газа — результат ударов молекул (атомов) о стенки сосуда. Давление зависит от: • концентрации • массы • скорости молекул
- 18. ùëÉ = 1 3 ùëõùëö0 ùëâ2 –°—Ä–µ–¥–Ω—è—è –∫–≤–∞–¥—Ä–∞—Ç–∏—á–Ω–∞—è —Å–∫–æ—Ä–æ—Å—Ç—å –º–æ–ª–µ–∫—É–ª –≥–∞–∑–∞ –ö–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—è –º–æ–ª–µ–∫—É–ª –≥–∞–∑–∞ –ú–∞—Å—Å–∞ –æ–¥–Ω–æ–π –º–æ–ª–µ–∫—É–ª—ã –î–∞–≤–ª–µ–Ω–∏–µ –≥–∞–∑–∞ –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –ï—Å–ª–∏ —Ä–∞—Å—Å–º–∞—Ç—Ä–∏–≤–∞—Ç—å –≥–∞–∑ –∫–∞–∫ —É–ø—Ä—É–≥–∏–µ —à–∞—Ä—ã, —Ç–æ –¥–∞–≤–ª–µ–Ω–∏–µ –≥–∞–∑–∞ ‚Äî —Ä–µ–∑—É–ª—å—Ç–∞—Ç —É–¥–∞—Ä–æ–≤ –º–æ–ª–µ–∫—É–ª (–∞—Ç–æ–º–æ–≤) –æ —Å—Ç–µ–Ω–∫–∏ —Å–æ—Å—É–¥–∞. –î–∞–≤–ª–µ–Ω–∏–µ –∑–∞–≤–∏—Å–∏—Ç –æ—Ç: ‚Ä¢ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏–∏ ‚Ä¢ –º–∞—ŗŗ㠂Ģ —Å–∫–æ—Ä–æ—Å—Ç–∏ –º–æ–ª–µ–∫—É–ª
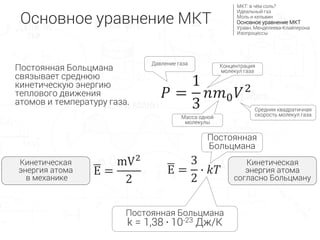
- 19. ùëÉ = 1 3 ùëõùëö0 ùëâ2 –°—Ä–µ–¥–Ω—è—è –∫–≤–∞–¥—Ä–∞—Ç–∏—á–Ω–∞—è —Å–∫–æ—Ä–æ—Å—Ç—å –º–æ–ª–µ–∫—É–ª –≥–∞–∑–∞ –ö–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—è –º–æ–ª–µ–∫—É–ª –≥–∞–∑–∞ –ú–∞—Å—Å–∞ –æ–¥–Ω–æ–π –º–æ–ª–µ–∫—É–ª—ã –ö–∏–Ω–µ—Ç–∏—á–µ—Å–∫–∞—è —ç–Ω–µ—Ä–≥–∏—è –∞—Ç–æ–º–∞ –≤ –º–µ—Ö–∞–Ω–∏–∫–µ –ö–∏–Ω–µ—Ç–∏—á–µ—Å–∫–∞—è —ç–Ω–µ—Ä–≥–∏—è –∞—Ç–æ–º–∞ —Å–æ–≥–ª–∞—Å–Ω–æ –ë–æ–ª—å—Ü–º–∞–Ω—É –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –î–∞–≤–ª–µ–Ω–∏–µ –≥–∞–∑–∞ –ü–æ—Å—Ç–æ—è–Ω–Ω–∞—è –ë–æ–ª—å—Ü–º–∞–Ω–∞ k = 1,38 ‚àô 10-23 –î–∂/–ö –ü–æ—Å—Ç–æ—è–Ω–Ω–∞—è –ë–æ–ª—å—Ü–º–∞–Ω–∞ –ü–æ—Å—Ç–æ—è–Ω–Ω–∞—è –ë–æ–ª—å—Ü–º–∞–Ω–∞ —Å–≤—è–∑—ã–≤–∞–µ—Ç —Å—Ä–µ–¥–Ω—é—é –∫–∏–Ω–µ—Ç–∏—á–µ—Å–∫—É—é —ç–Ω–µ—Ä–≥–∏—é —Ç–µ–ø–ª–æ–≤–æ–≥–æ –¥–≤–∏–∂–µ–Ω–∏—è –∞—Ç–æ–º–æ–≤ –∏ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –≥–∞–∑–∞. E = mV2 2 E = 3 2 ‚àô ùëòùëá
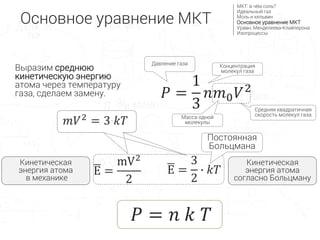
- 20. ùëÉ = 1 3 ùëõùëö0 ùëâ2 E = mV2 2 ùëÉ = ùëõ ùëò ùëá –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –î–∞–≤–ª–µ–Ω–∏–µ –≥–∞–∑–∞ E = 3 2 ‚àô ùëòùëá –ö–∏–Ω–µ—Ç–∏—á–µ—Å–∫–∞—è —ç–Ω–µ—Ä–≥–∏—è –∞—Ç–æ–º–∞ —Å–æ–≥–ª–∞—Å–Ω–æ –ë–æ–ª—å—Ü–º–∞–Ω—É –ö–∏–Ω–µ—Ç–∏—á–µ—Å–∫–∞—è —ç–Ω–µ—Ä–≥–∏—è –∞—Ç–æ–º–∞ –≤ –º–µ—Ö–∞–Ω–∏–∫–µ ùëöùëâ2 = 3‚àôùëòùëá –ü–æ—Å—Ç–æ—è–Ω–Ω–∞—è –ë–æ–ª—å—Ü–º–∞–Ω–∞ –ö–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—è –º–æ–ª–µ–∫—É–ª –≥–∞–∑–∞ –ú–∞—Å—Å–∞ –æ–¥–Ω–æ–π –º–æ–ª–µ–∫—É–ª—ã –°—Ä–µ–¥–Ω—è—è –∫–≤–∞–¥—Ä–∞—Ç–∏—á–Ω–∞—è —Å–∫–æ—Ä–æ—Å—Ç—å –º–æ–ª–µ–∫—É–ª –≥–∞–∑–∞ –í—ã—Ä–∞–∑–∏–º —Å—Ä–µ–¥–Ω—é—é –∫–∏–Ω–µ—Ç–∏—á–µ—Å–∫—É—é —ç–Ω–µ—Ä–≥–∏—é –∞—Ç–æ–º–∞ —á–µ—Ä–µ–∑ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—É –≥–∞–∑–∞, —Å–¥–µ–ª–∞–µ–º –∑–∞–º–µ–Ω—É.
- 21. Постоянная… Боцмана? k = 1,38 ∙ 10-23 Дж/К
- 22. –ó–∞–¥–∞—á–∞: –¥–∞–≤–ª–µ–Ω–∏–µ –≥–∞–∑–∞ –≤ –±–∞–ª–ª–æ–Ω–µ –ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å? –ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑ –ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω –û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢ –£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞ –ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã –í—ã—á–∏—Å–ª–∏—Ç—å –¥–∞–≤–ª–µ–Ω–∏–µ –ø—Ä–∏—Ä–æ–¥–Ω–æ–≥–æ –≥–∞–∑–∞ (CH4) –≤ –±–∞–ª–ª–æ–Ω–µ 50 –ª. –ü–æ–ª–Ω—ã–π –±–∞–ª–ª–æ–Ω –≤–µ—Å–∏—Ç 40 –∫–≥. –¢–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞ 17 ¬∞–°. 1. –í–µ—Å –≥–∞–∑–∞ –≤ –±–∞–ª–ª–æ–Ω–µ –ü—É—Å—Ç–æ–π –±–∞–ª–ª–æ–Ω –≤–µ—Å–∏—Ç 22 –∫–≥ (—Å–ø—Ä–∞–≤–∫–∞). –í–µ—Å –≥–∞–∑–∞: m = 40 ‚Äì 22 = 18 –∫–≥. 2. –ú–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ –º–µ—Ç–∞–Ω–∞ ¬µ =12 –≥/–º–æ–ª—å + 4√ó1 –≥/–º–æ–ª—å = 16 –≥/–º–æ–ª—å 3. –ö–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–æ–ª–µ–π –≤ –±–∞–ª–ª–æ–Ω–µ ŒΩ = m Œº = 18 –∫–≥ 0,016 –∫–≥/–º–æ–ª—å = 1125 –º–æ–ª—å 4. –ö–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—è –º–æ–ª–µ–∫—É–ª –≤ –±–∞–ª–ª–æ–Ω–µ n = N V = ŒΩ‚àôùëÅ ùê¥ V = 1125 ‚àô 6,02‚àô1023 50‚àô10‚àí3 = 1,35 ‚àô 1028 1/–º3 5. –î–∞–≤–ª–µ–Ω–∏–µ –≥–∞–∑–∞ p = n k T = 1,35 ‚àô 1028 ‚àô1,38 ‚àô 10-23 ‚àô 290 = = 540,3 ‚àô 105 –ü–∞ (¬´540 –∞—Ç–º–æ—Å—Ñ–µ—Ĭª)
- 23. Виктор Сиволгин Образование: физический факультет МГУ им. М.В. Ломоносова Призёр областных и региональных олимпиад по физике Лауреат международных научных конференций. Имеет 6 публикаций Преподаёт физику • лично — с 2006 года • в группах — с 2009 года О преподавателе >> Кто всё расскажет? МКТ: в чём соль? Идеальный газ Моль и кельвин Основное уравнение МКТ Уравн. Менделеева-Клайперона Изопроцессы
- 24. –°—Ç–∞—Ä—Ç 27 –º–∞—Ä—Ç–∞ | www.sivolgin.com | vk.com/victor.sivolgin


![• Диффузия [что это?]
• Испарение и конденсация
• Броуновское движение [что это?]
–ö–∞–∫–∏–µ —ç–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç—ã
–Ω–∞—Ç–æ–ª–∫–Ω—É–ª–∏ –Ω–∞ –º—ã—Å–ª—å
–æ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–æ-–∫–∏–Ω–µ—Ç–∏—á–µ—Å–∫–æ–π
—Ç–µ–æ—Ä–∏–∏?
–ú–ö–¢: –∫–∞–∫ –æ –Ω–µ–π –¥–æ–≥–∞–¥–∞–ª–∏—Å—å?
–ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å?
–ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑
–ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω
–û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢
–£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞
–ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã](https://image.slidesharecdn.com/1-150320145527-conversion-gate01/85/1-sivolgin-com-v1-3-320.jpg)






![6,02‚àô1023 —á–∞—Å—Ç–∏—Ü –≤–µ—â–µ—Å—Ç–≤–∞ = 1 –º–æ–ª—å
1 моль — это количество частиц (в штуках!),
—Ä–∞–≤–Ω–æ–µ —á–∏—Å–ª—É –ê–≤–æ–≥–∞–¥—Ä–æ (NA = 6,02‚àô1023)
Как «моли» связаны с массой вещества?
–ï—Å–ª–∏ –∏–∑–≤–µ—Å—Ç–Ω–∞ –º–∞—Å—Å–∞ –æ–¥–Ω–æ–π –º–æ–ª–µ–∫—É–ª—ã (m0), —Ç–æ
–º–æ–∂–Ω–æ –≤—ã—á–∏—Å–ª–∏—Ç—å –º–∞—Å—Å—É –æ–¥–Ω–æ–≥–æ –º–æ–ª—è –≤–µ—â–µ—Å—Ç–≤–∞
— молярную массу (μ).
–£–º–Ω–æ–∂–∏–º –º–∞—Å—Å—É –æ–¥–Ω–æ–π –º–æ–ª–µ–∫—É–ª—ã –Ω–∞ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ
–º–æ–ª–µ–∫—É–ª –≤ 1 –º–æ–ª–µ (—á–∏—Å–ª–æ –ê–≤–æ–≥–∞–¥—Ä–æ):
Œº = ùëö0 ‚àô ùëÅùê¥
–º–æ–ª—è—Ä–Ω–∞—è
–º–∞—Å—Å–∞
=
[–∫–∏–ª–æ–≥—Ä–∞–º–º]
[1 –º–æ–ª—å]
–ú–æ–ª—å –∏ –º–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞
–ú–ö–¢: –≤ —á—ë–º —Å–æ–ª—å?
–ò–¥–µ–∞–ª—å–Ω—ã–π –≥–∞–∑
–ú–æ–ª—å –∏ –∫–µ–ª—å–≤–∏–Ω
–û—Å–Ω–æ–≤–Ω–æ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ –ú–ö–¢
–£—Ä–∞–≤–Ω. –ú–µ–Ω–¥–µ–ª–µ–µ–≤–∞-–ö–ª–∞–π–ø–µ—Ä–æ–Ω–∞
–ò–∑–æ–ø—Ä–æ—Ü–µ—Å—Å—ã](https://image.slidesharecdn.com/1-150320145527-conversion-gate01/85/1-sivolgin-com-v1-11-320.jpg)