BaltymÅģ biologija nauja
- 1. BaltymÅģ biologija Martyna PetrulytÄ Lietuvos Sveikatos MokslÅģ Universitetas
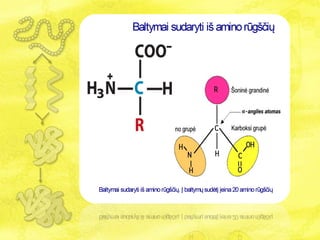
- 2. Baltymai âē Baltymai - tai polimerinÄs medÅūiagos, sudarytos iÅĄ monomerÅģ â aminorÅŦgÅĄÄiÅģ, kurias jungia peptidiniai ryÅĄiai: ~N-C-(C=O)~N-C-(C=O)~N-C-(C=O) ~ Jie susidaro tarp karboksilo (-COOH) grupÄs vienoje aminorÅŦgÅĄties molekulÄje ir aminogrupÄs (-NH2) â kitoje. âē Å ios reakcijos metu atskyla vandens molekulÄ, tai vadinama dehidratacijos reakcija (polikondensacija).
- 3. BaltymÅģ klasifikacija Pagal cheminÄ sudÄtÄŊ skirstomi ÄŊ paprastuosius (proteinus) ir sudÄtinius (proteidus). âē Paprastiems baltymams priskiriami tik tie baltymai, kurie sudaryti vien tik iÅĄ aminorÅŦgÅĄÄiÅģ. âē SudÄtiniams baltymams priskiriami baltymai, turintys nepeptidinÄ dalÄŊ, kaip pavyzdÅūiui: lipoproteinai turi lipidinÄ grupÄ, glikoproteinai â angliavandenio liekanÄ , metaloproteinai - metalo atomÄ , chromoproteinai - pigmentinÄ grupÄ.
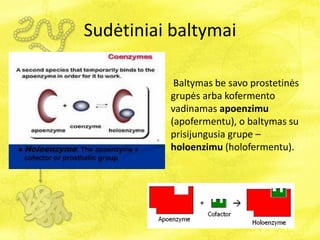
- 4. SudÄtiniai baltymai SudÄtiniÅģ baltymÅģ struktÅŦroje aptinkama nebaltyminÄ dalimis. âē Jei ÅĄi dalis yra tvirtai prijungta prie molekulÄs ir baltymui atliekant savo funkcijas ji neatsiskiria, tai ÅĄi grupÄ vadinama prostetine grupe. Pvz., hemo prostetinÄ grupÄ hemoglobine. âēJei, baltymui atliekant savo funkcijas, nebaltyminÄ dalis tai prisijungia, tai atsiskiria nuo baltymo, ji vadinama kofaktoriumi. Kofaktorius â ÄŊ fermento sudÄtÄŊ ÄŊeinanti nebaltyminÄs kilmÄs nedidelÄs molekulinÄs masÄs organinÄ medÅūiaga ar jonas, bÅŦtina fermento veikimui. Jei kofaktorius yra organinÄs kilmÄs, jis vadinamas kofermentu (coenzyme).
- 5. SudÄtiniai baltymai Baltymas be savo prostetinÄs grupÄs arba kofermento vadinamas apoenzimu (apofermentu), o baltymas su prisijungusia grupe â holoenzimu (holofermentu).
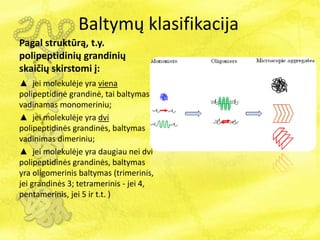
- 6. BaltymÅģ klasifikacija Pagal struktÅŦrÄ , t.y. polipeptidiniÅģ grandiniÅģ skaiÄiÅģ skirstomi ÄŊ: âē jei molekulÄje yra viena polipeptidinÄ grandinÄ, tai baltymas vadinamas monomeriniu; âē jei molekulÄje yra dvi polipeptidinÄs grandinÄs, baltymas vadinimas dimeriniu; âē jei molekulÄje yra daugiau nei dvi polipeptidinÄs grandinÄs, baltymas yra oligomerinis baltymas (trimerinis, jei grandinÄs 3; tetramerinis - jei 4, pentamerinis, jei 5 ir t.t. )
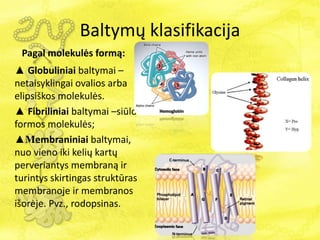
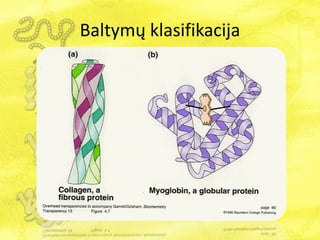
- 7. BaltymÅģ klasifikacija Pagal molekulÄs formÄ : âē Globuliniai baltymai â netaisyklingai ovalios arba elipsiÅĄkos molekulÄs. âē Fibriliniai baltymai âsiÅŦlo formos molekulÄs; âēMembraniniai baltymai, nuo vieno iki keliÅģ kartÅģ perveriantys membranÄ ir turintys skirtingas struktÅŦras membranoje ir membranos iÅĄorÄje. Pvz., rodopsinas.
- 8. BaltymÅģ klasifikacija Globuliniai baltymai âē GlobuliniÅģ baltymÅģ ilgio ir ploÄio santykis yra maÅūesnis nei 10 kartÅģ. âē Globuliniams baltymams bÅŦdingas kompaktiÅĄkas polipeptidiniÅģ grandiniÅģ susisukimas. Forma â sferinÄ arba elipsinÄ. âē Gerai tirpsta vandenyje, nesunkiai difunduoja. âēÅ iÅģ baltymÅģ pavyzdÅūiai yra hemoglobinas, insulinas, pepsinas. Fibriliniai baltymai âē FibriliniÅģ baltymÅģ ilgio ir ploÄio santykis didesnis nei 10 kartÅģ. âē Fibriliniai baltymai paprastai susideda iÅĄ keliÅģ polipeptidiniÅģ grandiniÅģ, kurios susijungia tarpusavyje kovalentiniais ir vandeniliniais ryÅĄiais. Forma â siÅŦlinÄ. âē Blogai tirpsta vandenyje,. âē FibriliniÅģ baltymÅģ pavyzdÅūiai yra kolagenas, keratinas, fibrinogenas.
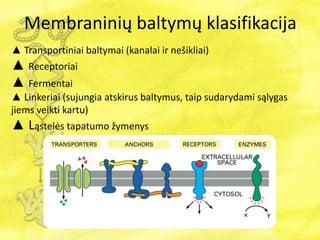
- 10. MembraniniÅģ baltymÅģ klasifikacija âē Transportiniai baltymai (kanalai ir neÅĄikliai) âē Receptoriai âē Fermentai âē Linkeriai (sujungia atskirus baltymus, taip sudarydami sÄ lygas jiems veikti kartu) âē ģĒÄ ēõģŲąðąôÄēõ tapatumo Åūymenys
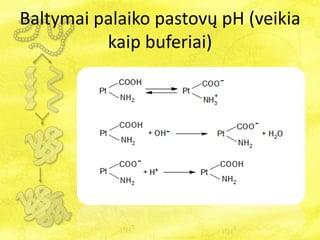
- 11. Baltymai palaiko pastovÅģ pH (veikia kaip buferiai)
- 12. Baltymai palaiko pastovÅģ pH (veikia kaip buferiai) Priklausomai nuo terpÄs pH, baltymai gali turÄti suminÄŊ nulinÄŊ, teigiamÄ arba neigiamÄ krÅŦvÄŊ. Skirtingai nuo aminorÅŦgÅĄÄiÅģ, jonizuotÅģ karboksilo grupiÅģ ar aminogrupiÅģ baltymÅģ makromolekulÄse yra labai daug.
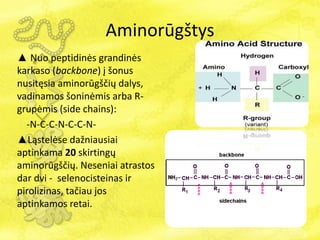
- 14. AminorÅŦgÅĄtys âē Nuo peptidinÄs grandinÄs karkaso (backbone) ÄŊ ÅĄonus nusitÄsia aminorÅŦgÅĄÄiÅģ dalys, vadinamos ÅĄoninÄmis arba R- grupÄmis (side chains): -N-C-C-N-C-C-N- âēģĒÄ ēõģŲąðąôÄēõe daÅūniausiai aptinkama 20 skirtingÅģ aminorÅŦgÅĄÄiÅģ. Neseniai atrastos dar dvi - selenocisteinas ir pirolizinas, taÄiau jos aptinkamos retai.
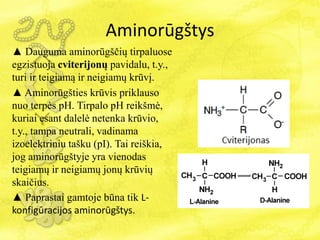
- 15. AminorÅŦgÅĄtys âē Dauguma aminorÅŦgÅĄÄiÅģ tirpaluose egzistuoja cviterijonÅģ pavidalu, t.y., turi ir teigiamÄ ir neigiamÅģ krÅŦvÄŊ. âē AminorÅŦgÅĄties krÅŦvis priklauso nuo terpÄs pH. Tirpalo pH reikÅĄmÄ, kuriai esant dalelÄ netenka krÅŦvio, t.y., tampa neutrali, vadinama izoelektriniu taÅĄku (pI). Tai reiÅĄkia, jog aminorÅŦgÅĄtyje yra vienodas teigiamÅģ ir neigiamÅģ jonÅģ krÅŦviÅģ skaiÄius. âē Paprastai gamtoje bÅŦna tik L- konfigÅŦracijos aminorÅŦgÅĄtys.
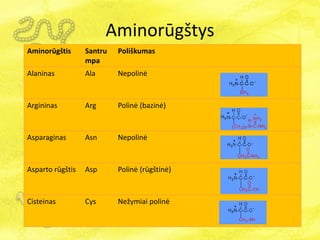
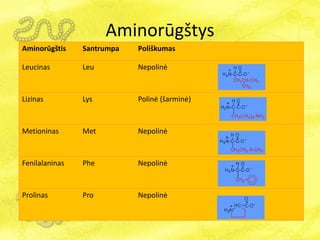
- 16. AminorÅŦgÅĄtys AminorÅŦgÅĄtis Santru mpa PoliÅĄkumas Alaninas Ala NepolinÄ Argininas Arg PolinÄ (bazinÄ) Asparaginas Asn NepolinÄ Asparto rÅŦgÅĄtis Asp PolinÄ (rÅŦgÅĄtinÄ) Cisteinas Cys NeÅūymiai polinÄ
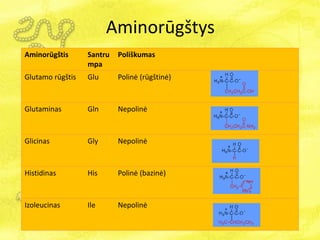
- 17. AminorÅŦgÅĄtys AminorÅŦgÅĄtis Santru mpa PoliÅĄkumas Glutamo rÅŦgÅĄtis Glu PolinÄ (rÅŦgÅĄtinÄ) Glutaminas Gln NepolinÄ Glicinas Gly NepolinÄ Histidinas His PolinÄ (bazinÄ) Izoleucinas Ile NepolinÄ
- 18. AminorÅŦgÅĄtys AminorÅŦgÅĄtis Santrumpa PoliÅĄkumas Leucinas Leu NepolinÄ Lizinas Lys PolinÄ (ÅĄarminÄ) Metioninas Met NepolinÄ Fenilalaninas Phe NepolinÄ Prolinas Pro NepolinÄ
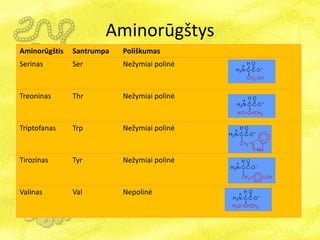
- 19. AminorÅŦgÅĄtys AminorÅŦgÅĄtis Santrumpa PoliÅĄkumas Serinas Ser NeÅūymiai polinÄ Treoninas Thr NeÅūymiai polinÄ Triptofanas Trp NeÅūymiai polinÄ Tirozinas Tyr NeÅūymiai polinÄ Valinas Val NepolinÄ
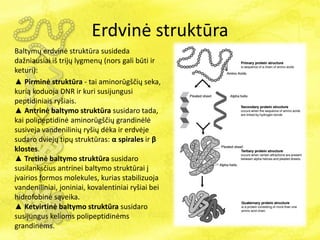
- 20. ErdvinÄ struktÅŦra BaltymÅģ erdvinÄ struktÅŦra susideda daÅūniausiai iÅĄ trijÅģ lygmenÅģ (nors gali bÅŦti ir keturi): âē PirminÄ struktÅŦra - tai aminorÅŦgÅĄÄiÅģ seka, kuriÄ koduoja DNR ir kuri susijungusi peptidiniais ryÅĄiais. âē AntrinÄ baltymo struktÅŦra susidaro tada, kai polipeptidinÄ aminorÅŦgÅĄÄiÅģ grandinÄlÄ susiveja vandeniliniÅģ ryÅĄiÅģ dÄka ir erdvÄje sudaro dviejÅģ tipÅģ struktÅŦras: Îą spirales ir Îē klostes. âē TretinÄ baltymo struktÅŦra susidaro susilanksÄius antrinei baltymo struktÅŦrai ÄŊ ÄŊvairios formos molekules, kurias stabilizuoja vandeniliniai, joniniai, kovalentiniai ryÅĄiai bei hidrofobinÄ sÄ veika. âē KetvirtinÄ baltymo struktÅŦra susidaro susijungus kelioms polipeptidinÄms grandinÄms.
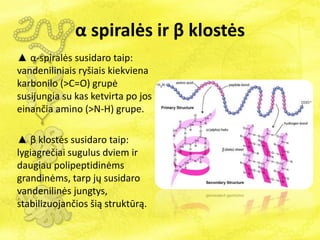
- 21. Îą spiralÄs ir Îē klostÄs âē Îą-spiralÄs susidaro taip: vandeniliniais ryÅĄiais kiekviena karbonilo (>C=O) grupÄ susijungia su kas ketvirta po jos einanÄia amino (>N-H) grupe. âē Îē klostÄs susidaro taip: lygiagreÄiai sugulus dviem ir daugiau polipeptidinÄms grandinÄms, tarp jÅģ susidaro vandenilinÄs jungtys, stabilizuojanÄios ÅĄiÄ struktÅŦrÄ .
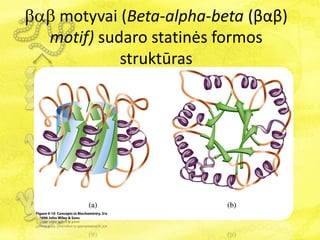
- 22. ïĒïĄïĒ motyvai (Beta-alpha-beta (ÎēÎąÎē) motif) sudaro statinÄs formos struktÅŦras
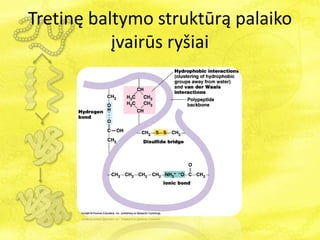
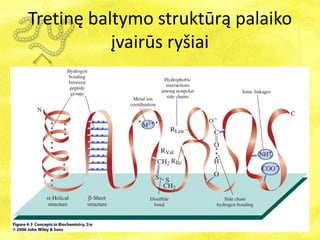
- 23. TretinÄ baltymo struktÅŦrÄ palaiko ÄŊvairÅŦs ryÅĄiai
- 24. TretinÄ baltymo struktÅŦrÄ palaiko ÄŊvairÅŦs ryÅĄiai
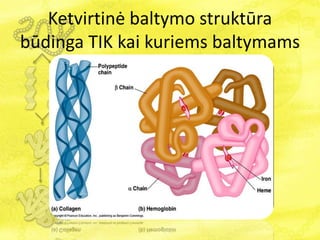
- 25. KetvirtinÄ baltymo struktÅŦra bÅŦdinga TIK kai kuriems baltymams
- 26. Å oninÄs grupÄs Å oninÄs aminorÅŦgÅĄtys skirstomos ÄŊ grupes: âē PolinÄs (turinÄios teigiamÄ arba neigiamÄ krÅŦvÄŊ), kurios gali: âĒ disocijuoti ir ÄŊgauti neigiamÄ krÅŦvÄŊ (pvz., asparto rÅŦgÅĄtis) -COOH virsta ÄŊ -COO- ; âĒ prisijungti protonÄ ir ÄŊgauti teigiamÄ (pvz., lizinas) krÅŦvÄŊ -NH2 virsta -NH3 + . âē NeÅūymiai polinÄs (turinÄios -OH ir -NH2 grupes, kurios turi dalinius teigiamus arba dalinius neigiamus krÅŦvius (pvz., treoninas). âē NepolinÄs (hidrofobinÄs) â ÅĄoninÄse grupÄse turi aromatinÄ grupÄ (pvz., tirptofanas) arba yra sudarytos iÅĄ alifatiniÅģ (neturinÄiÅģ ciklo) daliÅģ (pvz., izoleucinas). âē Tio grupÄ (-SH) grupÄs â sudaro nepolines molekuliÅģ dalis, vadinamas disulfidiniais tilteliais (-S-S-). Svarbiausia aminorÅŦgÅĄtis, turinti -SH grupÄ, yra cisteinas.
- 27. DenatÅŦracija âē Baltymo erdvinÄ struktÅŦra lemia jo atliekamas funkcijas. Toks baltymas, kuris turi natÅŦraliÄ konformacijÄ , t.y., atlieka jam bÅŦdingas funkcijas, vadinamas natyviu. âē Paveikus baltymÄ tokiai s veiksniais kaip temperatÅŦra, pH, organiniais tirpikliais, ÄŊvyksta jo dentaÅŦracija. DenatÅŦruotas baltymas praranda funkcinÄŊ aktyvumÄ . âē Kai kuriems baltymams bÅŦdinga renatÅŦracija â procesas, kurio metu denatÅŦruotas baltymas atgauna natyviÄ formÄ .
- 28. BaltymÅģ gryninimo metodai 1.IÅĄsÅŦdymas IÅĄsÅŦdymas remiasi jÅģ iÅĄskirtiniu tirpumu ÄŊvairios koncentracijos druskÅģ tirpaluose. DaÅūniausiai iÅĄsÅŦdyti naudojamos ÄŊvairios amonio sulfato (NH4)2SO4 koncentracijos.
- 29. DializÄ atliekama naudojant pusiau pralaidÅūias membranas, kaip pavyzdÅūiui, celofanÄ . Tokios membranos praleidÅūia tik tam tikro dydÅūio molekules, o didesnÄs yra sulaikomos. BaltymÅģ gryninimo metodai 2.DializÄ
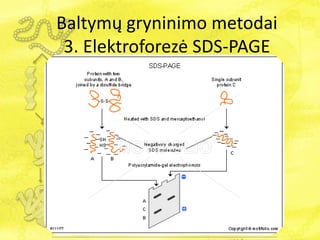
- 30. BaltymÅģ gryninimo metodai 3. ElektroforezÄ SDS-PAGE SDS-PAGE â tai natrio dodecilsulfato poliakrilamidinio gelio elektroforezÄ, kuri atliekama denatÅŦruojanÄiomis sÄ lygomis. NDS yra anijoninis detergentas, kuris suteikia baltymams neigiamÄ krÅŦvÄŊ. Tad paveikus baltymÄ SDSu, jis tampa neigiamas. PAGE atskiria skirtingus baltymus pagal jÅģ molekulinÄ masÄ.
- 31. Norint atlikti baltymÅģ iÅĄgryninimÄ elektroforezÄs metodu, bÅŦtina sukurti denatÅŦravimo terpÄ. Kaip buvo minÄta praeitoje skaidrÄje, viena iÅĄ medÅūiagÅģ, denatÅŦruojanÄiÅģ baltymus, yra SDS. Å ioje PAGE reakcijoje taip pat naudojami: EDTA â medÅūiaga, prisijungianti divalenÄius katijonus, todÄl sumaÅūina proteaziÅģ, kuriÅģ kofaktoriai yra tokie divalenÄiai metalai kaip magnis ir kalcis, aktyvumÄ . Tris buferis reikalingas pastovaus pH palaikymui. Glicerolis â alkoholis, kuris neleidÅūia mÄginiui iÅĄkilti ÄŊ pavirÅĄiÅģ iÅĄ ÅĄulinÄlio. Bromfenolio mÄlis yra daÅūas, kurio dÄka galime sekti elektroforezÄs eigÄ . Ditiotreitolis (DTT) yra reduktorius, kuris redukuoja disulfidines jungtis tarp cisteino molekuliÅģ. BaltymÅģ gryninimo metodai 3. ElektroforezÄ SDS-PAGE
- 32. BaltymÅģ gryninimo metodai 3. ElektroforezÄ SDS-PAGE
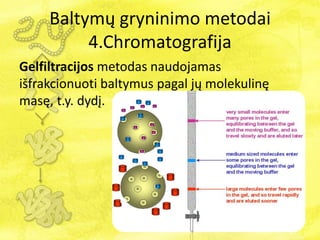
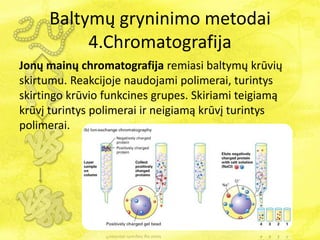
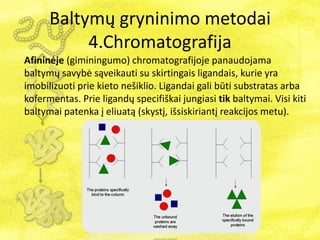
- 33. BaltymÅģ gryninimo metodai 4.Chromatografija Yra keturios pagrindinÄs chromatografijos rÅŦÅĄys: 1. JonÅģ mainÅģ 2. Gelfiltracijos 3. AfininÄ 4. HidrofobinÄs sÄ veikos
- 34. BaltymÅģ gryninimo metodai 4.Chromatografija Gelfiltracijos metodas naudojamas iÅĄfrakcionuoti baltymus pagal jÅģ molekulinÄ masÄ, t.y. dydÄŊ.
- 35. BaltymÅģ gryninimo metodai 4.Chromatografija JonÅģ mainÅģ chromatografija remiasi baltymÅģ krÅŦviÅģ skirtumu. Reakcijoje naudojami polimerai, turintys skirtingo krÅŦvio funkcines grupes. Skiriami teigiamÄ krÅŦvÄŊ turintys polimerai ir neigiamÄ krÅŦvÄŊ turintys polimerai.
- 36. BaltymÅģ gryninimo metodai 4.Chromatografija AfininÄje (giminingumo) chromatografijoje panaudojama baltymÅģ savybÄ sÄ veikauti su skirtingais ligandais, kurie yra imobilizuoti prie kieto neÅĄiklio. Ligandai gali bÅŦti substratas arba kofermentas. Prie ligandÅģ specifiÅĄkai jungiasi tik baltymai. Visi kiti baltymai patenka ÄŊ eliuatÄ (skystÄŊ, iÅĄsiskiriantÄŊ reakcijos metu).
- 37. BaltymÅģ gryninimo metodai 4.Chromatografija HidrofobinÄs sÄ veikos metu hidrofobinÄs baltymo dalys jungiasi prie tam tikrÅģ vamzdelio vietÅģ. DidelÄ druskÅģ koncentracija tirpale stabilizuoja baltymus, todÄl padidÄja baltymÅģ hidrofobiniÅģ daliÅģ sÄ veika su vamzdelio sienelÄmis. KeiÄiant pilamo druskos tirpalo koncentracijÄ , keiÄiasi baltymÅģ hidrofobinÄ sÄ veika su vamzdeliu, todÄl galima iÅĄskirti skirtingus baltymus.