ЯИЂЯИБЯИ░ЯИџЯИДЯИЎЯИЂЯИ▓ЯИБЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯИЦЯИ┤ЯИІЯИ┤ЯИф (Electrolysis Chemistry)
- 2. ЯИЌЯИџЯИЌЯИДЯИЎ Я╣ђЯИІЯИЦЯИЦЯ╣їЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓Я╣ђЯИёЯИАЯИхЯ╣ЂЯИџЯ╣ѕЯИЄЯИГЯИГЯИЂЯ╣ёЯИћЯ╣ЅЯ╣ђЯИЏЯ╣ЄЯИЎ 2 ЯИіЯИЎЯИ┤ЯИћ ЯИёЯИиЯИГ 1. Я╣Х─ЯИІЯИЦЯИЦЯ╣їЯИЂЯИ▒ЯИЦЯИДЯИ▓ЯИЎЯИ┤ЯИЂ(Galvanic cell) 2. Я╣ђЯИІЯИЦЯИЦЯ╣їЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯИ┤ЯИЂ(Electrolytic cell) ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓Я╣ђЯИёЯИАЯИх Рєњ ЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ ЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ Рєњ ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓Я╣ђЯИёЯИАЯИх Я╣ђЯИБЯИхЯИбЯИЂЯИЂЯИБЯИ░ЯИџЯИДЯИЎЯИЂЯИ▓ЯИБЯИЌЯИхЯ╣ѕЯ╣ђЯИЂЯИ┤ЯИћЯИѓЯИХЯ╣ЅЯИЎЯ╣ЃЯИЎЯ╣ђЯИІЯИЦЯИЦЯ╣їЯИДЯ╣ѕЯИ▓ ЯИЂЯИБЯИ░ЯИџЯИДЯИЂЯИ▓ЯИБЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯИЦЯИ┤ЯИІЯИ┤ЯИф
- 3. ЯИФЯИБЯИиЯИГ ЯИЂЯИБЯИ░ЯИџЯИДЯИЎЯИЂЯИ▓ЯИБЯ╣ЂЯИбЯИЂЯИфЯИ▓ЯИБЯИћЯ╣ЅЯИДЯИбЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ ЯИёЯИиЯИГ ЯИЂЯИБЯИ░ЯИџЯИДЯИЎЯИЂЯИ▓ЯИБЯИЌЯИхЯ╣ѕЯИЋЯ╣ЅЯИГЯИЄЯИГЯИ▓ЯИеЯИ▒ЯИбЯИъЯИЦЯИ▒ЯИЄЯИЄЯИ▓ЯИЎЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ЯИѕЯИ▓ЯИЂЯИаЯИ▓ЯИбЯИЎЯИГЯИЂ Я╣ђЯИѓЯ╣ЅЯИ▓Я╣ёЯИЏЯИаЯИ▓ЯИбЯ╣ЃЯИЎЯ╣ђЯИІЯИЦЯИЦЯ╣їЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓Я╣ђЯИёЯИАЯИхЯ╣ђЯИъЯИиЯ╣ѕЯИГЯ╣ЃЯИФЯ╣ЅЯ╣ђЯИЂЯИ┤ЯИћЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓Я╣ђЯИёЯИАЯИхЯ╣ЂЯИЦЯИ░ Я╣ђЯИЂЯИ┤ЯИћЯИфЯИ▓ЯИБЯ╣ЃЯИФЯИАЯ╣ѕ ЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯИЦЯИ┤ЯИІЯИ┤ЯИф (Electrolysis) Я╣ђЯИІЯИЦЯИЦЯ╣їЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓Я╣ђЯИёЯИАЯИхЯИЌЯИхЯ╣ѕЯ╣ђЯИЂЯИ┤ЯИћЯИЂЯИБЯИ░ЯИџЯИДЯИЎЯИЂЯИ▓ЯИБЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯИЦЯИ┤ЯИІЯИ┤ЯИф Я╣ђЯИБЯИхЯИбЯИЂЯИДЯ╣ѕЯИ▓ Я╣Х─ЯИІЯИЦЯИЦЯ╣їЯИГЯИ┤Я╣Х─ЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯ╣ї
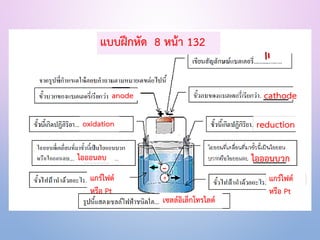
- 4. Я╣Х─ЯИІЯИЦЯИЦЯ╣їЯИГЯИ┤Я╣Х─ЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯ╣ї (Electrolytic cell) ЯИфЯ╣ѕЯИДЯИЎЯИЏЯИБЯИ░ЯИЂЯИГЯИџ 1. Я╣ЂЯИФЯИЦЯ╣ѕЯИЄЯ╣ЃЯИФЯ╣ЅЯИъЯИЦЯИ▒ЯИЄЯИЄЯИ▓ЯИЎЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓(external circuit) 2.ЯИѓЯИ▒Я╣ЅЯИДЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ (electrode) 2 ЯИѓЯИ▒Я╣ЅЯИД ЯИёЯИиЯИГ ЯИѓЯИ▒Я╣ЅЯИД cathode Я╣ЂЯИЦЯИ░ЯИѓЯИ▒Я╣ЅЯИД anode ЯИГЯИГЯИЂЯИІЯИ┤Я╣ђЯИћЯИіЯИ▒ЯИЎ Рєњ Я╣ђЯИЂЯИ┤ЯИћЯИЌЯИхЯ╣ѕЯИѓЯИ▒Я╣ЅЯИДЯ╣ЂЯИГЯ╣ѓЯИЎЯИћ (ЯИѓЯИ▒Я╣ЅЯИДЯИџЯИДЯИЂ) ЯИБЯИхЯИћЯИ▒ЯИЂЯИіЯИ▒ЯИЎ Рєњ Я╣ђЯИЂЯИ┤ЯИћЯИЌЯИхЯ╣ѕЯИѓЯИ▒Я╣ЅЯИДЯ╣ЂЯИёЯ╣ѓЯИЌЯИћ (ЯИѓЯИ▒Я╣ЅЯИДЯИЦЯИџ) 3. ЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИбЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯ╣ї
- 5. ЯИФЯИЦЯИ▒ЯИЂЯИЂЯИ▓ЯИБЯИЌЯИ▓ЯИЄЯИ▓ЯИЎ Я╣ёЯИГЯИГЯИГЯИЎЯИЦЯИџ Рєњ ЯИДЯИ┤Я╣ѕЯИЄЯ╣ёЯИЏЯИЌЯИхЯ╣ѕЯИѓЯИ▒Я╣ЅЯИДЯ╣ЂЯИГЯ╣ѓЯИЎЯИћ (ЯИѓЯИ▒Я╣ЅЯИДЯИџЯИДЯИЂ) Рєњ Я╣ђЯИЂЯИ┤ЯИћЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИГЯИГЯИЂЯИІЯИ┤Я╣ђЯИћЯИіЯИ▒ЯИЎ Я╣ёЯИГЯИГЯИГЯИЎЯИџЯИДЯИЂ Рєњ ЯИДЯИ┤Я╣ѕЯИЄЯ╣ёЯИЏЯИЌЯИхЯ╣ѕЯИѓЯИ▒Я╣ЅЯИДЯ╣ЂЯИёЯ╣ѓЯИЌЯИћ (ЯИѓЯИ▒Я╣ЅЯИДЯИЦЯИџ) Рєњ Я╣ђЯИЂЯИ┤ЯИћЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИБЯИхЯИћЯИ▒ЯИЂЯИіЯИ▒ЯИЎ
- 7. ЯИфЯИ▓ЯИБЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯ╣їЯИЌЯИхЯ╣ѕЯИЎЯИ┤ЯИбЯИАЯ╣ЃЯИіЯ╣ЅЯ╣ЃЯИЎЯ╣Х─ЯИІЯИЦЯИЦЯ╣їЯИГЯИ┤Я╣Х─ЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯ╣ї ЯИёЯИиЯИГ 1. ЯИфЯИ▓ЯИБЯИЏЯИБЯИ░ЯИЂЯИГЯИџЯ╣ёЯИГЯИГЯИГЯИЎЯИ┤ЯИЂЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИД 2. ЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИбЯИЌЯИхЯ╣ѕЯИАЯИхЯИЎЯ╣ЅЯИ▓Я╣ђЯИЏЯ╣ЄЯИЎЯИЋЯИ▒ЯИДЯИЌЯИ▓ЯИЦЯИ░ЯИЦЯИ▓ЯИб 3. ЯИЎЯ╣ЅЯИ▓
- 8. 1. ЯИЂЯИ▓ЯИБЯ╣ЂЯИбЯИЂЯИфЯИ▓ЯИБЯИфЯИ▓ЯИБЯИЏЯИБЯИ░ЯИЂЯИГЯИџЯ╣ёЯИГЯИГЯИГЯИЎЯИ┤ЯИЂЯИЌЯИхЯ╣ѕЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИДЯИћЯ╣ЅЯИДЯИбЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ ЯИЋЯИ▒ЯИДЯИГЯИбЯ╣ѕЯИ▓ЯИЄ ЯИЂЯИ▓ЯИБЯ╣ЂЯИбЯИЂ NaCl ЯИЌЯИхЯ╣ѕЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИДЯИћЯ╣ЅЯИДЯИбЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ Anode (ЯИГЯИГЯИЂЯИІЯИ┤Я╣ђЯИћЯИіЯИ▒ЯИЎ) : 2 ClРѕњ Cl2(g)+ 2eРђЊ Cathode (ЯИБЯИхЯИћЯИ▒ЯИЂЯИіЯИ▒ЯИЎ) : 2Na++ 2eРѕњ 2Na(l) ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИБЯИДЯИА : 2ClРѕњ + 2 Na+ Cl2(g) + 2Na(l)
- 9. ЯИЋЯИ▒ЯИДЯИГЯИбЯ╣ѕЯИ▓ЯИЄ ЯИЂЯИ▓ЯИБЯ╣ЂЯИбЯИЂ CaCl2 ЯИЌЯИхЯ╣ѕЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИДЯИћЯ╣ЅЯИДЯИбЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ Anode (ЯИГЯИГЯИЂЯИІЯИ┤Я╣ђЯИћЯИіЯИ▒ЯИЎ) : 2 ClРѕњ Cl2(g)+ 2eРђЊ Cathode (ЯИБЯИхЯИћЯИ▒ЯИЂЯИіЯИ▒ЯИЎ) : Ca 2+ + 2eРђЊ Ca(l) ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИБЯИДЯИА : 2 ClРѕњ + Ca 2+ Cl2(g) + Ca(l)
- 12. K+ (l) + e- -----> K (l) 2IРѕњ (l) -----> I2 (g) + 2e- 2K+ + 2IРѕњ (l) -----> 2K(l) + I2 (g) oxidation reduction K+ K (l) IРѕњ I2
- 13. Я╣ЂЯИџЯИџЯИЮЯИХЯИЂЯИФЯИ▒ЯИћ ЯИфЯИ▓ЯИБЯ╣ёЯИГЯИГЯИГЯИЎЯИ┤ЯИЂЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИД ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИЌЯИхЯ╣ѕЯ╣ЂЯИГЯ╣ѓЯИЎЯИћ ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИЌЯИхЯ╣ѕЯ╣ЂЯИёЯ╣ѓЯИЌЯИћ NaI CuBr2 CaF2 2IРѕњ (l) -----> I2 (g) + 2e- 2BrРѕњ (l) -----> Br2 (g) + 2e- 2FРѕњ (l) -----> F2 (g) + 2e- Na+ (l) + e- -----> Na (l) Cu2+ (l) + 2e- -----> Cu(l) Ca2+ (l) + 2e- -----> Ca(l)
- 14. 2.ЯИЂЯИ▓ЯИБЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯИЦЯИ┤ЯИІЯИ┤ЯИфЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИбЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯ╣їЯИЌЯИхЯ╣ѕЯ╣ЃЯИіЯ╣ЅЯИЎЯ╣ЅЯИ▓Я╣ђЯИЏЯ╣ЄЯИЎЯИЋЯИ▒ЯИДЯИЌЯИ▓ЯИЦЯИ░ЯИЦЯИ▓ЯИб ЯИЋЯИб. ЯИЂЯИ▓ЯИБЯ╣ЂЯИбЯИЂЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИб CuSO4 ЯИћЯ╣ЅЯИДЯИбЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ ЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИб CuSO4 ЯИЏЯИБЯИ░ЯИЂЯИГЯИџЯИћЯ╣ЅЯИДЯИб Cu2+ SO4 2-Я╣ЂЯИЦЯИ░ H2O
- 15. Я╣ђЯИАЯИиЯ╣ѕЯИГЯИюЯ╣ѕЯИ▓ЯИЎЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ЯИѕЯИ▓ЯИЂЯ╣ЂЯИџЯИЋЯ╣ђЯИЋЯИГЯИБЯИх Я╣ђЯИѓЯ╣ЅЯИ▓Я╣ёЯИЏЯ╣ЃЯИЎЯИГЯИИЯИЏЯИЂЯИБЯИЊЯ╣їЯ╣ЂЯИбЯИЂЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИбЯИћЯ╣ЅЯИДЯИб ЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓Я╣ђЯИЂЯИ┤ЯИћЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ ЯИћЯИ▒ЯИЄЯИЎЯИхЯ╣Ѕ Я╣ЂЯИёЯ╣ѓЯИЌЯИћ (ЯИѓЯИ▒Я╣ЅЯИДЯИЦЯИџ) ЯИЌЯИ▒Я╣ЅЯИЄ Cu 2+ Я╣ЂЯИЦЯИ░ H2O ЯИАЯИхЯ╣ѓЯИГЯИЂЯИ▓ЯИфЯИБЯИ▒ЯИџЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯИЋЯИБЯИГЯИЎ Я╣ђЯИЏЯИБЯИхЯИбЯИџЯ╣ђЯИЌЯИхЯИбЯИџЯИЂЯИ▓ЯИБЯИБЯИ▒ЯИџ eРђЊ ЯИѕЯИ▓ЯИЂЯИёЯ╣ѕЯИ▓ EO ЯИѓЯИГЯИЄЯИфЯИГЯИЄЯИёЯИБЯИХЯ╣ѕЯИЄЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИћЯИ▒ЯИЄЯИЎЯИхЯ╣Ѕ Cu 2+(aq) + 2eРђЊ Рєњ Cu(s) EO = +0.34 V 2H2O(l) + 2eРђЊ Рєњ H2(g) + 2OHРђЊ(aq) EO = РђЊ0.83 V Я╣ђЯИЂЯИ┤ЯИћЯИћЯИхЯИЂЯИДЯ╣ѕЯИ▓
- 17. Я╣ЂЯИГЯ╣ѓЯИЎЯИћ (ЯИѓЯИ▒Я╣ЅЯИДЯИЌЯИхЯ╣ѕЯИЋЯ╣ѕЯИГЯИГЯИбЯИ╣Я╣ѕЯИЂЯИ▒ЯИџЯИѓЯИ▒Я╣ЅЯИДЯИџЯИДЯИЂЯИѓЯИГЯИЄЯ╣ЂЯИџЯИЋЯ╣ђЯИЋЯИГЯИБЯИх) Я╣ЃЯИЎЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИбЯИАЯИх SO4 2- Я╣ЂЯИЦЯИ░ H2O ЯИЌЯИхЯ╣ѕЯИАЯИхЯ╣ѓЯИГЯИЂЯИ▓ЯИфЯ╣ЃЯИФЯ╣ЅЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯИЋЯИБЯИГЯИЎЯИФЯИБЯИиЯИГЯ╣ђЯИЂЯИ┤ЯИћЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИГЯИГЯИЂЯИІЯИ┤Я╣ђЯИћЯИіЯИ▒ЯИЎ Я╣ЂЯИЋЯ╣ѕЯИёЯ╣ѕЯИ▓ EO ЯИѓЯИГЯИЄЯИфЯИГЯИЄЯИёЯИБЯИХЯ╣ѕЯИЄЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓Я╣ђЯИЏЯ╣ЄЯИЎЯИћЯИ▒ЯИЄЯИЎЯИхЯ╣Ѕ ┬й S2O8 2-(aq) + eРђЊ Рєњ SO4 2-(aq) EO = +2.01 V 1/2O2(g) + 2H+(aq) + 2eРђЊ Рєњ H2O(l) EO = +1.23 V ЯИЂЯИЦЯИ▒ЯИџЯИфЯИАЯИЂЯИ▓ЯИБЯ╣ЃЯИФЯ╣Ѕ Я╣ђЯИЏЯ╣ЄЯИЎЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИГЯИГЯИЂЯИІЯИ┤Я╣ђЯИћЯИіЯИ▒ЯИЎ Я╣ђЯИъЯИиЯ╣ѕЯИГЯ╣ЃЯИФЯ╣ЅЯИфЯИГЯИћЯИёЯИЦЯ╣ЅЯИГЯИЄЯИЂЯИ▒ЯИџЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИЌЯИхЯ╣ѕЯИѕЯИ░Я╣ђЯИЂЯИ┤ЯИћЯИѓЯИХЯ╣ЅЯИЎЯИЌЯИхЯ╣ѕ Я╣ЂЯИГЯ╣ѓЯИЎЯИћ ЯИћЯИ▒ЯИЄЯИЎЯИхЯ╣Ѕ H2O(l) Рєњ 1/2 O2(g) + 2H+(aq) + 2eРђЊ EO = РђЊ1.23 V Eo ЯИЎЯ╣ЅЯИГЯИб Я╣ђЯИЂЯИ┤ЯИћЯИћЯИхЯИЂЯИДЯ╣ѕЯИ▓
- 19. ЯИќЯИХЯИЄЯ╣ЂЯИАЯ╣ЅЯ╣ЃЯИЎЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИѕЯИ░ЯИАЯИх H+ Я╣ђЯИЂЯИ┤ЯИћЯИѓЯИХЯ╣ЅЯИЎЯИћЯ╣ЅЯИДЯИб Я╣ЂЯИЦЯИ░ЯИГЯИ▓ЯИѕЯИБЯИ▒ЯИџЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯИЋЯИБЯИГЯИЎЯ╣ђЯИЂЯИ┤ЯИћЯ╣ђЯИЏЯ╣ЄЯИЎЯ╣ЂЯИЂЯ╣іЯИф H2 Я╣ЂЯИЋЯ╣ѕЯ╣ђЯИАЯИиЯ╣ѕЯИГ Я╣ђЯИЏЯИБЯИхЯИбЯИџЯ╣ђЯИЌЯИхЯИбЯИџЯИёЯ╣ѕЯИ▓ EO ЯИѕЯИ▓ЯИЂЯИёЯИБЯИХЯ╣ѕЯИЄЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИЋЯ╣ѕЯИГЯ╣ёЯИЏЯИЎЯИхЯ╣Ѕ Cu2+(aq) + 2eРђЊ Рєњ Cu(s) EO = +0.34 V 2H+(aq) + 2eРђЊ Рєњ H2(aq) EO= 0.00 V Я╣ђЯИЂЯИ┤ЯИћЯИћЯИхЯИЂЯИДЯ╣ѕЯИ▓ ЯИфЯИБЯИИЯИЏ ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИЂЯИ▓ЯИБЯ╣ЂЯИбЯИЂЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИб CuSO4 ЯИћЯ╣ЅЯИДЯИбЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ Я╣ЂЯИГЯ╣ѓЯИЎЯИћ : H2O(l) Рєњ O2(g) + 2H+(aq) + 2eРђЊ EO = Рѕњ1.23 V Я╣ЂЯИёЯ╣ѓЯИЌЯИћ : Cu2+(aq) + 2eРђЊ Рєњ Cu(s) EO = + 0.34 V ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИБЯИДЯИА : Cu 2+(aq) + H2O(l) Рєњ Cu (s) + O2(g) + 2H+(aq) = -0.89 V o cell E = РђЊ
- 20. ЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯИЦЯИ┤ЯИІЯИ┤ЯИфЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИб Na2SO4 Я╣ЃЯИЎЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИб Na2SO4 ЯИѕЯИ░ ЯИЏЯИБЯИ░ЯИЂЯИГЯИџЯИћЯ╣ЅЯИДЯИб Na+, SO4 2- Я╣ЂЯИЦЯИ░ЯИбЯИ▒ЯИЄЯИАЯИхЯ╣ѓЯИАЯ╣ђЯИЦЯИЂЯИИЯИЦ H2O
- 22. ЯИЋЯИ▒ЯИДЯИГЯИбЯ╣ѕЯИ▓ЯИЄ ЯИЂЯИ▓ЯИБЯ╣ЂЯИбЯИЂЯИфЯИЦЯИ▓ЯИбЯИ╚е╣ЅЯИ│ЯИћЯ╣ЅЯИДЯИбЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ ЯИГЯИИЯИЏЯИЂЯИБЯИЊЯ╣їЯИЌЯИхЯ╣ѕЯ╣ЃЯИіЯ╣Ѕ 1. Я╣ЂЯИџЯИЋЯ╣ђЯИЋЯИГЯИБЯИхЯ╣ѕ 2. Pt electrode 3. ЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИб H2SO4 Anode : 2H2O(l) 1/2O2(g) + 2H+(aq) + 2eРђЊ Cathode : 2H+(aq) + 2eРђЊ H2 (g) ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИБЯИДЯИА : H2O(l) 1/2O2(g) + H2 (g)
- 23. Я╣ЂЯИЂЯИБЯ╣їЯ╣ёЯИЪЯИЋЯ╣ї cathode anode K+ Br- H2O K+ BrРѕњ -2.92 - 0.83 + 1.23 + 1.08 K+ H2O H2 ,OHРѕњ 2BrРѕњ --- > Br2 +2eРѕњ Br2 2H2O + 2e -- > H2 +2OHРѕњ 2H2O + 2BrРѕњ -- > H2 +2OHРѕњ + Br2 BrРѕњ BrРѕњ
- 24. Pt cathode - 0.83 H2O H+ SO4 2Рѕњ anode + 1.23 H+ SO4 2Рѕњ 0 + 2.01 H+ H2O H+ H2 2H+ + 2e- Рєњ H2 H2O H2O SO4 2Рѕњ O2 , H+ H2O -- > ┬й O2 +2H+ + 2e H2O -- > ┬й O2 + H2
- 25. Я╣ЂЯИџЯИџЯИЮЯИХЯИЂЯИФЯИ▒ЯИћ ЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИбЯИЌЯИхЯ╣ѕЯ╣ЃЯИіЯ╣ЅЯ╣ЂЯИбЯИЂ ЯИћЯ╣ЅЯИДЯИбЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ ЯИюЯИЦЯИ┤ЯИЋЯИаЯИ▒ЯИЊЯИЉЯ╣їЯИЌЯИхЯ╣ѕЯ╣ЂЯИГЯ╣ѓЯИЎЯИћ(+) ЯИюЯИЦЯИ┤ЯИЋЯИаЯИ▒ЯИЊЯИЉЯ╣їЯИЌЯИхЯ╣ѕЯ╣ЂЯИёЯ╣ѓЯИЌЯИћ(-) KI MgBr2 LiCl H2(g), OH- H2(g), OH- H2(g), OH - I2(g) Br2(g) O2(g), H+
- 27. 1. ЯИЂЯИ▓ЯИБЯИюЯИЦЯИ┤ЯИЋЯ╣ѓЯИЦЯИФЯИ░Я╣ѓЯИІЯ╣ђЯИћЯИхЯИбЯИА Я╣ЃЯИіЯ╣ЅЯИГЯИИЯИЏЯИЂЯИБЯИЊЯ╣їЯИЌЯИхЯ╣ѕЯ╣ђЯИБЯИхЯИбЯИЂЯИДЯ╣ѕЯИ▓ Down Cell ЯИГЯИИЯИЏЯИЂЯИБЯИЊЯ╣ї 1. Я╣ЂЯИФЯИЦЯ╣ѕЯИЄЯИѕЯ╣ѕЯИ▓ЯИбЯ╣ёЯИЪ 2. cathode :Я╣ђЯИФЯИЦЯ╣ЄЯИЂ anode : Я╣ЂЯИЂЯИБЯ╣їЯ╣ёЯИЪЯИЋЯ╣ї 3. NaCl ЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИД Anode : 2 ClРѕњ Cl2(g)+ 2eРѕњ Cathode : 2 Na++ 2e Рѕњ 2Na(l) ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИБЯИДЯИА : 2 ClРѕњ + 2 Na+ Cl2(g) + 2Na(l)
- 28. 2 ЯИЂЯИ▓ЯИБЯИюЯИЦЯИ┤ЯИЋЯ╣ѓЯИЦЯИФЯИ░ЯИГЯИ░ЯИЦЯИ╣ЯИАЯИ┤Я╣ђЯИЎЯИхЯИбЯИА (ЯИЂЯИБЯИ░ЯИџЯИДЯИЎЯИЂЯИ▓ЯИБЯИ«ЯИГЯИЦ) Я╣ЃЯИЎЯИўЯИБЯИБЯИАЯИіЯИ▓ЯИЋЯИ┤ЯИъЯИџЯИГЯИ░ЯИЦЯИ╣ЯИАЯИ┤Я╣ђЯИЎЯИхЯИбЯИАЯ╣ЃЯИЎЯИБЯИ╣ЯИЏЯИфЯИ▓ЯИБЯИЏЯИБЯИ░ЯИЂЯИГЯИџ Я╣ђЯИіЯ╣ѕЯИЎ Я╣ЂЯИБЯ╣ѕЯИџЯИГЯИЂЯ╣ёЯИІЯИЋЯ╣ї ЯИАЯИх Al2O3№ЃЌ2H2O ЯИБЯ╣ЅЯИГЯИбЯИЦЯИ░ 85 Я╣ѓЯИћЯИбЯИАЯИДЯИЦ Я╣ђЯИАЯИиЯ╣ѕЯИГЯИЎЯИ▓ЯИАЯИ▓Я╣ЂЯИбЯИЂЯИфЯИ┤Я╣ѕЯИЄЯ╣ђЯИѕЯИиЯИГЯИЏЯИЎЯИГЯИГЯИЂЯ╣ЂЯИЦЯ╣ЅЯИДЯ╣ђЯИюЯИ▓ ЯИЌЯИхЯ╣ѕЯИГЯИИЯИЊЯИФЯИаЯИ╣ЯИАЯИ┤ 120OC ЯИѕЯИ░Я╣ёЯИћЯ╣ЅЯИГЯИ░ЯИЦЯИ╣ЯИАЯИ┤ЯИЎЯИ▓ЯИЌЯИхЯ╣ѕЯ╣ёЯИАЯ╣ѕЯИАЯИхЯИЎЯ╣ЅЯИ▓ ЯИюЯИЦЯИХЯИЂЯИёЯИиЯИГ Al2O3 Я╣ђЯИЏЯ╣ЄЯИЎЯИДЯИ▒ЯИЋЯИќЯИИЯИћЯИ┤ЯИџЯИЌЯИхЯ╣ѕЯ╣ЃЯИіЯ╣ЅЯ╣ЃЯИЎЯИЂЯИ▓ЯИБЯИюЯИЦЯИ┤ЯИЋ ЯИГЯИ░ЯИЦЯИ╣ЯИАЯИ┤Я╣ђЯИЎЯИхЯИбЯИА ЯИЂЯИ▓ЯИБЯИюЯИЦЯИ┤ЯИЋЯИГЯИ░ЯИЦЯИ╣ЯИАЯИ┤Я╣ђЯИЎЯИхЯИбЯИАЯИАЯИх 2 ЯИДЯИ┤ЯИўЯИх ЯИћЯИ▒ЯИЄЯИЎЯИхЯ╣Ѕ
- 29. 4.2 ЯИЂЯИ▓ЯИБЯИюЯИЦЯИ┤ЯИЋЯ╣ѓЯИЦЯИФЯИ░ЯИГЯИ░ЯИЦЯИ╣ЯИАЯИ┤Я╣ђЯИЎЯИхЯИбЯИА (ЯИЂЯИБЯИ░ЯИџЯИДЯИЎЯИЂЯИ▓ЯИБЯИ«ЯИГЯИЦ) ЯИДЯИ┤ЯИўЯИхЯИЌЯИхЯ╣ѕ 1 ЯИќЯИЦЯИИЯИЄЯ╣ЂЯИБЯ╣ѕЯИџЯИГЯИЂЯ╣ёЯИІЯИЋЯ╣їЯИћЯ╣ЅЯИДЯИбЯИёЯИДЯИ▓ЯИАЯИБЯ╣ЅЯИГЯИЎЯ╣ЂЯИЦЯ╣ЅЯИДЯИБЯИхЯИћЯИ┤ЯИДЯИІЯ╣ї Al2O3 Я╣ђЯИъЯИиЯ╣ѕЯИГЯ╣ЃЯИФЯ╣ЅЯ╣ёЯИћЯ╣ЅЯИГЯИ░ЯИЦЯИ╣ЯИАЯИ┤Я╣ђЯИЎЯИхЯИбЯИА Я╣ЂЯИЋЯ╣ѕ ЯИДЯИ┤ЯИўЯИхЯИЎЯИхЯ╣ЅЯИФЯИ▓ЯИЋЯИ▒ЯИДЯИБЯИхЯИћЯИ┤ЯИДЯИІЯ╣їЯИЌЯИхЯ╣ѕЯ╣ђЯИФЯИАЯИ▓ЯИ░ЯИфЯИАЯИбЯИ▓ЯИЂ ЯИДЯИ┤ЯИўЯИхЯИЌЯИхЯ╣ѕ 2 Я╣ЂЯИбЯИЂЯИћЯ╣ЅЯИДЯИбЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ ЯИЎЯИ▓Al2O3 ЯИІЯИХЯ╣ѕЯИЄЯИАЯИхЯИѕЯИИЯИћЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИДЯИфЯИ╣ЯИЄ 2045 OC ЯИАЯИ▓ЯИюЯИфЯИАЯИЂЯИ▒ЯИџЯ╣ЂЯИБЯ╣ѕЯ╣ёЯИёЯИБЯ╣ѓЯИГЯ╣ёЯИЦЯИЋЯ╣ї Na3AlF6 ЯИЌЯИхЯ╣ѕ ЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИД ЯИѕЯИ░Я╣ёЯИћЯ╣ЅЯИѓЯИГЯИЄЯИюЯИфЯИАЯИФЯИЦЯИГЯИАЯ╣ђЯИФЯИЦЯИДЯИЌЯИхЯ╣ѕЯИГЯИИЯИЊЯИФЯИаЯИ╣ЯИАЯИ┤ЯИЋЯ╣ѕЯИ▓ЯИЦЯИЄЯ╣ЂЯИЦЯИ░ЯИЎЯИ▓Я╣ёЯИЪЯИЪЯ╣ЅЯИ▓Я╣ёЯИћЯ╣Ѕ ЯИфЯИ▓ЯИАЯИ▓ЯИБЯИќЯИЎЯИ▓Я╣ёЯИЏ Я╣ЂЯИбЯИЂЯИћЯ╣ЅЯИДЯИбЯИЂЯИБЯИ░Я╣ЂЯИфЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓ЯИЌЯИхЯ╣ѕЯИГЯИИЯИЊЯИФЯИаЯИ╣ЯИАЯИ┤ЯИЏЯИБЯИ░ЯИАЯИ▓ЯИЊ 1000 OC Я╣ёЯИАЯ╣ѕЯИЎЯИ┤ЯИбЯИА
- 30. ЯИЂЯИ▓ЯИБЯИюЯИЦЯИ┤ЯИЋЯ╣ѓЯИЦЯИФЯИ░ЯИГЯИ░ЯИЦЯИ╣ЯИАЯИ┤Я╣ђЯИЎЯИхЯИбЯИА (ЯИЂЯИБЯИ░ЯИџЯИДЯИЎЯИЂЯИ▓ЯИБЯИ«ЯИГЯИЦ) ЯИГЯИИЯИЏЯИЂЯИБЯИЊЯ╣ї 1. Я╣ЂЯИФЯИЦЯ╣ѕЯИЄЯИѕЯ╣ѕЯИ▓ЯИбЯ╣ёЯИЪ 2. cathode :Я╣ЂЯИюЯ╣ѕЯИЎЯИёЯИ▓ЯИБЯ╣їЯИџЯИГЯИЎ anode : Я╣ЂЯИЌЯ╣ѕЯИЄЯИёЯИ▓ЯИБЯ╣їЯИџЯИГЯИЎ 3. Al2O3 ЯИюЯИфЯИА cryolite Anode : 3O2Рѕњ 3/2O2(g)+ 6e┬» Cathode : 2Al3++ 6e┬» 2Al(l) Я╣ЂЯИЂЯ╣іЯИфЯИГЯИГЯИЂЯИІЯИ┤Я╣ђЯИѕЯИЎЯИЌЯИхЯ╣ѕЯ╣ђЯИЂЯИ┤ЯИћЯИѓЯИХЯ╣ЅЯИЎЯИѕЯИ░ЯИЌЯИ▓ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИЂЯИ▒ЯИџЯИёЯИ▓ЯИБЯ╣їЯИџЯИГЯИЎЯИЌЯИхЯ╣ѕЯ╣ЂЯИГЯ╣ѓЯИЎЯИћ Я╣ёЯИћЯ╣ЅЯИюЯИЦЯИ┤ЯИЋЯИаЯИ▒ЯИЊЯИЉЯ╣їЯИфЯ╣ѕЯИДЯИЎЯ╣ЃЯИФЯИЇЯ╣ѕЯ╣ђЯИЏЯ╣ЄЯИЎ CO2 ЯИћЯИ▒ЯИЄЯИфЯИАЯИЂЯИ▓ЯИБ C(s) + O2(g) Рєњ CO2(g) ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИБЯИДЯИА : Al2O3(l) + 3C(s)Рєњ Al(l) + CO2(g)
- 31. 3 ЯИЂЯИ▓ЯИБЯИюЯИЦЯИ┤ЯИЋЯ╣ѓЯИЦЯИФЯИ░Я╣ЂЯИАЯИЂЯИЎЯИхЯ╣ђЯИІЯИхЯИбЯИА ЯИЎЯ╣ЅЯИ▓ЯИЌЯИ░Я╣ђЯИЦ Mg(OH)2 OH ┬» HCl Я╣ђЯИёЯИхЯ╣ѕЯИбЯИДЯ╣ЃЯИФЯ╣ЅЯ╣ЂЯИФЯ╣ЅЯИЄ MgCl2 ЯИЎЯИ▓Я╣ёЯИЏЯ╣ЃЯИіЯ╣ЅЯ╣ЃЯИЎЯ╣ђЯИІЯИЦЯИЦЯ╣ї ЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯ╣ї
- 32. ЯИГЯИИЯИЏЯИЂЯИБЯИЊЯ╣ї 1. Я╣ЂЯИФЯИЦЯ╣ѕЯИЄЯИѕЯ╣ѕЯИ▓ЯИбЯ╣ёЯИЪ 2. graphite electrode 3. MgCl2 anode : 2ClРѕњ Cl2 (g) + 2e- cathode : Mg2+ + 2e- Mg (l) ЯИЏЯИЈЯИ┤ЯИЂЯИ┤ЯИБЯИ┤ЯИбЯИ▓ЯИБЯИДЯИА : 2ClРѕњ + Mg2+ Mg(l) + Cl2(g)
- 33. 4. ЯИЂЯИ▓ЯИБЯИюЯИЦЯИ┤ЯИЋЯ╣ѓЯИЦЯИФЯИ░ЯИЌЯИГЯИЄЯ╣ЂЯИћЯИЄЯ╣ЂЯИЦЯИ░ЯИЂЯИ▓ЯИБЯИЌЯИ▓Я╣ЃЯИФЯ╣ЅЯИџЯИБЯИ┤ЯИфЯИИЯИЌЯИўЯИ┤Я╣ї ЯИГЯИИЯИЏЯИЂЯИБЯИЊЯ╣ї 1. Я╣ЂЯИФЯИЦЯ╣ѕЯИЄЯИѕЯ╣ѕЯИ▓ЯИбЯ╣ёЯИЪ 2. cathode : Cu ЯИџЯИБЯИ┤ЯИфЯИИЯИЌЯИўЯИ┤Я╣ї anode : Cu Я╣ёЯИАЯ╣ѕЯИџЯИБЯИ┤ЯИфЯИИЯИЌЯИўЯИ┤Я╣ї 3. CuSO4 + H2SO4
- 34. Anode : Cu Cu2+ + 2e- Fe Fe2+ + 2e- Zn Zn 2+ + 2e- Cathode : Cu 2+ + 2e - Cu(ЯИџЯИБЯИ┤ЯИфЯИИЯИЌЯИўЯИ┤Я╣ї99.95%)
- 35. 5. ЯИЂЯИ▓ЯИБЯИіЯИИЯИџЯ╣ѓЯИЦЯИФЯИ░ЯИћЯ╣ЅЯИДЯИбЯ╣ёЯИЪЯИЪЯ╣ЅЯИ▓(Electroplating) ЯИѓЯИ▒Я╣ЅЯИДЯ╣ЂЯИГЯ╣ѓЯИЎЯИћ: Я╣ѓЯИЦЯИФЯИ░ЯИЌЯИхЯ╣ѕЯ╣ЃЯИіЯ╣ЅЯИіЯИИЯИџ ЯИѓЯИ▒Я╣ЅЯИДЯ╣ЂЯИёЯ╣ѓЯИЌЯИћ: Я╣ѓЯИЦЯИФЯИ░ЯИЌЯИхЯ╣ѕЯИЋЯ╣ЅЯИГЯИЄЯИЂЯИ▓ЯИБЯИіЯИИЯИџ ЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИбЯИГЯИ┤Я╣ђЯИЦЯ╣ЄЯИЂЯ╣ѓЯИЌЯИБЯ╣ёЯИЦЯИЋЯ╣ї: ЯИфЯИ▓ЯИБЯИЦЯИ░ЯИЦЯИ▓ЯИбЯИЌЯИхЯ╣ѕЯИАЯИхЯ╣ёЯИГЯИГЯИГЯИЎЯИѓЯИГЯИЄЯ╣ѓЯИЦЯИФЯИ░ЯИЌЯИхЯ╣ѕ Я╣ЃЯИіЯ╣ЅЯ╣ђЯИЏЯ╣ЄЯИЎЯ╣ЂЯИГЯ╣ѓЯИЎЯИћ Я╣ёЯИЪЯИЪЯ╣ЅЯИ▓: ЯИЂЯИБЯИ░Я╣ЂЯИфЯИЋЯИБЯИЄ ЯИЏЯИБЯИ░Я╣ѓЯИбЯИіЯИЎЯ╣ї Я╣ђЯИъЯИиЯ╣ѕЯИГЯИёЯИДЯИ▓ЯИАЯИфЯИДЯИбЯИЄЯИ▓ЯИА Я╣ђЯИъЯИиЯ╣ѕЯИГЯИЏЯ╣ЅЯИГЯИЄЯИЂЯИ▒ЯИЎЯИфЯИЎЯИ┤ЯИА
- 36. ЯИЋЯИ▒ЯИДЯИГЯИбЯ╣ѕЯИ▓ЯИЄ ЯИЂЯИ▓ЯИБЯИіЯИИЯИџЯИіЯ╣ЅЯИГЯИЎЯ╣ѓЯИЦЯИФЯИ░ЯИћЯ╣ЅЯИДЯИбЯ╣ђЯИЄЯИ┤ЯИЎ ЯИГЯИИЯИЏЯИЂЯИБЯИЊЯ╣ї 1. Я╣ЂЯИФЯИЦЯ╣ѕЯИЄЯИѕЯ╣ѕЯИ▓ЯИбЯ╣ёЯИЪ 2. cathode : ЯИіЯ╣ЅЯИГЯИЎЯ╣ѓЯИЦЯИФЯИ░ anode : Я╣ЂЯИюЯ╣ѕЯИЎ Ag 3. AgNO3 ЯИѓЯИ▒Я╣ЅЯИДЯ╣ЂЯИГЯ╣ѓЯИЎЯИћ(Ag) : Ag(s) Ag+(aq) + eРђЊ ЯИѓЯИ▒Я╣ЅЯИДЯ╣ЂЯИёЯ╣ѓЯИЌЯИћ(ЯИіЯ╣ЅЯИГЯИЎ) : Ag+(aq) + eРђЊ Ag(s)