Kqht 2
- 1. KQHT 2: Nhiáŧt Äáŧng háŧc cÃĄc háŧ sinh vášt 1. Nhiáŧt Äáŧng háŧc cÃĄc háŧ sinh vášt 2. Máŧt sáŧ khÃĄi niáŧm và Äᚥi lÆ°áŧĢng cÆĄ bášĢn 3. Äáŧnh luášt 1 nhiáŧt Äáŧng háŧc và nháŧŊng háŧ quášĢ cáŧ§a nÃģ 4. Äáŧnh luášt 1 nhiáŧt Äáŧng háŧc ÃĄp dáŧĨng và o háŧ sinh vášt 5. PhÆ°ÆĄng phÃĄp nhiáŧt lÆ°áŧĢng kášŋ giÃĄn tiášŋp và nguyÊn tášŊc hoᚥt Äáŧng cáŧ§a cÆĄ tháŧ sáŧng
- 2. 6. PhÃĒn biáŧt NTHÄ cáŧ§a cÆĄ tháŧ sáŧng váŧi mÃĄy nhiáŧt 7. Äáŧnh luášt II nhiáŧt Äáŧng háŧc 8. TÃnh chášĨt tháŧng kÊ cáŧ§a Äáŧnh luášt II nhiáŧt Äáŧng háŧc 9. Äáŧnh luášt II nhiáŧt Äáŧng háŧc ÃĄp dáŧĨng và o háŧ sinh vášt 10. NÄng lÆ°áŧĢng táŧą do
- 3. 1. Nhiáŧt Äáŧng háŧc háŧ sinh vášt và hÆ°áŧng NC - HÆ°áŧng nghiÊn cáŧĐu cháŧ§ yášŋu sau: + Sáŧą chuyáŧn biášŋn nÄng lÆ°áŧĢng áŧ máŧĐc Äáŧ phÃĒn táŧ, tášŋ bà o, mÃī, âĶ.â XÃĄc Äáŧnh hiáŧu suášĨt sáŧ dáŧĨng nÄng lÆ°áŧĢng cáŧ§a cÃĄc cao phÃĒn táŧ sinh háŧc.
- 4. + TÃnh chášĨt nhiáŧt Äáŧng cáŧ§a cÃĄc quÃĄ trÃŽnh diáŧ n ra trong cÆĄ tháŧ sáŧng nhÆ° quÃĄ trÃŽnh khuyášŋch tÃĄn, thášĐm thášĨu, vášn chuyáŧn tÃch cáŧąc... + CÆĄ chášŋ tÃĄc Äáŧng cáŧ§a sáŧą thay Äáŧi cÃĄc yášŋu táŧ mÃīi trÆ°áŧng lÊn quÃĄ trÃŽnh chuyáŧn hoÃĄ nÄng lÆ°áŧĢng và sáŧą trao Äáŧi nÄng lÆ°áŧĢng giáŧŊa cÆĄ tháŧ sáŧng váŧi mÃīi trÆ°áŧng.
- 5. * Trᚥng thÃĄi cÃĒn bášąng, quÃĄ trÃŽnh cÃĒn bášąng: - Trᚥng thÃĄi cáŧ§a máŧt háŧ nhiáŧt Äáŧng ÄÆ°áŧĢc xÃĄc Äáŧnh báŧi cÃĄc thÃīng sáŧ trᚥng thÃĄi: p, V, T, n. - Nášŋu p, T khÃīng thay Äáŧi tᚥi máŧi Äiáŧm trong háŧ thÃŽ ta cÃģ trᚥng thÃĄi cÃĒn bášąng. - Máŧt quÃĄ trÃŽnh biášŋn Äáŧi, háŧ liÊn táŧĨc trášĢi qua nhiáŧu trᚥng thÃĄi. Nášŋu quÃĄ trÃŽnh biášŋn Äáŧi là Äáŧ§ chášm Äáŧ cÃĄc trᚥng thÃĄi mà háŧ trášĢi qua luÃīn là trᚥng thÃĄi cÃĒn bášąng thÃŽ gáŧi là quÃĄ trÃŽnh cÃĒn bášąng. 2. CÃC KHÃI NIáŧM CÆ BášĒN * CÃĄc khÃĄi niáŧm: Háŧ, háŧ cÃī lášp, háŧ kÃn, háŧ máŧ, âĶ
- 6. * QuÃĄ trÃŽnh thuášn ngháŧch và bášĨt thuášn ngháŧch: Máŧt quÃĄ trÃŽnh biášŋn Äáŧi ÄÆ°áŧĢc gáŧi là thuášn ngháŧch nášŋu nÃģ cÃģ tháŧ tiášŋn hà nh theo chiáŧu ngÆ°áŧĢc lᚥi, và áŧ lÆ°áŧĢt váŧ (quÃĄ trÃŽnh ngÆ°áŧĢc), háŧ Äi qua tášĨt cášĢ cÃĄc trᚥng thÃĄi trung gian nhÆ° áŧ lÆ°áŧĢt Äi. QuÃĄ trÃŽnh thuášn ngháŧch là quÃĄ trÃŽnh là tÆ°áŧng, tháŧąc tášŋ khÃīng xášĢy ra.
- 7. * Nhiáŧt lÆ°áŧĢng và cÃīng: Nhiáŧt lÆ°áŧĢng Q (nhiáŧt): là sáŧ Äo phᚧn nÄng lÆ°áŧĢng chuyáŧn Äáŧng nhiáŧt trao Äáŧi tráŧąc tiášŋp giáŧŊa cÃĄc phÃĒn táŧ cáŧ§a háŧ Äang xÃĐt váŧi mÃīi trÆ°áŧng ngoà i. CÃīng A cÃģ biáŧu tháŧĐc tÃnh: (2) 12 (1) A p.dV= â âŦ Qui Æ°áŧc váŧ dášĨu: A, Q > 0: khi háŧ nhášn táŧŦ bÊn ngoà i. A, Q < 0: khi háŧ cung cášĨp ra bÊn ngoà i.
- 8. 3. Äáŧnh luášt I nhiáŧt Äáŧng háŧc và háŧ quášĢ 3.1 Náŧi dung: Sáŧą biášŋn thiÊn náŧi nÄng cáŧ§a háŧ bášąng nhiáŧt lÆ°áŧĢng do háŧ nhášn ÄÆ°áŧĢc tráŧŦ Äi cÃīng do háŧ tháŧąc hiáŧn. dU = ÎīQ - ÎīA hay âU = Q - A dU: Äáŧ biášŋn Äáŧi náŧi nÄng ÎīA , ÎīQ: Äáŧ biášŋn Äáŧi cÃīng và nhiáŧt
- 9. 3.2 Háŧ quášĢ: CÃīng và Nhiáŧt sau máŧt chu trÃŽnh: Háŧ cÃī lášp: Náŧi nÄng cáŧ§a háŧ cÃī lášp ÄÆ°áŧĢc bášĢo toà n. A 0, Q 0 U 0 U const= = ââ = â = Sau máŧt chu trÃŽnh, háŧ nhášn bao nhiÊu nhiáŧt thÃŽ sinh bášĨy nhiÊu cÃīng và ngÆ°áŧĢc lᚥi. "KhÃīng tháŧ chášŋ tᚥo ÄÆ°áŧĢc Äáŧng cÆĄ vÄĐnh cáŧu loᚥi máŧt, là loᚥi Äáŧng cÆĄ khÃīng cᚧn cung cášĨp nÄng lÆ°áŧĢng nhÆ°ng vášŦn cÃģ khášĢ nÄng sinh cÃīng". âU = 0 â Q - A = 0 Hay A = Q
- 10. * CÃC Háš N CHášū CáŧĶA NGUYÃN Là I 1 - KhÃīng nÃģi Äášŋn Äiáŧu kiáŧn chuyáŧn hÃģa giáŧŊa cÃīng và nhiáŧt. 2 - KhÃīng nÃģi rÃĩ chiáŧu diáŧ n biášŋn trong cÃĄc quÃĄ trÃŽnh. Và dáŧĨ, sau máŧt chu trÃŽnh thÃŽ: NghÄĐa là háŧ nhášn bao nhiÊu nhiáŧt thÃŽ sinh bášĨy nhiÊu cÃīng. NhÆ°ng trÊn tháŧąc tášŋ vášŦn khÃīng cÃģ Äiáŧu nà y. Nhiáŧt khÃīng tháŧ táŧą Äáŧng truyáŧn táŧŦ vášt lᚥnh sang vášt nÃģng. âU = 0 â A - Q = 0 Hay A = Q
- 11. 4. Äáŧnh luášt I NÄH ÃĄp dáŧĨng và o háŧ sinh vášt âĒ DÃđng máŧt lÆ°áŧĢng tháŧĐc Än ÄÃĢ xÃĄc Äáŧnh trÆ°áŧc Äáŧ nuÃīi chuáŧt khoang trong nhiáŧt lÆ°áŧĢng kášŋ áŧ nhiáŧt Äáŧ 0o C. âĒ Diáŧ n ra cÃĄc phášĢn áŧĐng phÃĒn huáŧ· tháŧĐc Än táŧi sášĢn phášĐm cuáŧi cÃđng là khà CO2 và H2O
- 12. 4. Äáŧnh luášt I NÄH ÃĄp dáŧĨng và o háŧ sinh vášt âĒ Nhiáŧt lÆ°áŧĢng giášĢi phÃģng ra táŧŦ cÃĄc phášĢn áŧĐng hoÃĄ sinh diáŧ n ra trong cÆĄ tháŧ sáŧng Q1 hoà n toà n tÆ°ÆĄng ÄÆ°ÆĄng váŧi nhiáŧt lÆ°áŧĢng giášĢi phÃģng ra táŧŦ cÃĄc phášĢn áŧĐng Ãīxy hoÃĄ Q2 diáŧ n ra áŧ ngoà i cÆĄ tháŧ sáŧng. âĒ GiášĢi phÃģng ra nhiáŧt lÆ°áŧĢng: Q1 â Q2.
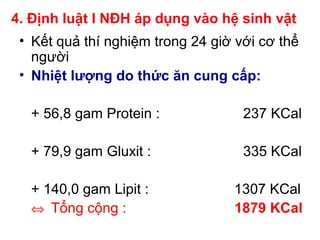
- 13. 4. Äáŧnh luášt I NÄH ÃĄp dáŧĨng và o háŧ sinh vášt âĒ Kášŋt quášĢ thà nghiáŧm trong 24 giáŧ váŧi cÆĄ tháŧ ngÆ°áŧi âĒ Nhiáŧt lÆ°áŧĢng do tháŧĐc Än cung cášĨp: + 56,8 gam Protein : 237 KCal + 79,9 gam Gluxit : 335 KCal + 140,0 gam Lipit : 1307 KCal â Táŧng cáŧng : 1879 KCal
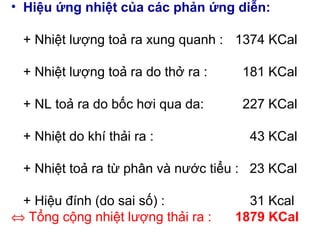
- 14. âĒ Hiáŧu áŧĐng nhiáŧt cáŧ§a cÃĄc phášĢn áŧĐng diáŧ n: + Nhiáŧt lÆ°áŧĢng toášĢ ra xung quanh : 1374 KCal + Nhiáŧt lÆ°áŧĢng toášĢ ra do tháŧ ra : 181 KCal + NL toášĢ ra do báŧc hÆĄi qua da: 227 KCal + Nhiáŧt do khà thášĢi ra : 43 KCal + Nhiáŧt toášĢ ra táŧŦ phÃĒn và nÆ°áŧc tiáŧu : 23 KCal + Hiáŧu ÄÃnh (do sai sáŧ) : 31 Kcal â Táŧng cáŧng nhiáŧt lÆ°áŧĢng thášĢi ra : 1879 KCal
- 15. âĒ Nhu cᚧu dinh dÆ°áŧĄng & nhiáŧt lÆ°áŧĢng thiášŋt yÊu cáŧ§a cÆĄ tháŧ: + SÆĄ Äáŧ quÃĄ trÃŽnh sinh nhiáŧt táŧŦ tháŧĐc Än: Gluxit, protein, lipit +O2 =Nhiáŧt nÄng+ H2O+CO2 + CÆĄ sáŧ chuyáŧn hÃģa nÄng lÆ°áŧĢng tiÊu hao: gan 27%; nÃĢo 19%; tim, thášn 10%; cÆĄ 18%; cÃĄc báŧ phášn cÃēn lᚥi 18%. Tuáŧi cà ng nháŧ chuyáŧn hÃģa cÆĄ sáŧ cà ng cao
- 16. 1. BášĢng 1: CÃīng tháŧĐc tÃnh chuyáŧn hÃģa cÆĄ sáŧ theo cÃĒn náš·ng ( w ) Lao Äáŧng tháŧ láŧąc. âĒ Lao Äáŧng nhášđ:ĖýNhÃĒn viÊn hà nh chÃnh, cÃĄc ngháŧ lao Äáŧng trà Ãģc, ngháŧ táŧą do, náŧi tráŧĢ, giÃĄo viÊn. âĒ Lao Äáŧng trung bÃŽnh:ĖýCÃīng nhÃĒn xÃĒy dáŧąng , nÃīng dÃĒn, ngháŧ cÃĄ, quÃĒn nhÃĒn, sinh viÊn. âĒ Lao Äáŧng náš·ng:ĖýMáŧt sáŧ ngháŧ nÃīng nghiáŧp, cÃīng nhÃĒn cÃīng nghiáŧp náš·ng, ngháŧ máŧ, vášn Äáŧng viÊn tháŧ thao, quÃĒn nhÃĒn tháŧi káŧģ luyáŧn tášp. âĒ Lao Äáŧng Äáš·c biáŧt:ĖýNgháŧ ráŧŦng, ngháŧ rÃĻn
- 17. 2.ĖýTÃnh nhu cᚧu nÄng lÆ°áŧĢng cášĢ ngà y âĒ BášĢngĖý2: Háŧ sáŧ tÃnh nhu cᚧu nÄng lÆ°áŧĢng cášĢ ngà y cáŧ§a ngÆ°áŧi trÆ°áŧng thà nh theo âĒ Vd: nhu cᚧu nÄng lÆ°áŧĢng cáŧ§a nhÃģm lao Äáŧng nam láŧĐa tuáŧi 18-30, cÃĒn náš·ng trung bÃŽnh 50 kg , loᚥi lao Äáŧng váŧŦa nhÆ° sau: ( 15,3 x 50 ) + 679 = 1444 kcalo â Nhu cᚧu cášĢ ngà y nhÆ° sau: 1444 kcalo x 1,78 = 2570 kcalo
- 18. DUY TRà CÃN NášķNG NÃN Cà BMI = cÃĒn náš·ng (kg)/ BÃŽnh phÆ°ÆĄng cáŧ§a Chiáŧu cao (m) áŧ ngÆ°áŧi bÃŽnh thÆ°áŧng nÊn nÄm trong khoášĢng 18,5-25 áŧ CášĒ NAM Và NáŧŪ. THEO KášūT QUášĒ NGHIÃN CáŧĻU CáŧĶA VIáŧN DINH DÆŊáŧ NG, CHáŧ Sáŧ BMI áŧ ngÆ°áŧi Viáŧt nam 26-40 tuáŧi : + Nam là 19,72 + 2,81 + NáŧŊ 19,75 + 3,41
- 19. 7. Äáŧnh luášt II nhiáŧt Äáŧng háŧc 1 PhÃĄt biáŧu cáŧ§a Thomson và Carnot: KhÃīng tháŧ chášŋ tᚥo ÄÆ°áŧĢc Äáŧng cÆĄ nhiáŧt hoᚥt Äáŧng tuᚧn hoà n, liÊn táŧĨc biášŋn nhiáŧt thà nh cÃīng mà mÃīi trÆ°áŧng xung quanh khÃīng chiáŧĨ sáŧą biášŋn Äáŧi nà o.
- 20. 2. PhÃĄt biáŧu cáŧ§a Clausius: Nhiáŧt khÃīng tháŧ táŧą Äáŧng truyáŧn táŧŦ vášt lᚥnh sang vášt nÃģng. NÃģi cÃĄch khÃĄc, sáŧą truyáŧn nhiáŧt táŧŦ vášt lᚥnh sang vášt nÃģng khÃīng tháŧ xášĢy ra nášŋu khÃīng cÃģ sáŧą bÃđ tráŧŦ nà o. 3. PhÃĄt biáŧu cáŧ§a Planck : Äáŧi váŧi háŧ cÃī lášp, máŧi quÃĄ trÃŽnh trong táŧą nhiÊn Äáŧu diáŧ n biášŋn theo chiáŧu tÄng cáŧ§a entropi
- 21. (a) ENTROPY 1 â KhÃĄi niáŧm váŧ Entropy: Chu trÃŽnh A-a-B-c-A: B A a c A B Q QQ 0 0 (1) T T T Îī ÎīÎī = â + = âŦ âŦ âŦà B A (b) (c) Chu trÃŽnh A-b-B-c-A: B A b c A B Q QQ 0 0 (2) T T T Îī ÎīÎī = â + = âŦ âŦ âŦà Do (a), (b) là bášĨt kÃŽ, nÊn táŧŦ (1) và (2) suy ra: B B a b A A Q Q const (3) T T Îī Îī = = âŦ âŦ
- 22. ENTROPY 1 â KhÃĄi niáŧm váŧ Entropy: (3) cháŧĐng táŧ: táŧng nhiáŧt lÆ°áŧĢng rÚt gáŧn cáŧ§a háŧ trong quÃĄ trÃŽnh biášŋn Äáŧi thuášn ngháŧch táŧŦ trᚥng thÃĄi nà y sang trᚥng thÃĄi kia khÃīng pháŧĨ thuáŧc và o quÃĄ trÃŽnh biášŋn Äáŧi, mà cháŧ pháŧĨ thuáŧc và o trᚥng thÃĄi Äᚧu và trᚥng thÃĄi cuáŧi cáŧ§a háŧ. ÄÃģ là tÃnh chášĨt THášū cáŧ§a cÃĄc quÃĄ trÃŽnh nhiáŧt Äáŧng. TáŧŦ ÄÃģ ta cÃģ tháŧ tÃŽm ÄÆ°áŧĢc máŧt hà m thášŋ S, gáŧi là hà m trᚥng thÃĄi hay entropy, sao cho: B A Q Q S S(B) S(A) dS T a T h y Îī Îī â = â = = âŦ
- 23. ENTROPY 2 â CÃĄc tÃnh chášĨt cáŧ§a Entropy: - Là hà m Äáš·c trÆ°ng cho trᚥng thÃĄi, khÃīng pháŧĨ thuáŧc và o quÃĄ trÃŽnh biášŋn Äáŧi. 0 Q S S T Îī = + âŦ - CÃģ tÃnh cáŧng ÄÆ°áŧĢc. - KhÃīng xÃĄc Äáŧnh ÄÆĄn giÃĄ mà sai kÃĐm máŧt hášąng sáŧ cáŧng. Váŧi S0 là entropy tᚥi trᚥng thÃĄi gáŧc. Qui Æ°áŧc S0 = 0 tᚥi 00 K.
- 24. ENTROPY 3 â Biáŧu tháŧĐc Äáŧnh lÆ°áŧĢng cáŧ§a NL II váŧi entropy: - XÃĐt máŧt chu trÃŽnh bášĨt thuášn ngháŧch gáŧm hai quÃĄ trÃŽnh: (a) B A (b) A-a-B: bášĨt thuášn ngháŧch B-b-A: thuášn ngháŧch (AaB) (BbA) Q Q Q 0 T T T Îī Îī Îī = + < âŦ âŦ âŦà VÃŽ (B-b-A): là thuášn ngháŧch nÊn khi tiášŋn hà nh theo chiáŧu ngÆ°áŧĢc lᚥi, ta cÃģ: (BbA) (AbB) Q Q T T Îī Îī = â âŦ âŦ Do ÄÃģ : (AaB) (AbB) Q Q S(B) S(A) S T T Îī Îī < = â = â âŦ âŦ Táŧng quÃĄt: (2) (1) Q Q S dS T T hay Îī Îī â âĨ âĨ âŦ Ta cÃģ:
- 25. ENTROPY 4 â NguyÊn lÃ― tÄng entropy: Trong máŧt háŧ cÃī lášp, ta cÃģ: Váŧi cÃĄc quÃĄ trÃŽnh thuášn ngháŧch: NguyÊn lÃ― tÄng entropy: TrÊn tháŧąc tášŋ, máŧi quÃĄ trÃŽnh nhiáŧt Äáŧng xášĢy ra trong máŧt háŧ cÃī lášp luÃīn theo chiáŧu hÆ°áŧng sao cho entropy cáŧ§a háŧ tÄng lÊn. Háŧ quášĢ: Q 0 dS 0Îī = â âĨ dS 0 S const= â = Váŧi cÃĄc quÃĄ trÃŽnh bášĨt thuášn ngháŧch: dS 0 S> â â Háŧ cÃī lášp khÃīng tháŧ 2 lᚧn cÃđng Äi qua máŧt trᚥng thÃĄi. Háŧ cÃī lášp áŧ trᚥng thÃĄi cÃĒn bášąng sáš― kášŋt thÚc máŧi quÃĄ trÃŽnh biášŋn Äáŧi. Khi ÄÃģ entropy cáŧ§a háŧ Äᚥt cáŧąc Äᚥi.
- 26. ENTROPY * à nghÄĐa tháŧng kÊ cáŧ§a entropy và nguyÊn lÃ― II: 1. Entropy là thÆ°áŧc Äo máŧĐc Äáŧ háŧn loᚥn cáŧ§a cÃĄc phÃĒn táŧ trong háŧ. Khi entropy giášĢm (và dáŧĨ ÄÆ°áŧĢc là m lᚥnh) thÃŽ tÃnh háŧn loᚥn cáŧ§a cÃĄc phÃĒn táŧ cÅĐng giášĢm, tÃnh trášt táŧą tÄng lÊn và ngÆ°áŧĢc lᚥi.
- 27. 2. Nhiáŧt khÃīng tháŧ táŧą Äáŧng truyáŧn táŧŦ vášt lᚥnh sang vášt nÃģng và entropy cáŧ§a háŧ cÃī lášp khÃīng tháŧ giášĢm. NÃģi cÃĄch khÃĄc, háŧ luÃīn cÃģ xu hÆ°áŧng biášŋn Äáŧi táŧŦ trᚥng thÃĄi khÃīng cÃĒn bášąng váŧ trᚥng thÃĄi cÃĒn bášąng và khi váŧ Äášŋn trᚥng thÃĄi cÃĒn bášąng ráŧi, nÃģ khÃīng tháŧ táŧą Äáŧng tráŧ lᚥi trᚥng thÃĄi khÃīng cÃĒn bášąng. 3. NguyÊn lÃ― II cháŧ ÃĄp dáŧĨng cho háŧ vÄĐ mÃī gáŧm máŧt sáŧ rášĨt láŧn cÃĄc phÃĒn táŧ (vÃŽ khi ÄÃģ ta cÃģ tháŧ báŧ qua ášĢnh hÆ°áŧng cáŧ§a nháŧŊng thÄng giÃĄng).
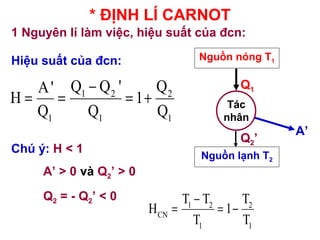
- 28. * ÄáŧNH Là CARNOT 1 NguyÊn là là m viáŧc, hiáŧu suášĨt cáŧ§a Äcn: Nguáŧn nÃģng T1 Nguáŧn lᚥnh T2 TÃĄc nhÃĒn Aâ Q1 Q2â Hiáŧu suášĨt cáŧ§a Äcn: 1 2 2 1 1 1 Q Q ' QA' H 1 Q Q Q â = = = + ChÚ Ã―: H < 1 Aâ > 0 và Q2â > 0 Q2 = - Q2â < 0 1 2 2 CN 1 1 T T T H 1 T T â = = â
- 29. * ÄáŧNH Là CARNOT âĒ Và dáŧĨ 1: Máŧt Äáŧng cÆĄ nhiáŧt là m viáŧc theo chu trÃŽnh Carnot, cÃģ cÃīng suášĨt 100 mÃĢ láŧąc. Nhiáŧt Äáŧ cáŧ§a nguáŧn nÃģng là 1000 C, nguáŧn lᚥnh là 00 C. TÃnh: a)Hiáŧu suášĨt cáŧ§a Äáŧng cÆĄ. b)Nhiáŧt lÆ°áŧĢng mà tÃĄc nhÃĒn nhášn trong 1 phÚt. c)Nhiáŧt lÆ°áŧĢng mà tÃĄc nhÃĒn nhášĢ cho nguáŧn lᚥnh trong 1 phÚt. ÄS: a) 27%; b) 16470kJ; c) 12054kJ
- 30. âĒ Và dáŧĨ 2: Máŧt mÃĄy hÆĄi nÆ°áŧc cÃģ cÃīng suášĨt 14,7kW, tiÊu tháŧĨ 8,1kg than trong máŧt giáŧ. Nhiáŧt Äáŧ cáŧ§a nguáŧn nÃģng là 2000 C, nguáŧn lᚥnh là 580 C. NÄng suášĨt táŧa nhiáŧt cáŧ§a than là 7800 kcal/kg. a) TÃnh hiáŧu suášĨt cáŧ§a mÃĄy. b) So sÃĄnh hiáŧu suášĨt ÄÃģ váŧi hiáŧu suášĨt là tÆ°áŧng cáŧ§a mÃĄy là m viáŧc theo chu trÃŽnh Carnot váŧi hai nguáŧn nhiáŧt káŧ trÊn. ÄS: a) 20%; b) 2/3HCN
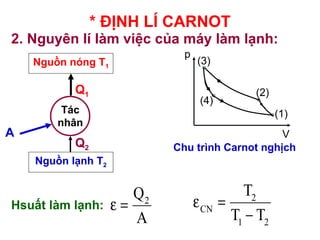
- 31. * ÄáŧNH Là CARNOT 2. NguyÊn là là m viáŧc cáŧ§a mÃĄy là m lᚥnh: 2 CN 1 2 T T T Îĩ = â V p (3) (2) (1) (4) Chu trÃŽnh Carnot ngháŧch HsuášĨt là m lᚥnh: Nguáŧn nÃģng T1 Nguáŧn lᚥnh T2 TÃĄc nhÃĒn A Q1 Q2 2 Q A Îĩ =
- 32. âĒ Và dáŧĨ 3: Máŧt mÃĄy là m lᚥnh hoᚥt Äáŧng theo chu trÃŽnh Carnot váŧi tÃĄc nhÃĒn bášĨt káŧģ áŧ cÃĄc nhiáŧt Äáŧ là 0 o C và -100 o C. Trong trÆ°áŧng háŧĢp nà o hiáŧu suášĨt cáŧ§a mÃĄy là m lᚥnh là khÃīng Äáŧi: a. GiášĢm Äáŧng tháŧi nhiáŧt Äáŧ hai nguáŧn 200 K. b. TÄng Äáŧng tháŧi nhiáŧt Äáŧ hai nguáŧn lÊn hai lᚧn. c. TÄng Äáŧng tháŧi nhiáŧt Äáŧ tuyáŧt Äáŧi cáŧ§a hai nguáŧn lÊn hai lᚧn. d. TÄng nhiáŧt Äáŧ nguáŧn lᚥnh thÊm 1000 K.
- 33. âĒ Và dáŧĨ 4: Máŧt chu trÃŽnh là m lᚥnh xášĢ 250 J nhiáŧt và o phÃēng trong khi mÃītÆĄ cung cášĨp 80J cÃīng. LÆ°áŧĢng nhiáŧt lášĨy táŧŦ bÊn trong mÃĄy là m lᚥnh bášąng bao nhiÊu? a. 170 J b. 299 cal. c. 598 J d. 5210 cal.