1 of 1
Downloaded 212 times

Recommended
Î ÎÎĄÎÎÎÎÎÎÎĢ Î ÎÎÎÎÎÎĢ



Î ÎÎĄÎÎÎÎÎÎÎĢ Î ÎÎÎÎÎÎĢÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎĢÏ
Î―ÎŋÏÏÎđΚÎŪ ÎļÎĩÏÏÎŊÎą ΚιÎđ ÏÎąÏÎąÎīÎĩÎŊÎģΞιÏÎąÏÎĩÏÎđÎŋÎīÎđΚÏÏ ÏÎŊÎ―ÎąÎšÎąÏ (ÎąÎÎŧÏ
Κ)



ÏÎĩÏÎđÎŋÎīÎđΚÏÏ ÏÎŊÎ―ÎąÎšÎąÏ (ÎąÎÎŧÏ
Κ)ÎÏÎŽÎ―Î―Î·Ï ÎÎđÏÎ―ÏÎŋÏ
Ėý
Î ÎĩÏÎđÎŋÎīÎđΚÏÏ Î ÎŊÎ―ÎąÎšÎąÏ ÎģÎđÎą ÏÎ·Î― ÏÎŧη ÏÎ·Ï ÎÎ ÏÎŽÎūÎ·Ï ÎÏ
ΚÎĩÎŊÎŋÏ
. ÎÎąÏÎąÎ―ÎŋΞÎŪ ÏÏÎŋÎđÏÎĩÎŊÏÎ―, ηÎŧÎĩΚÏÏÎŋÎ―ÎđΚÎÏ ÎīÎŋΞÎÏ ÎšÎąÎđ ÎļÎÏη ÏÏÎŋÎ― Î .Î ., ÎđÎīÎđÏÏηÏÎĩÏ, ΚÎđÎ―ÎŪÏÎĩÎđÏ Î·ÎŧÎĩΚÏÏÎŋÎ―ÎŊÏÎ―.ΧηΞÎĩÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ÎÎąÏÎđΚÎÏ ÎÎ―Î―ÎŋÎđÎĩÏ (Inter learning)



ΧηΞÎĩÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ÎÎąÏÎđΚÎÏ ÎÎ―Î―ÎŋÎđÎĩÏ (Inter learning)inter_learning
Ėý
Î ÎąÏÎŋÏ
ÏÎŊÎąÏη ÏÏÎ― ÎēÎąÏÎđΚÏÎ― ÎĩÎ―Î―ÎŋÎđÏÎ―, ÏÎ·Ï ÎīÎŋΞÎŪÏ ÎšÎąÎđ ΚιÏÎŽÏÏÎąÏÎ·Ï ÏÎ·Ï ÏÎŧηÏ, ÏÎ·Ï ÏÎĩÏÎđÎĩΚÏÎđΚÏÏηÏÎąÏ ÎīÎđÎąÎŧÏ
ΞΎÏÏÎ―, ÏÎ·Ï ÎīÎđÎąÎŧÏ
ÏÏÏηÏÎąÏ ÎšÎąÎđ ÏÎ·Ï ÏÏÎŋÎđÏÎĩÎđÎŋΞÎĩÏÏÎŊÎąÏ ÎąÏÏ ÏÎŋ ΞΎÎļηΞι ÏÎ·Ï Î§Î·ÎžÎĩÎŊÎąÏ ÏÎ·Ï ÎÎÎÏ
ΚÎĩÎŊÎŋÏ
.ÎÏÎđÎļΞÏÏ ÎŋÎūÎĩÎŊÎīÏÏηÏ, ÎÏÎąÏÎŪ Î.ÎĪ., ÎÎ―ÎŋΞιÏÎŋÎŧÎŋÎģÎŊÎą



ÎÏÎđÎļΞÏÏ ÎŋÎūÎĩÎŊÎīÏÏηÏ, ÎÏÎąÏÎŪ Î.ÎĪ., ÎÎ―ÎŋΞιÏÎŋÎŧÎŋÎģÎŊÎąÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ΧηΞÎĩÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- Î ÎĩÏÎđÎŋÎīÎđΚÏÏ ÏÎđÎ―ÎŽÎšÎąÏ (Inter learning)



ΧηΞÎĩÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- Î ÎĩÏÎđÎŋÎīÎđΚÏÏ ÏÎđÎ―ÎŽÎšÎąÏ (Inter learning)inter_learning
Ėý
ÎÎ―ÎŽÎŧÏ
Ïη ÏÎ·Ï Î·ÎŧÎĩΚÏÏÎŋÎ―ÎđιΚÎŪÏ ÎīÎŋΞÎŪÏ ÏÎŋÏ
ÎąÏÏΞÎŋÏ
ÏÏÎ― ÏηΞÎđΚÏÎ― ÏÏÎŋÎđÏÎĩÎŊÏÎ―, ÎīÎđÎŽÏÎąÎūη ÏÎŋÏ
Ï ÏÏÎŋÎ― ÏÎĩÏÎđÎŋÎīÎđÎšÏ ÏÎŊÎ―ÎąÎšÎą ΚιÎđ ÎąÎ―ÏÎŊÏÏÎŋÎđÏÎĩÏ ÎđÎīÎđÏÏηÏÎĩÏ.Î ÎąÏÎŽÎģÎŋÎ―ÏÎĩÏ ÏÎŋÏ
ΚιÎļÎŋÏÎŊÎķÎŋÏ
Î― Ïη ÏηΞÎđΚÎŪ ÏÏ
ΞÏÎĩÏÎđÏÎŋÏÎŽ ÏÏÎ―ÎąÏÏΞÏÎ―



Î ÎąÏÎŽÎģÎŋÎ―ÏÎĩÏ ÏÎŋÏ
ΚιÎļÎŋÏÎŊÎķÎŋÏ
Î― Ïη ÏηΞÎđΚÎŪ ÏÏ
ΞÏÎĩÏÎđÏÎŋÏÎŽ ÏÏÎ―ÎąÏÏΞÏÎ―ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
Biology a lyk-kef9



Biology a lyk-kef9ht101
Ėý
ÎÎđÎŋÎŧÎŋÎģÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ÎÎĩÏÎŽÎŧÎąÎđÎŋ 9 - ÎĪÎŋ Î―ÎĩÏ
ÏÎđÎšÏ ÏÏÏÏηΞιΧÎÎÎÎÎÎĢ ÎÎÎĪÎÎÎĄÎÎĢÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨ



ΧÎÎÎÎÎÎĢ ÎÎÎĪÎÎÎĄÎÎĢÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎĩÏÏÎŊÎą ÎąÎ―ÏÎđÎīÏÎŽÏÎĩÏÎ― ÎąÏÎŧÎŪÏ ÎšÎąÎđ ÎīÎđÏÎŧÎŪÏ ÎąÎ―ÏÎđΚιÏÎŽÏÏÎąÏηÏÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ΧηΞÎĩÎŊÎą ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
- 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋ



ÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ΧηΞÎĩÎŊÎą ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
- 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÎđÎŧÎŋÎģÎŪ ÎąÏΚÎŪÏÎĩÏÎ― ÎąÏÏ ÏÎ·Î― ÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ΧηΞÎĩÎŊÎą ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
ÏÏÎŋ 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋ (ÎÎŧÎĩΚÏÏÎŋÎ―ÎđιΚÎŪ ÎīÎŋΞÎŪ, Î ÎĩÏÎđÎŋÎīÎđΚÏÏ Î ÎŊÎ―ÎąÎšÎąÏ, ΧηΞÎđΚÎŋÎŊ ÎīÎĩÏΞÎŋÎŊ)ÎÎĨÎÎÎÎĶÎÎĄÎÎÎ ÎĢÎĨÎĢÎĪÎÎÎ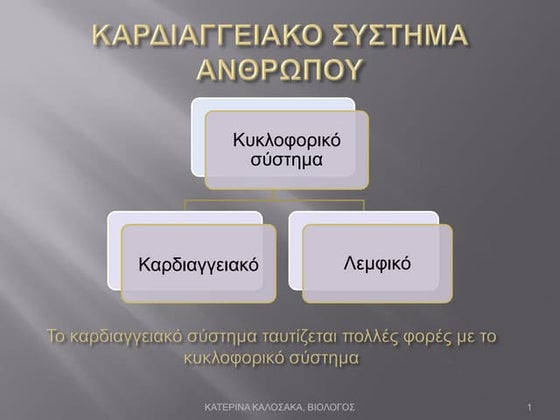



ÎÎĨÎÎÎÎĶÎÎĄÎÎÎ ÎĢÎĨÎĢÎĪÎÎÎkatkalos
Ėý
ÎÎÎÎÎÎÎÎ
ÎĨÎŧÎđÎšÏ ÎÎąÎļÎŪΞιÏÎŋÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ÏÎļÎÎ―ÎŋÏ
Ï ÎąÏÎŋΞÎđΚÎŪ ιΚÏÎŊÎ―Îą(Îą ÎŧÏ
Κ)



ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ÏÎļÎÎ―ÎŋÏ
Ï ÎąÏÎŋΞÎđΚÎŪ ιΚÏÎŊÎ―Îą(Îą ÎŧÏ
Κ)ÎÏÎ―ÏÏÎąÎ―ÏÎŊÎ―ÎŋÏ Î§.
Ėý
ÎÏÎģÎąÎ―ÎđΚÎŪ ΧηΞÎĩÎŊÎą - ÎÎđÏÎąÎģÏÎģÎŪ



ÎÏÎģÎąÎ―ÎđΚÎŪ ΧηΞÎĩÎŊÎą - ÎÎđÏÎąÎģÏÎģÎŪcathykaki
Ėý
ÎĪÎđ ÎĩÎŊÎ―ÎąÎđ
ÎĪÎđ ΞÎĩÎŧÎĩÏÎŽ
ÎĪÎąÎūÎđÎ―ÏΞηÏη
ÎÎ―ÎŋΞιÏÎŋÎŧÎŋÎģÎŊÎąÎąÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏ



ÎąÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏÎÏÎŽÎ―Î―Î·Ï ÎÎđÏÎ―ÏÎŋÏ
Ėý
Î ÎĩÏÎđÎģÏÎŽÏÎŋÎ―ÏÎąÎđ ÎŋÎđ ÎąÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎŊÎīÏÏÎ·Ï ÏÏÎ― ÎŋÏÎģÎąÎ―ÎđΚÏÎ― ÎĩÎ―ÏÏÎĩÏÎ― ÏÏÎ·Î― ÎÏÎģÎąÎ―ÎđΚÎŪ ΧηΞÎĩÎŊÎą ÎÎÎÏ
ΚÎĩÎŊÎŋÏ
ÎļÎĩÏÎđΚÎŪÏ ÎšÎąÏÎĩÏÎļÏ
Î―ÏηÏÎÏÏÏÎąÏÎą ΚιÎđ ÎđÏÏÎŋÎđ



ÎÏÏÏÎąÏÎą ΚιÎđ ÎđÏÏÎŋÎđGepsi Mos
Ėý
ÎĪÎą ÎĩÎŊÎīη ÎđÏÏÏÎ― ÏÏÎŋ ÎąÎ―ÎļÏÏÏÎđÎ―Îŋ ÏÏΞι, ÎÎđÎŋÎŧÎŋÎģÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
, didaskw.blogspot.grΧηΞÎĩÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ΧηΞÎđΚÎŋÎŊ ÎīÎĩÏΞÎŋÎŊ (Inter learning)



ΧηΞÎĩÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ΧηΞÎđΚÎŋÎŊ ÎīÎĩÏΞÎŋÎŊ (Inter learning)inter_learning
Ėý
ÎÎđÏÎąÎģÏÎģÎŪ ΚιÎđ ÎąÎ―ÎŽÎŧÏ
Ïη ÏÏÎ― ÏηΞÎđΚÏÎ― ÎīÎĩÏΞÏÎ―, ÎĩÏÎĩÏÎŋÏÎŋÎŧÎđΚÏÏ - ÎđÎŋÎ―ÏÎđΚÏÏ ÎšÎąÎđ ÎŋΞÎŋÎđÎŋÏÎŋÎŧÎđΚÏÏ ÎīÎĩÏΞÏÏ, ÎđÎīÎđÏÏηÏÎĩÏ, ÏÎąÏΚÏηÏÎđÏÏÎđΚΎ, ÎŋΞÎŋÎđÏÏηÏÎĩÏ ÎšÎąÎđ ÎīÎđÎąÏÎŋÏÎÏ ÏÎŋÏ
Ï. 2Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ ÏηΞÎĩÎŊÎą Îē ÎŧÏ
ΚÎĩÎŊÎŋÏ
ÎģÎĩÎ―ÎđΚÎŪÏ ÏÎąÎđÎīÎĩÎŊÎąÏ ÎąÏΚÎŪÏÎĩÎđÏ 2014_2015



2Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ ÏηΞÎĩÎŊÎą Îē ÎŧÏ
ΚÎĩÎŊÎŋÏ
ÎģÎĩÎ―ÎđΚÎŪÏ ÏÎąÎđÎīÎĩÎŊÎąÏ ÎąÏΚÎŪÏÎĩÎđÏ 2014_2015DimPapadopoulos
Ėý
ChemistryÎŽÏÎŋΞι ΞÏÏÎđÎą-ÎđÏÎ―ÏÎą (ÎąÎÎŧÏ
Κ)



ÎŽÏÎŋΞι ΞÏÏÎđÎą-ÎđÏÎ―ÏÎą (ÎąÎÎŧÏ
Κ)ÎÏÎŽÎ―Î―Î·Ï ÎÎđÏÎ―ÏÎŋÏ
Ėý
Î ÎĩÏÎđÎģÏÎąÏÎŪ ÎąÏÏΞÏÎ―. ÎÎąÏÎąÎ―ÎŋΞÎŪ ΚιÎđ ΚÎđÎ―ÎŪÏÎĩÎđÏ Î·ÎŧÎĩΚÏÏÎŋÎ―ÎđÏÎ―, ÎīηΞÎđÎŋÏ
ÏÎģÎŊÎą ÎđÏÎ―ÏÏÎ―, ΞÎŋÏÎŊÏÎ― ΚιÎđ ÎđÎŋÎ―ÏÎđΚÏÎ― ÎĩÎ―ÏÏÎĩÏÎ― (ÏÏÎđ ÎąÎ―ÎąÎŧÏ
ÏÎđΚΎ ÎŋÎđ ÎīÎĩÏΞÎŋÎŊ). ÎÎŋΞÎđΚΎ ÏÏΞιÏÎŊÎīÎđÎą ÏÎ·Ï ÏÎŧÎ·Ï - ÎÎŋΞÎŪ ÏÎŋÏ
ÎąÏÏΞÎŋÏ




ÎÎŋΞÎđΚΎ ÏÏΞιÏÎŊÎīÎđÎą ÏÎ·Ï ÏÎŧÎ·Ï - ÎÎŋΞÎŪ ÏÎŋÏ
ÎąÏÏΞÎŋÏ
ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞιDimitris Kontoudakis
Ėý
ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ 2Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ (ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι) ÏÎ·Ï ÎĶÏ
ÏÎđΚÎŪÏ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
, ÏÎŋ ÎŋÏÎŋÎŊÎŋ ÏÎĩÏÎđÎÏÎĩÎđ:
ÎĢÏÎ―ÎŋÏη ÎÎĩÏÏÎŊÎąÏ (ΞÎĩ Ïη ΞÎŋÏÏÎŪ ÎĩÏÏÏηÏÎ·Ï - ÎąÏÎŽÎ―ÏηÏηÏ)
ÎĪÏ
ÏÎŋÎŧÏÎģÎđÎŋ
2 ÎÎđÎąÎģÏÎ―ÎŊÏΞιÏÎą (ΞÎĩ ÏÎđÏ ÎąÏÎąÎ―ÏÎŪÏÎĩÎđÏ ÏÎŋÏ
Ï)ÏÎĩÏÎđÎŋÎīÎđΚÏÏ ÏÎŊÎ―ÎąÎšÎąÏ ÏηΞÎĩÎŊÎą Î'ÎģÏ
ÎžÎ―ÎąÏÎŊÎŋÏ




ÏÎĩÏÎđÎŋÎīÎđΚÏÏ ÏÎŊÎ―ÎąÎšÎąÏ ÏηΞÎĩÎŊÎą Î'ÎģÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
kostaschatz2001
Ėý
ÎÏÎĩÎđ ÎīÎđÎŽÏÎŋÏÎĩÏ ÎšÎąÎđ ÏÎ·ÎžÎąÎ―ÏÎđΚÎÏ ÏÎŧηÏÎŋÏÎŋÏÎŊÎĩÏ ÏÏÎŋ ÎąÎ―ÎąÏÎŋÏÎŽ ÎļÎΞιÏÎą ÏÎŋÏ
ÏÎĩÏÎđÎŋÎīÎđΚÎŋÏ ÏÎŊÎ―ÎąÎšÎą. ÎĪÎŋ ÏÏ
Î―ÎđÏÏÏ ÎģÎđÎą ÏÎąÎđÎīÎđÎŽ Î'ÎģÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
ÏÎŋÏ
ÎļÎą ÎģÏÎŽÏÎŋÏ
Î― ÎīÎđÎąÎģÏÎ―ÎŊÏΞιÏÎą ΞÎĩ ÎēÎŽÏη ÎąÏ
ÏÏÎ―.Biology a lyk-kef3



Biology a lyk-kef3ht101
Ėý
ÎÎđÎŋÎŧÎŋÎģÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ΚÎĩÏÎŽÎŧÎąÎđÎŋ 3 (ÎĪÎŋ ΚÏ
ΚÎŧÎŋÏÎŋÏÎđÎšÏ ÏÏÏÏηΞι)Î ÎÎĄÎÎÎĐÎÎ ÎĄÎÎÎÎĪÎĐÎ



Î ÎÎĄÎÎÎĐÎÎ ÎĄÎÎÎÎĪÎĐÎmono030156
Ėý
Î ÎĩÏÎđÎÏÎĩÎđ ÏÎąÏÎŽÎģÏÎģÎą ÎēÎąÏÎđΚÏÎ― ÏηΞΎÏÏÎ― ÏÎ·Ï ÎÏÏÎąÎŊÎąÏ ÎÎŧÎŧÎ·Î―ÎđΚÎŪÏTÏÎŋÏÎđΚÎÏ ÏÏÎÏÎĩÎđÏ ÎšÎąÎđ ÏÎŋÎŪ ÎĩÎ―ÎÏÎģÎĩÎđÎąÏ



TÏÎŋÏÎđΚÎÏ ÏÏÎÏÎĩÎđÏ ÎšÎąÎđ ÏÎŋÎŪ ÎĩÎ―ÎÏÎģÎĩÎđÎąÏDespina Setaki
Ėý
ÎÎđÎŋÎŧÎŋÎģÎŊÎą Îē' ÎģÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
, ÏÏÎŋÏÎđΚÎÏ ÏÏÎÏÎĩÎđÏ, ÎŋÎđΚÎŋÏÏÏÏηΞιÎÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏ



ÎÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏDimPapadopoulos
Ėý
Î ÎĩÏÎđÎģÏÎąÏÎŪ ÎąÎ―ÏÎđÎīÏÎŽÏÎĩÏÎ― ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏ ÎģÎđÎą ÏÎŋ ΞΎÎļηΞι ÏÎ·Ï Î§Î·ÎžÎĩÎŊÎąÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
.ÎÎÎÎÎĪÎĄÎÎÎAÎÎ ÎÎÎÎ ÎĪâĶÎ ÎÎĪÎÎâĶÎ



ÎÎÎÎÎĪÎĄÎÎÎAÎÎ ÎÎÎÎ ÎĪâĶÎ ÎÎĪÎÎâĶÎÎÎĩÏÎīÏÏÎŋÏ ÎÎąÏÎąÎģΚÎŋÏÎŧÎąÏ
Ėý
ÎÏÎŋΞÎđΚÎŪ ÎīÎŋΞÎŪ ΚιÎđ ΚιÏÎąÎ―ÎŋΞÎŪ ÏÏÎ― ηÎŧÎĩΚÏÏÎŋÎ―ÎŊÏÎ― ÏÏÎđÏ ÏÏÎđÎēÎŽÎīÎĩÏ ÎĩÎ―ÏÏ ÎąÏÏΞÎŋÏ
More Related Content
What's hot (20)
Biology a lyk-kef9



Biology a lyk-kef9ht101
Ėý
ÎÎđÎŋÎŧÎŋÎģÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ÎÎĩÏÎŽÎŧÎąÎđÎŋ 9 - ÎĪÎŋ Î―ÎĩÏ
ÏÎđÎšÏ ÏÏÏÏηΞιΧÎÎÎÎÎÎĢ ÎÎÎĪÎÎÎĄÎÎĢÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨ



ΧÎÎÎÎÎÎĢ ÎÎÎĪÎÎÎĄÎÎĢÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎĩÏÏÎŊÎą ÎąÎ―ÏÎđÎīÏÎŽÏÎĩÏÎ― ÎąÏÎŧÎŪÏ ÎšÎąÎđ ÎīÎđÏÎŧÎŪÏ ÎąÎ―ÏÎđΚιÏÎŽÏÏÎąÏηÏÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ΧηΞÎĩÎŊÎą ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
- 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋ



ÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ΧηΞÎĩÎŊÎą ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
- 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÎđÎŧÎŋÎģÎŪ ÎąÏΚÎŪÏÎĩÏÎ― ÎąÏÏ ÏÎ·Î― ÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ΧηΞÎĩÎŊÎą ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
ÏÏÎŋ 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋ (ÎÎŧÎĩΚÏÏÎŋÎ―ÎđιΚÎŪ ÎīÎŋΞÎŪ, Î ÎĩÏÎđÎŋÎīÎđΚÏÏ Î ÎŊÎ―ÎąÎšÎąÏ, ΧηΞÎđΚÎŋÎŊ ÎīÎĩÏΞÎŋÎŊ)ÎÎĨÎÎÎÎĶÎÎĄÎÎÎ ÎĢÎĨÎĢÎĪÎÎÎ



ÎÎĨÎÎÎÎĶÎÎĄÎÎÎ ÎĢÎĨÎĢÎĪÎÎÎkatkalos
Ėý
ÎÎÎÎÎÎÎÎ
ÎĨÎŧÎđÎšÏ ÎÎąÎļÎŪΞιÏÎŋÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ÏÎļÎÎ―ÎŋÏ
Ï ÎąÏÎŋΞÎđΚÎŪ ιΚÏÎŊÎ―Îą(Îą ÎŧÏ
Κ)



ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ÏÎļÎÎ―ÎŋÏ
Ï ÎąÏÎŋΞÎđΚÎŪ ιΚÏÎŊÎ―Îą(Îą ÎŧÏ
Κ)ÎÏÎ―ÏÏÎąÎ―ÏÎŊÎ―ÎŋÏ Î§.
Ėý
ÎÏÎģÎąÎ―ÎđΚÎŪ ΧηΞÎĩÎŊÎą - ÎÎđÏÎąÎģÏÎģÎŪ



ÎÏÎģÎąÎ―ÎđΚÎŪ ΧηΞÎĩÎŊÎą - ÎÎđÏÎąÎģÏÎģÎŪcathykaki
Ėý
ÎĪÎđ ÎĩÎŊÎ―ÎąÎđ
ÎĪÎđ ΞÎĩÎŧÎĩÏÎŽ
ÎĪÎąÎūÎđÎ―ÏΞηÏη
ÎÎ―ÎŋΞιÏÎŋÎŧÎŋÎģÎŊÎąÎąÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏ



ÎąÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏÎÏÎŽÎ―Î―Î·Ï ÎÎđÏÎ―ÏÎŋÏ
Ėý
Î ÎĩÏÎđÎģÏÎŽÏÎŋÎ―ÏÎąÎđ ÎŋÎđ ÎąÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎŊÎīÏÏÎ·Ï ÏÏÎ― ÎŋÏÎģÎąÎ―ÎđΚÏÎ― ÎĩÎ―ÏÏÎĩÏÎ― ÏÏÎ·Î― ÎÏÎģÎąÎ―ÎđΚÎŪ ΧηΞÎĩÎŊÎą ÎÎÎÏ
ΚÎĩÎŊÎŋÏ
ÎļÎĩÏÎđΚÎŪÏ ÎšÎąÏÎĩÏÎļÏ
Î―ÏηÏÎÏÏÏÎąÏÎą ΚιÎđ ÎđÏÏÎŋÎđ



ÎÏÏÏÎąÏÎą ΚιÎđ ÎđÏÏÎŋÎđGepsi Mos
Ėý
ÎĪÎą ÎĩÎŊÎīη ÎđÏÏÏÎ― ÏÏÎŋ ÎąÎ―ÎļÏÏÏÎđÎ―Îŋ ÏÏΞι, ÎÎđÎŋÎŧÎŋÎģÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
, didaskw.blogspot.grΧηΞÎĩÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ΧηΞÎđΚÎŋÎŊ ÎīÎĩÏΞÎŋÎŊ (Inter learning)



ΧηΞÎĩÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ΧηΞÎđΚÎŋÎŊ ÎīÎĩÏΞÎŋÎŊ (Inter learning)inter_learning
Ėý
ÎÎđÏÎąÎģÏÎģÎŪ ΚιÎđ ÎąÎ―ÎŽÎŧÏ
Ïη ÏÏÎ― ÏηΞÎđΚÏÎ― ÎīÎĩÏΞÏÎ―, ÎĩÏÎĩÏÎŋÏÎŋÎŧÎđΚÏÏ - ÎđÎŋÎ―ÏÎđΚÏÏ ÎšÎąÎđ ÎŋΞÎŋÎđÎŋÏÎŋÎŧÎđΚÏÏ ÎīÎĩÏΞÏÏ, ÎđÎīÎđÏÏηÏÎĩÏ, ÏÎąÏΚÏηÏÎđÏÏÎđΚΎ, ÎŋΞÎŋÎđÏÏηÏÎĩÏ ÎšÎąÎđ ÎīÎđÎąÏÎŋÏÎÏ ÏÎŋÏ
Ï. 2Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ ÏηΞÎĩÎŊÎą Îē ÎŧÏ
ΚÎĩÎŊÎŋÏ
ÎģÎĩÎ―ÎđΚÎŪÏ ÏÎąÎđÎīÎĩÎŊÎąÏ ÎąÏΚÎŪÏÎĩÎđÏ 2014_2015



2Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ ÏηΞÎĩÎŊÎą Îē ÎŧÏ
ΚÎĩÎŊÎŋÏ
ÎģÎĩÎ―ÎđΚÎŪÏ ÏÎąÎđÎīÎĩÎŊÎąÏ ÎąÏΚÎŪÏÎĩÎđÏ 2014_2015DimPapadopoulos
Ėý
ChemistryÎŽÏÎŋΞι ΞÏÏÎđÎą-ÎđÏÎ―ÏÎą (ÎąÎÎŧÏ
Κ)



ÎŽÏÎŋΞι ΞÏÏÎđÎą-ÎđÏÎ―ÏÎą (ÎąÎÎŧÏ
Κ)ÎÏÎŽÎ―Î―Î·Ï ÎÎđÏÎ―ÏÎŋÏ
Ėý
Î ÎĩÏÎđÎģÏÎąÏÎŪ ÎąÏÏΞÏÎ―. ÎÎąÏÎąÎ―ÎŋΞÎŪ ΚιÎđ ΚÎđÎ―ÎŪÏÎĩÎđÏ Î·ÎŧÎĩΚÏÏÎŋÎ―ÎđÏÎ―, ÎīηΞÎđÎŋÏ
ÏÎģÎŊÎą ÎđÏÎ―ÏÏÎ―, ΞÎŋÏÎŊÏÎ― ΚιÎđ ÎđÎŋÎ―ÏÎđΚÏÎ― ÎĩÎ―ÏÏÎĩÏÎ― (ÏÏÎđ ÎąÎ―ÎąÎŧÏ
ÏÎđΚΎ ÎŋÎđ ÎīÎĩÏΞÎŋÎŊ). ÎÎŋΞÎđΚΎ ÏÏΞιÏÎŊÎīÎđÎą ÏÎ·Ï ÏÎŧÎ·Ï - ÎÎŋΞÎŪ ÏÎŋÏ
ÎąÏÏΞÎŋÏ




ÎÎŋΞÎđΚΎ ÏÏΞιÏÎŊÎīÎđÎą ÏÎ·Ï ÏÎŧÎ·Ï - ÎÎŋΞÎŪ ÏÎŋÏ
ÎąÏÏΞÎŋÏ
ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞιDimitris Kontoudakis
Ėý
ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ 2Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ (ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι) ÏÎ·Ï ÎĶÏ
ÏÎđΚÎŪÏ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
, ÏÎŋ ÎŋÏÎŋÎŊÎŋ ÏÎĩÏÎđÎÏÎĩÎđ:
ÎĢÏÎ―ÎŋÏη ÎÎĩÏÏÎŊÎąÏ (ΞÎĩ Ïη ΞÎŋÏÏÎŪ ÎĩÏÏÏηÏÎ·Ï - ÎąÏÎŽÎ―ÏηÏηÏ)
ÎĪÏ
ÏÎŋÎŧÏÎģÎđÎŋ
2 ÎÎđÎąÎģÏÎ―ÎŊÏΞιÏÎą (ΞÎĩ ÏÎđÏ ÎąÏÎąÎ―ÏÎŪÏÎĩÎđÏ ÏÎŋÏ
Ï)ÏÎĩÏÎđÎŋÎīÎđΚÏÏ ÏÎŊÎ―ÎąÎšÎąÏ ÏηΞÎĩÎŊÎą Î'ÎģÏ
ÎžÎ―ÎąÏÎŊÎŋÏ




ÏÎĩÏÎđÎŋÎīÎđΚÏÏ ÏÎŊÎ―ÎąÎšÎąÏ ÏηΞÎĩÎŊÎą Î'ÎģÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
kostaschatz2001
Ėý
ÎÏÎĩÎđ ÎīÎđÎŽÏÎŋÏÎĩÏ ÎšÎąÎđ ÏÎ·ÎžÎąÎ―ÏÎđΚÎÏ ÏÎŧηÏÎŋÏÎŋÏÎŊÎĩÏ ÏÏÎŋ ÎąÎ―ÎąÏÎŋÏÎŽ ÎļÎΞιÏÎą ÏÎŋÏ
ÏÎĩÏÎđÎŋÎīÎđΚÎŋÏ ÏÎŊÎ―ÎąÎšÎą. ÎĪÎŋ ÏÏ
Î―ÎđÏÏÏ ÎģÎđÎą ÏÎąÎđÎīÎđÎŽ Î'ÎģÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
ÏÎŋÏ
ÎļÎą ÎģÏÎŽÏÎŋÏ
Î― ÎīÎđÎąÎģÏÎ―ÎŊÏΞιÏÎą ΞÎĩ ÎēÎŽÏη ÎąÏ
ÏÏÎ―.Biology a lyk-kef3



Biology a lyk-kef3ht101
Ėý
ÎÎđÎŋÎŧÎŋÎģÎŊÎą Î' ÎÏ
ΚÎĩÎŊÎŋÏ
- ΚÎĩÏÎŽÎŧÎąÎđÎŋ 3 (ÎĪÎŋ ΚÏ
ΚÎŧÎŋÏÎŋÏÎđÎšÏ ÏÏÏÏηΞι)Î ÎÎĄÎÎÎĐÎÎ ÎĄÎÎÎÎĪÎĐÎ



Î ÎÎĄÎÎÎĐÎÎ ÎĄÎÎÎÎĪÎĐÎmono030156
Ėý
Î ÎĩÏÎđÎÏÎĩÎđ ÏÎąÏÎŽÎģÏÎģÎą ÎēÎąÏÎđΚÏÎ― ÏηΞΎÏÏÎ― ÏÎ·Ï ÎÏÏÎąÎŊÎąÏ ÎÎŧÎŧÎ·Î―ÎđΚÎŪÏTÏÎŋÏÎđΚÎÏ ÏÏÎÏÎĩÎđÏ ÎšÎąÎđ ÏÎŋÎŪ ÎĩÎ―ÎÏÎģÎĩÎđÎąÏ



TÏÎŋÏÎđΚÎÏ ÏÏÎÏÎĩÎđÏ ÎšÎąÎđ ÏÎŋÎŪ ÎĩÎ―ÎÏÎģÎĩÎđÎąÏDespina Setaki
Ėý
ÎÎđÎŋÎŧÎŋÎģÎŊÎą Îē' ÎģÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
, ÏÏÎŋÏÎđΚÎÏ ÏÏÎÏÎĩÎđÏ, ÎŋÎđΚÎŋÏÏÏÏηΞιÎÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏ



ÎÎ―ÏÎđÎīÏÎŽÏÎĩÎđÏ ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏDimPapadopoulos
Ėý
Î ÎĩÏÎđÎģÏÎąÏÎŪ ÎąÎ―ÏÎđÎīÏÎŽÏÎĩÏÎ― ÎŋÎūÎĩÎđÎīÎŋÎąÎ―ÎąÎģÏÎģÎŪÏ ÎģÎđÎą ÏÎŋ ΞΎÎļηΞι ÏÎ·Ï Î§Î·ÎžÎĩÎŊÎąÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
.ÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ΧηΞÎĩÎŊÎą ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
- 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋ



ÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ΧηΞÎĩÎŊÎą ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
- 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ÏÎļÎÎ―ÎŋÏ
Ï ÎąÏÎŋΞÎđΚÎŪ ιΚÏÎŊÎ―Îą(Îą ÎŧÏ
Κ)



ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ÏÎļÎÎ―ÎŋÏ
Ï ÎąÏÎŋΞÎđΚÎŪ ιΚÏÎŊÎ―Îą(Îą ÎŧÏ
Κ)ÎÏÎ―ÏÏÎąÎ―ÏÎŊÎ―ÎŋÏ Î§.
Ėý
2Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ ÏηΞÎĩÎŊÎą Îē ÎŧÏ
ΚÎĩÎŊÎŋÏ
ÎģÎĩÎ―ÎđΚÎŪÏ ÏÎąÎđÎīÎĩÎŊÎąÏ ÎąÏΚÎŪÏÎĩÎđÏ 2014_2015



2Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ ÏηΞÎĩÎŊÎą Îē ÎŧÏ
ΚÎĩÎŊÎŋÏ
ÎģÎĩÎ―ÎđΚÎŪÏ ÏÎąÎđÎīÎĩÎŊÎąÏ ÎąÏΚÎŪÏÎĩÎđÏ 2014_2015DimPapadopoulos
Ėý
ÎÎŋΞÎđΚΎ ÏÏΞιÏÎŊÎīÎđÎą ÏÎ·Ï ÏÎŧÎ·Ï - ÎÎŋΞÎŪ ÏÎŋÏ
ÎąÏÏΞÎŋÏ




ÎÎŋΞÎđΚΎ ÏÏΞιÏÎŊÎīÎđÎą ÏÎ·Ï ÏÎŧÎ·Ï - ÎÎŋΞÎŪ ÏÎŋÏ
ÎąÏÏΞÎŋÏ
ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
![[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞι](https://cdn.slidesharecdn.com/ss_thumbnails/02-161214022842-thumbnail.jpg?width=560&fit=bounds)
[ÎĶÏ
ÏÎđΚÎŪ ÎÂī ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
] ÎĶÏ
ÎŧÎŧÎŽÎīÎđÎŋ ÎģÎđÎą ÏÎŋ ÎÎŧÎĩΚÏÏÎđÎšÏ ÎĄÎĩÏΞιDimitris Kontoudakis
Ėý
Similar to ÎÎŧÎĩΚÏÏÎŋÎ―ÎđιΚÎŪ ÎīÎŋΞÎŪ ÏÏÎ― ÎąÏÏΞÏÎ― (20)
ÎÎÎÎÎĪÎĄÎÎÎAÎÎ ÎÎÎÎ ÎĪâĶÎ ÎÎĪÎÎâĶÎ



ÎÎÎÎÎĪÎĄÎÎÎAÎÎ ÎÎÎÎ ÎĪâĶÎ ÎÎĪÎÎâĶÎÎÎĩÏÎīÏÏÎŋÏ ÎÎąÏÎąÎģΚÎŋÏÎŧÎąÏ
Ėý
ÎÏÎŋΞÎđΚÎŪ ÎīÎŋΞÎŪ ΚιÎđ ΚιÏÎąÎ―ÎŋΞÎŪ ÏÏÎ― ηÎŧÎĩΚÏÏÎŋÎ―ÎŊÏÎ― ÏÏÎđÏ ÏÏÎđÎēÎŽÎīÎĩÏ ÎĩÎ―ÏÏ ÎąÏÏΞÎŋÏ
ÎąÏÎŋΞÎđΚΎ ÏÎąÎđÎ―ÏΞÎĩÎ―Îą



ÎąÏÎŋΞÎđΚΎ ÏÎąÎđÎ―ÏΞÎĩÎ―ÎąGiannis Stathis
Ėý
ÎĢÏ
Î―ÎŋÏÏÎđΚÎŪ ÏÎąÏÎŋÏ
ÏÎđÎŽÏη ÏÎ·Ï ÏÎŧηÏ. ÎĪÎŋ ÎąÏÏÎĩÎŊÎŋ ÎļÎą ÏÏ
ΞÏÎŧηÏÏÎ―ÎĩÏÎąÎđ ΚιÎđ ÎļÎą ÎąÎ―ÎąÎēÎąÎļΞÎŊÎķÎĩÏÎąÎđ ÎąÎ―ÎŽÎŧÎŋÎģÎą ΞÎĩ ÏÎđÏ ÎąÏÎąÎđÏÎŪÏÎĩÎđÏ ÎšÎąÎđ ÏÎđÏ ÏÎąÏÎąÏηÏÎŪÏÎĩÎđÏ ÏÎąÏ.Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2006/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏ



Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2006/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏHOME
Ėý
Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2006/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏ
ÏÏÏÏ ÎÏÎŋÏ
Î― ÎīηΞÎŋÏÎđÎĩÏ
ÎļÎĩÎŊ ÏÏÎŋÎ― ÎđÏÏÏÏÎŋÏÎŋ "micro-kosmos"
ÎΎΞÏÏÎŋÏ ÎÎīΎΞ
www.lam-lab.com
adamlscp@gmail.comÎÎŋΞÎŪ ÎąÏÏΞÎŋÏ
ΚιÏÎŽ Bohr



ÎÎŋΞÎŪ ÎąÏÏΞÎŋÏ
ΚιÏÎŽ BohrDimPapadopoulos
Ėý
Î ÎĩÏÎđÎģÏÎąÏÎŪ ÏÎ·Ï ÎīÎŋΞÎŪÏ ÏÎŋÏ
ÎąÏÏΞÎŋÏ
ΞÎĩ ÎēÎŽÏη Ïη ÎļÎĩÏÏÎŊÎą ÏÎŋÏ
Bohr.Exercises22



Exercises22Marios Costa
Ėý
ÎÏΚÎŪÏÎĩÎđÏ ÎąÏÏ ÎÎđÎēÎŧÎŊÎŋ: Î ÎąÎ―ÎĩÏÎđÏÏηΞÎđιΚÎŪ ÏÏ
ÏÎđΚÎŪ (ÏÏΞÎŋÏ 1 ΚιÎđ ÏÏΞÎŋÏ 2), D. Young Hugh, ÎĩΚÎīÏÏÎĩÎđÏ Î ÎąÏÎąÎķÎŪÏη.ÎīÎŋΞÎŪ ÎąÏÏΞÎŋÏ
ΚιÏÎŽ Bohr



ÎīÎŋΞÎŪ ÎąÏÏΞÎŋÏ
ΚιÏÎŽ BohrDimPapadopoulos
Ėý
ÎÎŊÎ―ÎŋÎ―ÏÎąÎđ ÏÎŧηÏÎŋÏÎŋÏÎŊÎĩÏ ÎģÎđÎą Ïη ÎīÎŋΞÎŪ ÎąÏÏΞÎŋÏ
ΚιÏÎŽ Bohr.ÎÏÏÏηΞÎŋ ÎĶÏÎŋÎ―ÏÎđÏÏÎŪÏÎđÎŋ (ÎÎļÎŪÎ―Îą). ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚΎ ÎļÎΞιÏÎą ÏÎąÎ―ÎĩÎŧÎŧÎ·Î―ÎŊÏÎ― 2015 |



ÎÏÏÏηΞÎŋ ÎĶÏÎŋÎ―ÏÎđÏÏÎŪÏÎđÎŋ (ÎÎļÎŪÎ―Îą). ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚΎ ÎļÎΞιÏÎą ÏÎąÎ―ÎĩÎŧÎŧÎ·Î―ÎŊÏÎ― 2015 |ÎÏÏÏηΞÎŋ ÎĶÏÎŋÎ―ÏÎđÏÏÎŪÏÎđÎŋ (ÎÎļÎŪÎ―Îą) ÎÎÏÎ·Ï ÎΚÏÎąÎŊÎīÎĩÏ
ÏηÏ
Ėý
ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚΎ ÎļÎΞιÏÎą ÏÎąÎ―ÎĩÎŧÎŧÎ·Î―ÎŊÏÎ― 2015 ÎąÏÏ ÏÎŋ ÏÏÎŋÎ―ÏÎđÏÏÎŪÏÎđÎŋ ΞÎÏÎ·Ï ÎĩΚÏÎąÎŊÎīÎĩÏ
ÏÎ·Ï ÎÏÏÏηΞÎŋ (ÎÎļÎŪÎ―Îą). ÎÎŽÎļÎĩÏÎĩ ÏÎĩÏÎđÏÏÏÏÎĩÏÎą ÏÏÎŋ http://www.frontistiria.edu.gr/Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2007/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏ



Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2007/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏHOME
Ėý
Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2007/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏ
ÏÏÏÏ ÎÏÎŋÏ
Î― ÎīηΞÎŋÏÎđÎĩÏ
ÎļÎĩÎŊ ÏÏÎŋÎ― ÎđÏÏÏÏÎŋÏÎŋ "micro-kosmos"
ÎΎΞÏÏÎŋÏ ÎÎīΎΞ
www.lam-lab.com
adamlscp@gmail.comï Î ÎĩÏÎđÎģÏÎąÏÎŪ ÏÎŋÏ
ÎąÏÎŋΞÎđΚÎŋÏ ÏÏÎŋÏÏÏÎŋÏ
ÏÎŋÏ
BÎÎ



ï Î ÎĩÏÎđÎģÏÎąÏÎŪ ÏÎŋÏ
ÎąÏÎŋΞÎđΚÎŋÏ ÏÏÎŋÏÏÏÎŋÏ
ÏÎŋÏ
BÎÎDiatsigosJim1
Ėý
ÎÏÏÏ ÎąÏÏ ÏÎŋÎ― ÏÏ
ÏÎŪÎ―Îą ÏÎĩ ΚιÎļÎŋÏÎđÏΞÎÎ―ÎĩÏ (ÎĩÏÎđÏÏÎĩÏÏÎÏ) ΚÏ
ΚÎŧÎđΚÎÏ ÏÏÎŋÏÎđÎÏ ÎšÎđÎ―ÎŋÏÎ―ÏÎąÎđ ÏÎą ηÎŧÎĩΚÏÏÏÎ―ÎđÎą
Periodic table -enriched



Periodic table -enrichedDespina Setaki
Ėý
Î ÎĩÏÎđÎŋÎīÎđΚÏÏ Î ÎŊÎ―ÎąÎšÎąÏ ÎģÎđÎą Î' ÎÏ
ÎžÎ―ÎąÏÎŊÎŋÏ
ΞÎĩ ÏÏÎŋÎΚÏÎąÏη ÏÏÎ·Î― Î ÎÏ
ΚÎĩÎŊÎŋÏ
ΞÎĩÏÎąÎēÎŋÎŧÎŪ ÎŋÏÎđÏΞÎÎ―ÏÎ― ÏÎĩÏÎđÎŋÎīÎđΚÏÎ― ÎđÎīÎđÎŋÏÎŪÏÏÎ―



ΞÎĩÏÎąÎēÎŋÎŧÎŪ ÎŋÏÎđÏΞÎÎ―ÏÎ― ÏÎĩÏÎđÎŋÎīÎđΚÏÎ― ÎđÎīÎđÎŋÏÎŪÏÏÎ―DimPapadopoulos
Ėý
ÎÎŊÎ―ÎŋÎ―ÏÎąÎđ ÏÎŧηÏÎŋÏÎŋÏÎŊÎĩÏ ÎģÎđÎą ÏÎŋ ÏÏÏ ÎžÎĩÏÎąÎēÎŽÎŧÎŧÎĩÏÎąÎđ ÏÏÎŋÎ― ÏÎĩÏÎđÎŋÎīÎđÎšÏ ÏÎŊÎ―ÎąÎšÎą η ÎąÏÎŋΞÎđΚÎŪ ιΚÏÎŊÎ―Îą ΚιÎđ η ÎĩÎ―ÎÏÎģÎĩÎđÎą ÎđÎŋÎ―ÏÎđÏΞÎŋÏ ÏÏÎ― ÏÏÎŋÎđÏÎĩÎŊÏÎ―.Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2006/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏ



Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2006/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏHOME
Ėý
ÎÏÏÏηΞÎŋ ÎĶÏÎŋÎ―ÏÎđÏÏÎŪÏÎđÎŋ (ÎÎļÎŪÎ―Îą). ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚΎ ÎļÎΞιÏÎą ÏÎąÎ―ÎĩÎŧÎŧÎ·Î―ÎŊÏÎ― 2015 |



ÎÏÏÏηΞÎŋ ÎĶÏÎŋÎ―ÏÎđÏÏÎŪÏÎđÎŋ (ÎÎļÎŪÎ―Îą). ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚΎ ÎļÎΞιÏÎą ÏÎąÎ―ÎĩÎŧÎŧÎ·Î―ÎŊÏÎ― 2015 |ÎÏÏÏηΞÎŋ ÎĶÏÎŋÎ―ÏÎđÏÏÎŪÏÎđÎŋ (ÎÎļÎŪÎ―Îą) ÎÎÏÎ·Ï ÎΚÏÎąÎŊÎīÎĩÏ
ÏηÏ
Ėý
Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2007/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏ



Î ÎąÎ―ÎĩÎŧÎŧÎŪÎ―ÎđÎŋÏ ÎÎđÎąÎģÏÎ―ÎđÏΞÏÏ ÎĶÏ
ÏÎđΚÎŪÏ BÎ ÎÏ
ΚÎĩÎŊÎŋÏ
2007/ ÎÎΞιÏÎą ΚιÎđ ÎÏÏÎĩÎđÏHOME
Ėý
More from ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ (20)
YÎīÏÎŋÎģÎŋÎ―ÎŽÎ―ÎļÏιΚÎĩÏ ÎÎÎÏ
ΚÎĩÎŊÎŋÏ
2016 17



YÎīÏÎŋÎģÎŋÎ―ÎŽÎ―ÎļÏιΚÎĩÏ ÎÎÎÏ
ΚÎĩÎŊÎŋÏ
2016 17ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÏÏÎŪÏÎĩÎđÏ-ÎÏΚÎŪÏÎĩÎđÏ ÏÏÎŋÏ
Ï Ï
ÎīÏÎŋÎģÎŋÎ―ÎŽÎ―ÎļÏιΚÎĩÏ Î§Î·ÎžÎĩÎŊÎą ÎÎÎÏ
ΚÎĩÎŊÎŋÏ
2016-17EÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÏÏÎ·Î― ÎđÎŋÎ―ÏÎđΚÎŪ ÎđÏÎŋÏÏÎŋÏÎŊÎą



EÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÏÏÎ·Î― ÎđÎŋÎ―ÏÎđΚÎŪ ÎđÏÎŋÏÏÎŋÏÎŊÎąÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÏÏÎą ÎīÎđÎąÎŧÏΞιÏÎą ηÎŧÎĩΚÏÏÎŋÎŧÏ
ÏÏÎ― (5Îŋ ΚÎĩÏÎŽÎŧÎąÎđÎŋ ΧηΞÎĩÎŊÎąÏ ÎÎÎÏ
ΚÎĩÎŊÎŋÏ
)ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÎšÎĩÏ.4 ÎÎÎŧÏ
Κ 2015-16



ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÎšÎĩÏ.4 ÎÎÎŧÏ
Κ 2015-16ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏÏÏη ÏηΞÎđΚÎŪ ÎđÏÎŋÏÏÎŋÏÎŊÎą (ÎÎĩÏ.4) ÎÎÎŧÏ
Κ (2015-16)ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎÏΚÎŪÏÎĩÎđÏ Î§Î·ÎžÎĩÎŊÎąÏ Î' ÎÏ
ΚÎĩÎŊÎŋÏ




ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎÏΚÎŪÏÎĩÎđÏ Î§Î·ÎžÎĩÎŊÎąÏ Î' ÎÏ
ΚÎĩÎŊÎŋÏ
ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎÏΚÎŪÏÎĩÎđÏ Î§Î·ÎžÎĩÎŊÎąÏ Î' ÎÏ
ΚÎĩÎŊÎŋÏ
, ÎŋÎđ ÎŋÏÎŋÎŊÎĩÏ ÎžÏÎŋÏÎŋÏÎ― Î―Îą ÏÎĩÎļÎŋÏÎ― ÏÏ 3Îŋ ÎŪ 4Îŋ ÎļÎΞι ÎĩÎūÎĩÏÎŽÏÎĩÏÎ―ÎÏÏÏÎŪÏÎĩÎđÏ ÏÎŋÎŧÎŧÎąÏÎŧÎŪÏ ÎĩÏÎđÎŧÎŋÎģÎŪÏ Î§Î·ÎžÎĩÎŊÎąÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ




ÎÏÏÏÎŪÏÎĩÎđÏ ÏÎŋÎŧÎŧÎąÏÎŧÎŪÏ ÎĩÏÎđÎŧÎŋÎģÎŪÏ Î§Î·ÎžÎĩÎŊÎąÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÏÏÎŪÏÎĩÎđÏ ÏÎŋÎŧÎŧÎąÏÎŧÎŪÏ ÎĩÏÎđÎŧÎŋÎģÎŪÏ ÏÎŋÏ
ΚιÎŧÏÏÏÎŋÏ
Î― ÎŋÎŧÏΚÎŧηÏη ÏÎ·Î― ÏÎŧη ÏÎ·Ï ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
ÎÎĢÎÎÎĢÎÎÎĢ ÎĢÎĪÎ ÎÎÎÎ (4Îŋ ÎÎÎĶÎÎÎÎÎ ÎÎ ÎÎĨÎÎÎÎÎĨ)



ÎÎĢÎÎÎĢÎÎÎĢ ÎĢÎĪÎ ÎÎÎÎ (4Îŋ ÎÎÎĶÎÎÎÎÎ ÎÎ ÎÎĨÎÎÎÎÎĨ)ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏΚÎŪÏÎĩÎđÏ ÏÏÎą ΚÎŋÏÎĩÏΞÎÎ―Îą ΞÎŋÎ―ÎŋΚιÏÎēÎŋÎūÏ
ÎŧÎđΚΎ ÎŋÎūÎÎąÎÎĢÎÎÎĢÎÎÎĢ ÎĢÎĪÎÎĢ ÎÎÎÎÎÎÎÎĢ (3Îŋ ÎÎÎĶÎÎÎÎÎ ÎÎ ÎÎĨÎÎÎÎÎĨ)



ÎÎĢÎÎÎĢÎÎÎĢ ÎĢÎĪÎÎĢ ÎÎÎÎÎÎÎÎĢ (3Îŋ ÎÎÎĶÎÎÎÎÎ ÎÎ ÎÎĨÎÎÎÎÎĨ)ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎĢÎÎÎĢÎÎÎĢ 2ÎŋÏ
ÎÎÎĶÎÎÎÎÎÎĨ ΧÎÎÎÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨ ÎÎ Î ÎĪÎĄÎÎ ÎÎÎ ÎÎÎÎÎĪÎĐÎ



ÎÎĢÎÎÎĢÎÎÎĢ 2ÎŋÏ
ÎÎÎĶÎÎÎÎÎÎĨ ΧÎÎÎÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨ ÎÎ Î ÎĪÎĄÎÎ ÎÎÎ ÎÎÎÎÎĪÎĐÎÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
Î ÎĩÏÎđÎÏÎŋÎ―ÏÎąÎđ ÏÎŧÎĩÏ ÎŋÎđ ÎąÏΚÎŪÏÎĩÎđÏ (4Îŋ ÎļÎΞι) ÎąÏÏ ÏÎ·Î― ÎĪÏÎŽÏÎĩÎķÎą ÎÎĩΞΎÏÏÎ― ÏÏÎŋ 2Îŋ ÎÎĩÏÎŽÎŧÎąÎđÎŋ ΧηΞÎĩÎŊÎąÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
ÏÎŋÏ
ÎąÎ―ÎąÏÏÎŪÎļÎ·ÎšÎąÎ― ΞÎÏÏÎđ ΚιÎđ ÏÎŋ ÎÎĩΚÎΞÎēÏÎđÎŋ ÏÎŋÏ
2014.ÎÎĢÎÎÎĢÎÎÎĢ ÎÎÎÎÎÎĪÎÎÎÎÎÎÎĢ-ÎÎĢÎÎÎÎĄÎÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨ



ÎÎĢÎÎÎĢÎÎÎĢ ÎÎÎÎÎÎĪÎÎÎÎÎÎÎĢ-ÎÎĢÎÎÎÎĄÎÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎÎÎÎĪΠΧÎÎÎÎÎÎĢ-ÎÎÎΧÎÎÎÎÎÎĢ ÎĪÎΧÎÎÎÎÎÎÎÎÎĢ ÎÎÎĪ/ÎĢÎÎĢ 2013



ÎÎÎÎÎĪΠΧÎÎÎÎÎÎĢ-ÎÎÎΧÎÎÎÎÎÎĢ ÎĪÎΧÎÎÎÎÎÎÎÎÎĢ ÎÎÎĪ/ÎĢÎÎĢ 2013ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
EÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÏÏÎ·Î― ÎđÎŋÎ―ÏÎđΚÎŪ ÎđÏÎŋÏÏÎŋÏÎŊÎą



EÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÏÏÎ·Î― ÎđÎŋÎ―ÏÎđΚÎŪ ÎđÏÎŋÏÏÎŋÏÎŊÎąÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÎšÎĩÏ.4 ÎÎÎŧÏ
Κ 2015-16



ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎąÏΚÎŪÏÎĩÎđÏ ÎšÎĩÏ.4 ÎÎÎŧÏ
Κ 2015-16ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎÏΚÎŪÏÎĩÎđÏ Î§Î·ÎžÎĩÎŊÎąÏ Î' ÎÏ
ΚÎĩÎŊÎŋÏ




ÎÏÎąÎ―ÎąÎŧηÏÏÎđΚÎÏ ÎÏΚÎŪÏÎĩÎđÏ Î§Î·ÎžÎĩÎŊÎąÏ Î' ÎÏ
ΚÎĩÎŊÎŋÏ
ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÏÏÏÎŪÏÎĩÎđÏ ÏÎŋÎŧÎŧÎąÏÎŧÎŪÏ ÎĩÏÎđÎŧÎŋÎģÎŪÏ Î§Î·ÎžÎĩÎŊÎąÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ




ÎÏÏÏÎŪÏÎĩÎđÏ ÏÎŋÎŧÎŧÎąÏÎŧÎŪÏ ÎĩÏÎđÎŧÎŋÎģÎŪÏ Î§Î·ÎžÎĩÎŊÎąÏ ÎÎ ÎÏ
ΚÎĩÎŊÎŋÏ
ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎĢÎÎÎĢÎÎÎĢ ÎĢÎĪÎ ÎÎÎÎ (4Îŋ ÎÎÎĶÎÎÎÎÎ ÎÎ ÎÎĨÎÎÎÎÎĨ)



ÎÎĢÎÎÎĢÎÎÎĢ ÎĢÎĪÎ ÎÎÎÎ (4Îŋ ÎÎÎĶÎÎÎÎÎ ÎÎ ÎÎĨÎÎÎÎÎĨ)ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎĢÎÎÎĢÎÎÎĢ ÎĢÎĪÎÎĢ ÎÎÎÎÎÎÎÎĢ (3Îŋ ÎÎÎĶÎÎÎÎÎ ÎÎ ÎÎĨÎÎÎÎÎĨ)



ÎÎĢÎÎÎĢÎÎÎĢ ÎĢÎĪÎÎĢ ÎÎÎÎÎÎÎÎĢ (3Îŋ ÎÎÎĶÎÎÎÎÎ ÎÎ ÎÎĨÎÎÎÎÎĨ)ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎĢÎÎÎĢÎÎÎĢ 2ÎŋÏ
ÎÎÎĶÎÎÎÎÎÎĨ ΧÎÎÎÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨ ÎÎ Î ÎĪÎĄÎÎ ÎÎÎ ÎÎÎÎÎĪÎĐÎ



ÎÎĢÎÎÎĢÎÎÎĢ 2ÎŋÏ
ÎÎÎĶÎÎÎÎÎÎĨ ΧÎÎÎÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨ ÎÎ Î ÎĪÎĄÎÎ ÎÎÎ ÎÎÎÎÎĪÎĐÎÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎĢÎÎÎĢÎÎÎĢ ÎÎÎÎÎÎĪÎÎÎÎÎÎÎĢ-ÎÎĢÎÎÎÎĄÎÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨ



ÎÎĢÎÎÎĢÎÎÎĢ ÎÎÎÎÎÎĪÎÎÎÎÎÎÎĢ-ÎÎĢÎÎÎÎĄÎÎÎÎĢ ÎÎ ÎÎĨÎÎÎÎÎĨÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎÎÎÎĪΠΧÎÎÎÎÎÎĢ-ÎÎÎΧÎÎÎÎÎÎĢ ÎĪÎΧÎÎÎÎÎÎÎÎÎĢ ÎÎÎĪ/ÎĢÎÎĢ 2013



ÎÎÎÎÎĪΠΧÎÎÎÎÎÎĢ-ÎÎÎΧÎÎÎÎÎÎĢ ÎĪÎΧÎÎÎÎÎÎÎÎÎĢ ÎÎÎĪ/ÎĢÎÎĢ 2013ÎÎąÏÎŊÎŧÎ·Ï ÎÎąÎ―ÏÎŽÏ
Ėý
ÎÎŧÎĩΚÏÏÎŋÎ―ÎđιΚÎŪ ÎīÎŋΞÎŪ ÏÏÎ― ÎąÏÏΞÏÎ―
- 1. ÎÎ―Îą ÎąÏÎŧÏ ÂĩÎŋÎ―ÏÎÎŧÎŋ ÎģÎđÎą ÏÎŋ ÎŽÏÎŋÂĩÎŋ ÎÎŊÎą ÏÎŋÎŧÏ ÎąÏÎŧÎŪ ÎĩÎđΚÏÎ―Îą ÏÏÎĩÏÎđΚΎ ÂĩÎĩ ÏÎŋ ÎŽÏÎŋÂĩÎŋ, ÎūÎĩÏÎĩÏÎąÏÂĩÎÎ―Î· ÎēÎÎēÎąÎđÎą ÏÎŪÂĩÎĩÏÎą, ÂĩÎąÏ ÎÏÎĩÎđ ÎīÏÏÎĩÎđ Îŋ Bohr. ÎĪÎŋ ÎąÏÎŋÂĩÎđÎšÏ ÏÏÏÏÏ ÏÎŋ ÏÎŋÏ Bohr ÎąÏÎŋÏÎĩÎŧÎĩÎŊ ÂĩÎŊÎą ÂĩÎđÎ―ÎđÎąÏÎŋÏÏÎą ÏÎŧÎąÎ―Î·ÏÎđΚÎŋÏ ÏÏ ÏÏÎŪÂĩÎąÏÎŋÏ. To ÎŽÏÎŋÂĩÎŋ ÎąÏÎŋÏÎĩÎŧÎĩÎŊÏÎąÎđ ÎąÏÏ ÏÎŋÎ― ÏÏ ÏÎŪÎ―Îą, ÏÎŋÏ ÏÎĩÏÎđÎÏÎĩÎđ ÏÎą ÎļÎĩÏÎđΚΎ ÏÎŋÏÏÎđÏÂĩÎÎ―Îą ÏÏÏÏÏÎ―ÎđÎą ΚιÎđ ÏÎą ÎŋÏ ÎīÎÏÎĩÏÎą Î―ÎĩÏÏÏÎ―ÎđÎą. ÎĢÏÎŋÎ― ÏÏ ÏÎŪÎ―Îą ÎĩÎŊÎ―ÎąÎđ ÏÏιΚÏÎđΚΎ ÏÏ ÎģΚÎĩÎ―ÏÏÏÂĩÎÎ―Î· η ÂĩÎŽÎķÎą ÏÎŋÏ ÎąÏÏÂĩÎŋÏ . ÎÏÏÏ ÎąÏÏ ÏÎŋÎ― ÏÏ ÏÎŪÎ―Îą ΚιÎđ ÏÎĩ ÎąÏΚÎĩÏÎŽ ÂĩÎĩÎģÎŽÎŧÎĩÏ ÎąÏÎŋÏÏÎŽÏÎĩÎđÏ ÎšÎđÎ―ÎŋÏÎ―ÏÎąÎđ ÏÎĩ ΚιÎļÎŋÏÎđÏÂĩÎÎ―ÎĩÏ (ÎĩÏÎđÏÏÎĩÏÏÎÏ) ÏÏÎŋÏÎđÎÏ ÏÎą ηÎŧÎĩΚÏÏÏÎ―ÎđÎą. ÎĪÎą ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ÏÎŋÏ ÎšÎđÎ―ÎŋÏÎ―ÏÎąÎđ ÏÏÎ·Î― ÎŊÎīÎđÎą ÏÎĩÏÎŊÏÎŋÏ ÎąÏÏÏÏÎąÏη ÎąÏÏ ÏÎŋÎ― ÏÏ ÏÎŪÎ―Îą ÎŧÎÂĩÎĩ ÏÏÎđ ÎēÏÎŊÏΚÎŋÎ―ÏÎąÎđ ÏÏÎ·Î― ÎŊÎīÎđÎą ÏÏÎđÎēÎŽÎīÎą ÎŪ ÏÎŧÎŋÎđÏ ÎŪ ÎĩÎ―ÎĩÏÎģÎĩÎđιΚÎŪ ÏÏÎŽÎļÂĩη. ÎÏÎąÎ― ÏÎą ÎŽÏÎŋÂĩÎą ÎīÎĩÎ― ÎĩÎŊÎ―ÎąÎđ ÏÎĩ ÎīÎđÎÎģÎĩÏÏη, ÏÎą ηÎŧÎĩΚÏÏÏÎ―ÎđÎŽ ÏÎŋÏ Ï ÎšÎąÏÎąÎ―ÎÂĩÎŋÎ―ÏÎąÎđ ÏÎĩ ÎĩÏÏÎŽ ÏÎŋ ÏÎŋÎŧÏ ÏÏÎđÎēÎŽÎīÎĩÏ, ÏÎđÏ K, L, Î, N, O, P, ΚιÎđ Q ÎÎŽÎļÎĩ ÏÏÎđÎēÎŽÎīÎą ÏÎąÏιΚÏηÏÎŊÎķÎĩÏÎąÎđ ÎąÏÏ ÎÎ―ÎąÎ― ÎąÏÎđÎļÂĩÏ ÏÎŋÏ ÏÏ ÂĩÎēÎŋÎŧÎŊÎķÎĩÏÎąÎđ ÂĩÎĩ n ΚιÎđ ÎŋÎ―ÎŋÂĩÎŽÎķÎĩÏÎąÎđ ΚÏÏÎđÎŋÏ ÎšÎēÎąÎ―ÏÎđΚÏÏ ÎąÏÎđÎļÂĩÏÏ. ÎÎđÎą n = 1 ÎÏÎŋÏ ÂĩÎĩ ÏÎ·Î― ÏÎŧηÏÎđÎÏÏÎĩÏη ÏÏÎŋÏ ÏÎŋÎ― ÏÏ ÏÎŪÎ―Îą ÏÏÎđÎēÎŽÎīÎą, ÏÎ·Î― K, ÎģÎđÎą n = 2 ÎÏÎŋÏ ÂĩÎĩ Ïη ÏÏÎđÎēÎŽÎīÎą L, ΚÎŧÏ. ÎÏÎŋ ÎąÏÎŋÂĩιΚÏÏ Î―ÏÂĩÎąÏÏÎĩ ÎąÏÏ ÏÎŋÎ― ÏÏ ÏÎŪÎ―Îą, ÏÏÏÎŋ ÎąÏ ÎūÎŽÎ―ÎĩÏÎąÎđ η ÎĩÎ―ÎĩÏÎģÎĩÎđιΚÎŪ ÏÏÎŽÎļÂĩη ÏÎ·Ï ÏÏÎđÎēÎŽÎīÎąÏ. âηÎŧÎąÎīÎŪ, ÎK < ÎL < ÎÎ < ... ÎÎąÏÎąÎ―ÎŋÂĩÎŪ ηÎŧÎĩΚÏÏÎŋÎ―ÎŊÏÎ― ÏÎĩ ÏÏÎđÎēÎŽÎīÎĩÏ ÎÎđÎą Ïη ÎīÎđÎŽÏÎąÎūη ÏÏÎ― ηÎŧÎĩΚÏÏÎŋÎ―ÎŊÏÎ― ÏÎĩ ÏÏÎđÎēÎŽÎīÎĩÏ (ηÎŧÎĩΚÏÏÎŋÎ―ÎđιΚÎŪ ÎīÎŋÂĩÎŪ) ιΚÎŋÎŧÎŋÏ ÎļÎŋÏÂĩÎĩ ÏÎŋÏ Ï ÎĩÎūÎŪÏ ÎšÎąÎ―ÏÎ―ÎĩÏ : 1. O ÂĩÎÎģÎđÏÏÎŋÏ ÎąÏÎđÎļÂĩÏÏ Î·ÎŧÎĩΚÏÏÎŋÎ―ÎŊÏÎ― ÏÎŋÏ ÂĩÏÎŋÏÎĩÎŊ Î―Îą ÏÎŽÏÎĩÎđ ΚΎÎļÎĩ ÂĩÎŊÎą ÎąÏÏ ÏÎđÏ ÏÎÏÏÎĩÏÎđÏ ÏÏÏÏÎĩÏ ÏÏÎđÎēÎŽÎīÎĩÏ ÎīÎŊÎ―ÎĩÏÎąÎđ ÎąÏÏ ÏÎŋÎ― ÏÏÏÎŋ 2n2, ÏÏÎŋÏ n Îŋ ΚÏÏÎđÎŋÏ ÎšÎēÎąÎ―ÏÎđΚÏÏ ÎąÏÎđÎļÂĩÏÏ, ÎīηÎŧÎąÎīÎŪ Îŋ ÎąÏÎđÎļÂĩÏÏ ÏÎ·Ï ÏÏÎđÎēÎŽÎīÎąÏ. ÎÏÏÎđ η K ÂĩÏÎŋÏÎĩÎŊ Î―Îą ÏÎŽÏÎĩÎđ ÎÏÏ 2 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą, η L ÎÏÏ 8 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą, η M ÎÏÏ 18 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ΚιÎđ η N ÎÏÏ 32 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą. 2. H ÏÎĩÎŧÎĩÏ ÏÎąÎŊÎą ÏÏÎđÎēÎŽÎīÎą ÎŋÏÎŋÎđÎŋÏ ÎīÎŪÏÎŋÏÎĩ ÎąÏÏÂĩÎŋÏ ÎīÎĩÎ― ÂĩÏÎŋÏÎĩÎŊ Î―Îą ÎÏÎĩÎđ ÏÎĩÏÎđÏÏÏÏÎĩÏÎą ÎąÏÏ 8 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą. ÎΚÏÏÏ ÎąÎ― ÎĩÎŊÎ―ÎąÎđ η K ÏÎŋÏ ÏÏ ÂĩÏÎŧηÏÏÎ―ÎĩÏÎąÎđ ÂĩÎĩ 2 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą. 3. H ÏÏÎŋÏÎĩÎŧÎĩÏ ÏÎąÎŊÎą ÏÏÎđÎēÎŽÎīÎą ÎīÎĩÎ― ÂĩÏÎŋÏÎĩÎŊ Î―Îą ÏÎĩÏÎđÎÏÎĩÎđ ÏÎĩÏÎđÏÏÏÏÎĩÏÎą ÎąÏÏ 18 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą, ÎąÎŧÎŧÎŽ ÎŋÏÏÎĩ ΚιÎđ ÎŧÎđÎģÏÏÎĩÏÎą ÎąÏÏ 8. ÎΚÏÏÏ ÎąÎ― ÎĩÎŊÎ―ÎąÎđ η K ÏÎŋÏ ÎÏÎĩÎđ ÏÎŋ ÏÎŋÎŧÏ 2. Î ÎąÏÎŽÎīÎĩÎđÎģÂĩÎą ÎÎą ΚιÏÎąÎ―ÎĩÂĩηÎļÎŋÏÎ― ÏÎą 19 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ÏÎŋÏ ÎąÏÏÂĩÎŋÏ ÏÎŋÏ ÎšÎąÎŧÎŊÎŋÏ (K) ÏÎĩ ÏÏÎđÎēÎŽÎīÎĩÏ. ÎÎĨÎĢÎ Î ÏÏÏÎą ÏÏ ÂĩÏÎŧηÏÏÎ―ÎĩÏÎąÎđ η ÏÏÎđÎēÎŽÎīÎą K ÂĩÎĩ 2 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą ΚιÎđ ÏÏη ÏÏ Î―ÎÏÎĩÎđÎą η ÏÏÎđÎēÎŽÎīÎą L ÂĩÎĩ 8 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą. ÎÏÎŋÂĩÎÎ―ÎŋÏ Î― 9 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą. H ΚιÏÎąÎ―ÎŋÂĩÎŪ ÏÂĩÏÏ 2,8,9 ÎīÎĩÎ― Ï ÏιΚÎŋÏÎĩÎđ ÏÏÎŋÎ― ÎšÎąÎ―ÏÎ―Îą "η ÎĩÎūÏÏÎĩÏÎđΚÎŪ ÏÏÎđÎēÎŽÎīÎą ÎīÎĩ ÂĩÏÎŋÏÎĩÎŊ Î―Îą ÎÏÎĩÎđ ÏÎĩÏÎđÏÏÏÏÎĩÏÎą ÎąÏÏ 8 ηÎŧÎĩΚÏÏÏÎ―ÎđÎą". ÎÏÏÎđ, η ηÎŧÎĩΚÏÏÎŋÎ―ÎđιΚÎŪ ÎīÎŋÂĩÎŪ ÏÎŋÏ ÎšÎąÎŧÎŊÎŋÏ ÎģÎŊÎ―ÎĩÏÎąÎđ (2,8,8,1). ÎÎ ÎÎÎÎÎÎÎ : ÎÎÎĢÎÎÎÎĢ ÎÎÎÎĪÎÎĢ ΧηÂĩÎđΚÏÏ