thermo file
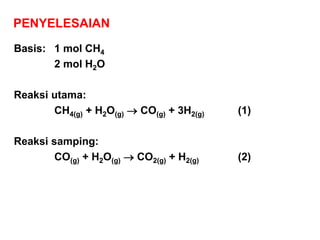
- 4. PENYELESAIAN Basis: 1 mol CH4 2 mol H2O Reaksi utama: CH4(g) + H2O(g) ’é« CO(g) + 3H2(g) (1) Reaksi samping: CO(g) + H2O(g) ’é« CO2(g) + H2(g) (2)
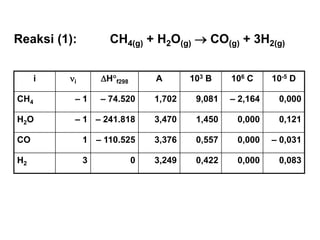
- 5. i ’ü«i ’üäH’é░f298 A 103 B 106 C 10-5 D CH4 ŌĆō 1 ŌĆō 74.520 1,702 9,081 ŌĆō 2,164 0,000 H2O ŌĆō 1 ŌĆō 241.818 3,470 1,450 0,000 0,121 CO 1 ŌĆō 110.525 3,376 0,557 0,000 ŌĆō 0,031 H2 3 0 3,249 0,422 0,000 0,083 Reaksi (1): CH4(g) + H2O(g) ’é« CO(g) + 3H2(g)
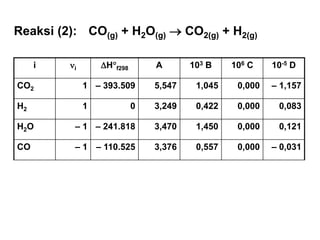
- 6. i ’ü«i ’üäH’é░f298 A 103 B 106 C 10-5 D CO2 1 ŌĆō 393.509 5,547 1,045 0,000 ŌĆō 1,157 H2 1 0 3,249 0,422 0,000 0,083 H2O ŌĆō 1 ŌĆō 241.818 3,470 1,450 0,000 0,121 CO ŌĆō 1 ŌĆō 110.525 3,376 0,557 0,000 ŌĆō 0,031 Reaksi (2): CO(g) + H2O(g) ’é« CO2(g) + H2(g)
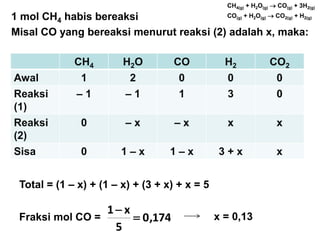
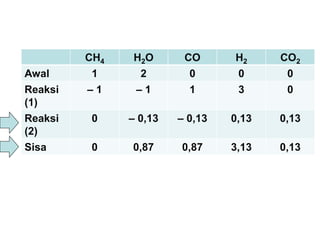
- 7. CH4 H2O CO H2 CO2 Awal 1 2 0 0 0 Reaksi (1) ŌĆō 1 ŌĆō 1 1 3 0 Reaksi (2) 0 ŌĆō x ŌĆō x x x Sisa 0 1 ŌĆō x 1 ŌĆō x 3 + x x Total = (1 ŌĆō x) + (1 ŌĆō x) + (3 + x) + x = 5 Fraksi mol CO = 174,0 5 x1 ’ĆĮ ’ĆŁ x = 0,13 1 mol CH4 habis bereaksi Misal CO yang bereaksi menurut reaksi (2) adalah x, maka: CH4(g) + H2O(g) ’é« CO(g) + 3H2(g) CO(g) + H2O(g) ’é« CO2(g) + H2(g)
- 8. CH4 H2O CO H2 CO2 Awal 1 2 0 0 0 Reaksi (1) ŌĆō 1 ŌĆō 1 1 3 0 Reaksi (2) 0 ŌĆō 0,13 ŌĆō 0,13 0,13 0,13 Sisa 0 0,87 0,87 3,13 0,13
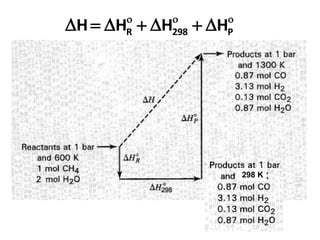
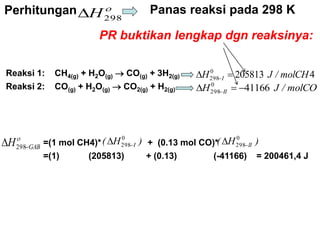
- 10. 42058130 298 molCH/JH I ’ĆĮ’üä ’ĆŁ Panas reaksi pada 298 K Reaksi 1: CH4(g) + H2O(g) ’é« CO(g) + 3H2(g) Reaksi 2: CO(g) + H2O(g) ’é« CO2(g) + H2(g) molCO/JH II 411660 298 ’ĆŁ’ĆĮ’üä ’ĆŁ ’ü» 298H’üä ’ü» GABH ’ĆŁ’üä 298 =(1 mol CH4)* + (0.13 mol CO)* =(1) (205813) + (0.13) (-41166) = 200461,4 J )H( I 0 298’ĆŁ’üä )H( II 0 298’ĆŁ’üä Perhitungan PR buktikan lengkap dgn reaksinya:
- 11. Panas sensibel reaktan (600 K ’é« 298 K) ’ā▓’āź’āź ’ā▓ ’āĘ ’āĘ ’āĖ ’āČ ’ā¦ ’ā¦ ’ā© ’ā” ’ĆĮ’ĆĮ’üä ’ü»’ü» ’ü» 0 i 0 i T T i Pi i T T P iR dT R Cn RdT R C RnH ’Ć© ’Ć® ’Ć© ’Ć® ’ā¬ ’ā¬ ’ā¬ ’ā½ ’ā® ’Ć½’ĆŁ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’Ć½’ĆŁ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā”’ĆĮ ’āź ’āź 22 0 i ii 0 i ii TT 2 Bn TTAnR ’Ć© ’Ć® ’ā║ ’ā║ ’ā║ ’ā╗ ’ā╣ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’ĆŁ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā”’ĆŁ’ĆŁ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’Ć½’ĆĮ ’āź ’āź T 1 T 1 DnTT 3 Cn 0i ii 33 0 i ii
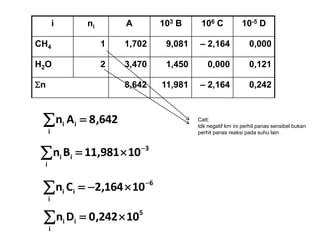
- 12. i ni A 103 B 106 C 10-5 D CH4 1 1,702 9,081 ŌĆō 2,164 0,000 H2O 2 3,470 1,450 0,000 0,121 ’üōn 8,642 11,981 ŌĆō 2,164 0,242 642,8An i ii ’ĆĮ’āź 3 i ii 10981,11Bn ’ĆŁ ’é┤’ĆĮ’āź 6 i ii 10164,2Cn ’ĆŁ ’é┤’ĆŁ’ĆĮ’āź 5 i ii 10242,0Dn ’é┤’ĆĮ’āź Catt: tdk negatif krn ini perhit panas sensibel bukan perhit panas reaksi pada suhu lain
- 13. ’Ć© ’Ć®’Ć© ’Ć®’üø ’Ć½’ĆŁ’ĆĮ’üä ’ü» 600298642,8314,8HR ’Ć© ’Ć®’Ć© ’Ć®223 60029810981,11 ’ĆŁ’é┤’Ć½ ’ĆŁ Jika dimasukkan ke persamaan untuk ’üäHR’é░ (reaktan): = -34390 J ’Ć© ’Ć®’Ć© ’Ć®336 60029810164,2 ’ĆŁ’é┤’ĆŁ’Ć½ ’ĆŁ ’Ć© ’Ć® ’ā║’ā╗ ’ā╣ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’ĆŁ’é┤’Ć½ 600 1 298 1 10242,0 5
- 14. Panas sensibel produk (298K ’é« 1300K) ’ā▓’āź’āź ’ā▓ ’āĘ ’āĘ ’āĖ ’āČ ’ā¦ ’ā¦ ’ā© ’ā” ’ĆĮ’ĆĮ’üä ’ü»’ü» ’ü» T T i Pi i T T P iP 0 i 0 i dT R Cn RdT R C RnH ’Ć© ’Ć® ’Ć© ’Ć® ’ā¬ ’ā¬ ’ā¬ ’ā½ ’ā® ’Ć½’ĆŁ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’Ć½’ĆŁ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā”’ĆĮ ’āź ’āź 2 0 2i ii 0 i ii TT 2 Bn TTAnR ’Ć© ’Ć® ’ā║ ’ā║ ’ā║ ’ā╗ ’ā╣ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’ĆŁ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā”’ĆŁ’ĆŁ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’Ć½’ĆĮ ’āź ’āź 0i ii 3 0 3i ii T 1 T 1 DnTT 3 Cn
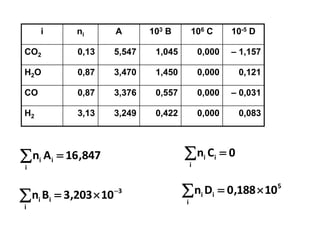
- 15. i ni A 103 B 106 C 10-5 D CO2 0,13 5,547 1,045 0,000 ŌĆō 1,157 H2O 0,87 3,470 1,450 0,000 0,121 CO 0,87 3,376 0,557 0,000 ŌĆō 0,031 H2 3,13 3,249 0,422 0,000 0,083 847,16An i ii ’ĆĮ’āź 3 i ii 10203,3Bn ’ĆŁ ’é┤’ĆĮ’āź 0Cn i ii ’ĆĮ’āź 5 i ii 10188,0Dn ’é┤’ĆĮ’āź
- 16. ’Ć© ’Ć®’Ć© ’Ć®’üø ’Ć½’ĆŁ’ĆĮ’üä ’ü» 2981300847,16314,8HP ’Ć© ’Ć®’Ć© ’Ć®223 298130010203,3 ’ĆŁ’é┤’Ć½ ’ĆŁ Jika dimasukkan ke persamaan untuk ’üäHP’é░ (produk): = 162940 J ’Ć© ’Ć® ’ā║’ā╗ ’ā╣ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’ĆŁ’é┤’Ć½ 298 1 1300 1 10188,0 5 ’ü»’ü»’ü» ’üä’Ć½’üä’Ć½’üä’ĆĮ’üä P298R HHHH = -34390J+ 200461J + 162940 J = 329011J = 329,01kJ Krn Ws=0, Ek+Ep diabaikan mk Q= =329,01kJH’üä
- 17. CONTOH SOAL 4.9 Sebuah boiler menggunakan bahan bakar minyak kualitas tinggi (hanya berisi hidrokarbon) yang memiliki panas pembakaran standar ŌĆō 43.515 J g-1 pada 25’é░C dengan CO2(g) dan H2O(l) sebagai produk. Bahan bakar minyak masuk ke ruang pembakaran pada 25’é░C. Udara dianggap kering. Gas hasil pembakaran keluar dari boiler pada 300’é░C, dan analisis komposisi rata-ratanya adalah (basis kering) 11,2% CO2, 0,4% CO, 6,2% O2 dan 82,2% N2. Berapa bagian dari panas pembakaran yang ditransfer sebagai panas ke boiler?
- 18. CONTOH SOAL 4.9 Sebuah boiler menggunakan bahan bakar minyak kualitas tinggi (hanya berisi hidrokarbon) yang memiliki panas pembakaran standar ŌĆō 43.515 J g-1 pada 25’é░C dengan CO2(g) dan H2O(l) sebagai produk. Bahan bakar minyak masuk ke ruang pembakaran pada 25’é░C. Udara dianggap kering. Gas hasil pembakaran keluar dari boiler pada 300’é░C, dan analisis komposisi rata-ratanya adalah (basis kering) 11,2% CO2, 0,4% CO, 6,2% O2 dan 82,2% N2. Berapa bagian dari panas pembakaran yang ditransfer sebagai panas ke boiler? PENYELESAIAN Dari soal terlihat bhw panas pembakaran standar dalam J/g Sehingga perlu dicari massa bahan bakar. Krn data gas keluar cukup lengkap, maka dijadikan basis hitungan. Basis: 100 mol gas hasil pembakaran kering: CO2 11,2 mol CO 0,4 mol O2 6,2 mol N2 82,2 mol ------------------------ Total 100,0 mol
- 19. Bahan bakar hanya hidrocarbon (senyawa H & C saja) Menentukan mol H2 dalam bahan bakar: dapat dilihat dari perkiraan persamaan reaksi pembakaran sempurna berikut: ... CnHm + .... O2 ’é« .... CO2 + .... H2O Dari pers reaksi ini terlihat bhw mol H dlm bhn bakar harus sama dgn mol H dalam H2O yg terbentuk, krn satu- satunya sumber H dalam produk air adalah dari bahan bakar. Shg harus dicari mol H2O Mol H2O yg terbentuk dpt dihitung dari neraca massa oksigen
- 20. Neraca massa oksigen: Masuk sebagai O2 (dalam udara) = 79 21 2,82 ’é┤ = 21,85 mol Masuk: Keluar: Dalam CO2 CO2 C + O2 = 11,20 mol Dalam CO CO C + ┬Į O2 =┬Į 0,40 mol = 0,2 mol O2 dalam sisa = 6,20 mol ---------------------------------------------------------------------------------------------- Total Oksigen di luar H2O = 17,6 mol Jd oksigen yg bereaksi membentuk H2O = 21,85 ŌĆō 17.6 = 4.25 mol H2 + ┬Į O2 H2O H2O yang terbentuk = 2 x 4.25 mol = 8.5 mol mol H2 dlm air = 8.5 mol, shg jumlah mol H H2 H(+) + H(+) =2x8.5 = 17 mol Mol H pd bahan bakar juga = 17 mol
- 21. Menentukan mol C dlm bhn bakar dari NERACA massa C Keluar: Sebagai CO2 = 11,20 mol Sebagai CO = 0,40 mol --------------------------------------- Total = 11,60 mol Masuk: Mol C masuk = mol C keluar = 11,60 mol Karena mol H dan C telah diketahui maka: Rumus molekul bahan bakar = C11,6H17
- 22. C dan H semuanya berasal dari bahan bakar, sehingga total berat bahan bakar yang masuk adalah = (11,60) (12) + (17,0) (1) = 156,2 g Jika semua bahan bakar terbakar sempurna membentuk CO2(g) dan H2O(l) pada 25’é░C, maka panas pembakarannya adalah: Ini panas maksimal yg seharusnya... ’Ć© ’Ć®’Ć© ’Ć® J.g.gJ.H 0406797215651543298 ’ĆŁ’ĆĮ’ĆŁ’ĆĮ’üä ’ü» Reaksi pembakaran jika bahan bakar terbakar sempurna membentuk CO2(g) dan H2O(l) adalah: C11,6H17(l) + 15,85 O2(g) ’é« 11,6 CO2(g) + 8,5 H2O(l) ’üäH’é░298 = ŌĆō 43.515 J/g
- 23. Analisis hasil pembakaran menunjukkan bahwa pembakaran berlangsung tidak sempurna (karena terbentuknya CO) dan H2O berupa gas bukan cairan. Reaksi yang terjadi: C11,6H17(l) + 15,65 O2(g) ’é« 11,2 CO2(g) + 0,4 CO(g) + 8,5 H2O(g) Panas reaksi untuk reaksi tersebut dapat dihitung dengan menggunakan berbagai panas reaksi yang telah diketahui datanya. Catt: Reaksi sempurna: C11,6H17(l) + 15,85 O2(g) ’é« 11,6 CO2(g) + 8,5 H2O(l)
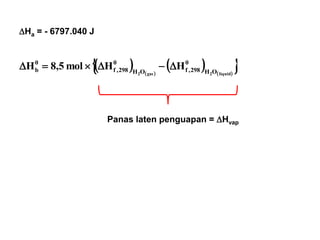
- 24. Reaksi di atas merupakan penjumlahan dari reaksi2 sbb.: C11,6H17(l) + 15,85 O2(g) ’é« 11,6 CO2(g) + 8,5 H2O(l) 8,5 H2O(l) ’é« 8,5 H2O(g) 0,4 CO2(g) ’é« 0,4 CO(g) + 0,2 O2(g) Panas reaksi standar total pada 25’é░C: ’Ć© ’Ć®’Ć© ’Ć® ’Ć© ’Ć®’Ć© ’Ć® J.,.,..H 74063094098428258012440406797298 ’ĆŁ’ĆĮ’Ć½’Ć½’ĆŁ’ĆĮ’üä ’ü» C11,6H17(l) + 15,65 O2(g) ’é« 11,2 CO2(g) + 0,4 CO(g) + 8,5 H2O(g) ’üäHa ’üäHb ’üäHc (a) (b) (c) ?
- 25. ’üäHa = - 6797.040 J ’Ć© ’Ć® ’Ć© ’Ć® ’Ć© ’Ć® ’Ć© ’Ć® ’ü╗ ’üĮliquid2gas2 OH 0 298,fOH 0 298,f 0 b HHmol5,8H ’üä’ĆŁ’üä’é┤’ĆĮ’üä Panas laten penguapan = ’üäHvap
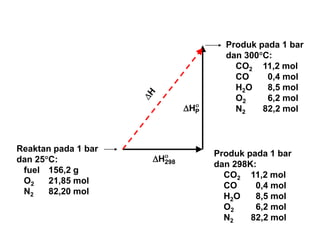
- 26. Reaktan pada 1 bar dan 25’é░C: fuel 156,2 g O2 21,85 mol N2 82,20 mol Produk pada 1 bar dan 300’é░C: CO2 11,2 mol CO 0,4 mol H2O 8,5 mol O2 6,2 mol N2 82,2 mol ’ü» ’üä PH ’ü» ’üä 298H Produk pada 1 bar dan 298K: CO2 11,2 mol CO 0,4 mol H2O 8,5 mol O2 6,2 mol N2 82,2 mol
- 27. ’ā▓ ’āź’āź ’ā▓ ’āĘ ’āĘ ’āĖ ’āČ ’ā¦ ’ā¦ ’ā© ’ā” ’ĆĮ’ĆĮ’üä ’ü»’ü» ’ü» T T i Pi i T T P iP 0 i 0 i dT R Cn RdT R C RnH ’Ć© ’Ć® ’Ć© ’Ć® ’Ć© ’Ć® ’ā║ ’ā║ ’ā║ ’ā║ ’ā╗ ’ā╣ ’ā¬ ’ā¬ ’ā¬ ’ā¬ ’ā½ ’ā® ’āĘ’āĘ ’āĖ ’āČ ’ā¦’ā¦ ’ā© ’ā” ’ĆŁ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’ĆŁ’ĆŁ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’Ć½’ĆŁ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’Ć½’ĆŁ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’ĆĮ ’āź ’āź’āź ’āź 0i ii 3 0 3i ii 2 0 2i ii 0 i ii T 1 T 1 DnTT 3 Cn TT 2 Bn TTAnR 142,384An i ii ’ĆĮ’āź 3 i ii 10134,76Bn ’ĆŁ ’é┤’ĆĮ’āź 0Cn i ii ’ĆĮ’āź 5 i ii 100617,10Dn ’é┤’ĆŁ’ĆĮ’āź ’Ć© ’Ć®’Ć© ’Ć®’üø ’Ć½’ĆŁ’ĆĮ’üä ’ü» 15,29815,573142,384314,8HP ’Ć© ’Ć®’Ć© ’Ć® ’Ć© ’Ć® ’ā║ ’ā╗ ’ā╣ ’āĘ ’āĖ ’āČ ’ā¦ ’ā© ’ā” ’ĆŁ’é┤’Ć½’ĆŁ’é┤’Ć½ ’ĆŁ 15298 1 15573 1 10645015298155731013476 5223 ,, ,,,, Jika dimasukkan ke persamaan untuk ’üäHP’é░: = 940.660 J
- 28. ’ü»’ü» ’üä’Ć½’üä’ĆĮ’üä P298 HHH = ŌĆō 6309.740 + 940.660 = ŌĆō 5369.080 J Proses pembakaran ini merupakan proses alir tunak dengan: ŌĆó WS = 0 ŌĆó ’üäEK = 0 ŌĆó ’üäEP = 0 Maka: ’üäH = Q Q = ŌĆō 5369.080 J merupakan panas yang ditransfer ke boiler Jadi fraksi panas pembakaran yang ditransfer ke boiler adalah: %,% . . 079100 0406797 0805369 ’ĆĮ’é┤’ĆĮ
- 29. PR SOAL 4.29 & 4.32 SMITH VAN NESS