–ª–µ–∫—Ü—ñ—è 12
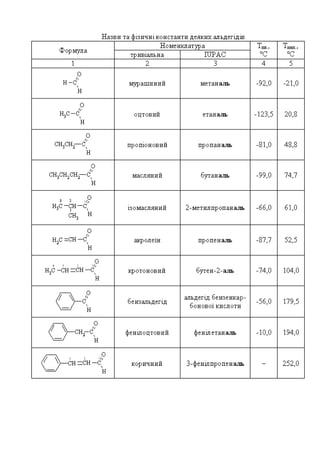
- 1. Лекція 12 Оксосполуки. Альдегіди та кетони План 1. Класифікація, номенклатура та ізомерія оксосполук. 2. Методи одержання альдегідів та кетонів. 3. Фізичні та хімічні властивості оксосполук. 4. β- Дикарбонільні сполуки. Кето-енольна таутомерія. 5. Окремі представники. Галузі застосування карбонільних сполук 1. Класифікація, номенклатура та ізомерія оксосполук Альдегіди та кетони – це такі органічні сполуки, які мають в своєму складі карбонільну групу (оксогрупу) C O. Альдегідами називають сполуки, в яких карбонільна група сполучена з вуглеводневим залишком і Гідрогеном, кетонами – якщо вона сполучена з двома вуглеводневими залишками: R C O H R C O R (R') Альдегід Кетон В залежності від характеру вуглеводневих залишків, що входять до складу альдегідів і кетонів, розрізняють насичені, ненасичені, карбоциклічні, ароматичні та змішаного типу оксосполуки: CH3 C O H CH3 C CH3 O C C O H CH2 CH3 C6 H5 C O H C6 H5 C C6 H5 O C6 H5 C CH3 O Ацетон Бензофенон Ацетофенон Оцтовий альдегід Метакриловий альдегід Бензеновий альдегід За кількістю карбонільних груп розрізняють моно- та полікарбонільні сполуки. Ізомерія альдегідів пов’язана з будовою карбонового ланцюга, положенням кратного зв’язку у ненасичених оксосполуках, а кетонів – додатково положенням карбонільної групи:
- 2. CH2 C O H CH2 CH3 CH2 C CH3 O CH2 CH3 CH C O H CH3 CH3 C CH2 CH3 CH2 CH3 O Бутаналь Метилпропаналь 3-Пентанон2-Пентанон 5 4 3 2 1 5 4 3 2 1 Номенклатура За історичною (тривіальною) номенклатурою альдегіди називають за назвами відповідних кислот, в які вони перетворюються при окисненні, з додаванням у кінці назви альдегід. За раціональною номенклатурою – як похідні оцтового альдегіду. Для назви кетонів за раціональною номенклатурою називають вуглеводневі залишки, що сполучені з карбонільною групою, та додають слово кетон. За систематичною номенклатурою в основі назви альдегідів і кетонів лежить назва вуглеводню з таким самим числом атомів Карбону, включаючи атом Карбону карбонільної групи, а також суфікс для альдегідів – -аль, а для кетонів – -он із зазначенням номера атома Карбону, безпосередньо сполученого з атомом Оксигену. Наприклад: CH2 C O H CH3 CH2 C CH3 O CH2 CH3 1) Пропіоновий альдегід, 2) Метилоцтовий альдегід, 3) Пропаналь 2) Метилпропілкетон, 3) 2-Пентанон 5 4 3 2 1
- 4. 2. Методи добування 1. Окиснення спиртів: первинні спирти дають альдегіди; вторинні – кетони: R CH2 OH R C O H R CH R' OH R C R' O [O] [O] Третинні спирти окиснюються з розривом карбонового ланцюга біля атома Карбону, сполученого з −ОН групою і утворюють суміш продуктів окиснення. 2. Дегідрування спиртів: R CH2 OH R C O H R CH R' OH R C R' O Cu Cu + H2 H2 + 300 - 400ºC 300 - 400ºC 3. Суха перегонка кальцієвих або барієвих солей карбонових кислот. Кислоти можуть бути однаковими або різними. Якщо одна з кислот мурашина, утворюються альдегіди, в решті випадків – кетони. CH3 CH2 C O O CH3 CH2 C O O Ca C O O CH3 C O O Ca H CH3 CH2 C CH2 CH3 O CH3 C O H Ctº + CaCO3 tºC + CaCO3 3-Пентанон Оцтовий альдегід 4. Оксосинтез (пряме карбонілювання) – це важливий промисловий метод добування альдегідів: CH3 CH2 CH CH2 CH3 CH2 CH2 CH2 C O H CH3 CH2 CH C O HCH3 + +СО Н2 Пентаналь 2-Метилбутаналь 5. Гідроліз гемінальних дигалогенопохідних:
- 5. CH3 CH2 CHCl2 CH3 CH2 C OH OH H CH3 CH2 C O H H2O - H2O- 2 HCl + 2 C CH3 CH3 Cl Cl - H2 O C CH3 CH3 OH OH CH3 C CH3 O H2O - 2 HCl + 2 6. Гідратація ацетиленових вуглеводнів (за реакцією Кучерова) (див. алкіни). 7. Ацилювання аренів та їх похідних за Фріделем-Крафтсом: C CH3 O CH3 C Cl O - HCl + (AlCl3) 8. Ацилювання аренів та їх похідних за реакцією Гаттермана-Коха (пряме введення карбонільної групи): C O H(AlCl3 б/в) СОHCl+ + 3. Фізичні та хімічні властивості альдегідів та кетонів Насичені альдегіди і кетони – це безбарвні рідини, крім метаналю, який за нормальних умов є газом. Починаючи з С16 – тверді, переважно розчинні у воді речовини. Альдегіди характеризуються більш різким запахом, ніж кетони. Оксосполуки киплять при значно нижчій температурі, ніж спирти з такою ж кількістю атомів Карбону, тому що для них наявність водневого зв’язку не характерна. Причому кетони киплять при вищий температурі, ніж альдегіди з однаковою кількістю атомів Карбону. Ароматичні альдегіди та кетони – прозорі рідини або кристалічні речовини, часто з запахом гіркого мигдалю (альдегіди) і квітів (кетони). Висока активність оксосполук обумовлена наявністю в їх молекулах карбонільної групи та особливостями її будови. В карбонільній групі зв’язок між атомами Карбону та Оксигену здійснюється двома парами електронів і складається з σ- і π-зв’язків. R C O H 
- 6. I. –Ý–µ–∞–∫—Ü—ñ—ó –ø—Ä–∏—î–¥–Ω–∞–Ω–Ω—è. 1. –í–∑–∞—î–º–æ–¥—ñ—è –∑ –∞–º–æ–Ω—ñ–∞–∫–æ–º: C O R R' C NH2 R R' OH H NH2 C NHR R' - H2 O ÔÄ≠Ôŧ ÔÄ´Ôŧ ÔÄ≠ÔŧÔÄ´Ôŧ –ê–ª—å–¥—ñ–º—ñ–Ω, –∫–µ—Ç—ñ–º—ñ–Ω + (H)(H) (H) 2. –í–∑–∞—î–º–æ–¥—ñ—è –∑—ñ —Å–ø–∏—Ä—Ç–∞–º–∏: C O R R' C OR"R R' OH H OR" C OR"R R' OR" H-OR" - H2O –ù–∞–ø—ñ–≤–∞—Ü–µ—Ç–∞–ª—å ÔÄ≠Ôŧ ÔÄ´Ôŧ + (H)(H) (H) 3. –í–∑–∞—î–º–æ–¥—ñ—è –∑ —Ü—ñ–∞–Ω–æ–≤–æ–¥–Ω–µ–º (–æ–∫—Å–∏–Ω—ñ—Ç—Ä–∏–ª—å–Ω–∏–π —Å–∏–Ω—Ç–µ–∑): C O R R' C CR R' OH NH C N C CR R' OH O OH H-OH+3 - NH3 –û–∫—Å–∏–Ω—ñ—Ç—Ä–∏–ª ÔÅ°-–ì—ñ–¥—Ä–æ–∫—Å–∏–∫–∏—Å–ª–æ—Ç–∞ ÔÄ≠Ôŧ ÔÄ´Ôŧ + (H)(H) (H) 4. –ü—Ä–∏—î–¥–Ω–∞–Ω–Ω—è –Ω–∞—Ç—Ä—ñ–π –≥—ñ–¥—Ä–æ—Å—É–ª—å—Ñ—ñ—Ç—É NaHSO3 ‚Äì —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –±–µ–∑–±–∞—Ä–≤–Ω–∏—Ö –æ—Å–∞–¥—ñ–≤ –±—ñ—Å—É–ª—å—Ñ—ñ—Ç–Ω–∏—Ö –ø–æ—Ö—ñ–¥–Ω–∏—Ö —î —è–∫—ñ—Å–Ω–æ—é —Ä–µ–∞–∫—Ü—ñ—î—é –Ω–∞ –æ–∫—Å–æ—Å–ø–æ–ª—É–∫–∏: C O R R' H SO3 Na C SO3 NaR R' OH ÔÄ≠Ôŧ ÔÄ´Ôŧ ÔÄ≠ÔŧÔÄ´Ôŧ + (H) (H) 5. –ü—Ä–∏—î–¥–Ω–∞–Ω–Ω—è –º–∞–≥–Ω—ñ–π–æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Å–ø–æ–ª—É–∫ (—Ä–µ–∞–∫—Ç–∏–≤—ñ–≤ –ì—Ä—ñ–Ω—å—è—Ä–∞): C O R R' C R"R R' O MgI R" MgI C R"R R' OH H-OH ÔÄ≠Ôŧ ÔÄ´Ôŧ ÔÄ´Ôŧ ÔÄ≠Ôŧ ÔÄ´Ôŧ (H) ÔÄ≠Ôŧ (H) (H) + Mg(OH)I C–ø–∏—Ä—Ç + (H)(H) (H) II. –Ý–µ–∞–∫—Ü—ñ—ó –æ–∫–∏—Å–Ω–µ–Ω–Ω—è —î —è–∫—ñ—Å–Ω–∏–º–∏ —Ä–µ–∞–∫—Ü—ñ—è–º–∏ –Ω–∞ –∞–ª—å–¥–µ–≥—ñ–¥–∏, –∞–±–æ –∂ —Ä–µ–∞–∫—Ü—ñ—è–º–∏, —â–æ –≤—ñ–¥—Ä—ñ–∑–Ω—è—é—Ç—å –∞–ª—å–¥–µ–≥—ñ–¥–∏ –≤—ñ–¥ –∫–µ—Ç–æ–Ω—ñ–≤. 1. –Ý–µ–∞–∫—Ü—ñ—è ¬´—Å—Ä—ñ–±–Ω–æ–≥–æ –¥–∑–µ—Ä–∫–∞–ª–∞¬ª: C O R H C O R OH [Ag(NH3 )2 ]OH Ôŧ Ôŧ _ + + t¬∫ + NH3 + H2O+ Ag
- 7. 2. –Ý–µ–∞–∫—Ü—ñ—è –∑ —Ñ–µ–ª—ñ–Ω–≥–æ–≤–æ—é —Ä—ñ–¥–∏–Ω–æ—é. –§–µ–ª—ñ–Ω–≥–æ–≤–∞ —Ä—ñ–¥–∏–Ω–∞ —Å–∫–ª–∞–¥–∞—î—Ç—å—Å—è –∑ –¥–≤–æ—Ö –∫–æ–º–ø–æ–Ω–µ–Ω—Ç—ñ–≤ (–§–µ–ª—ñ–Ω–≥ I —Ç–∞ –§–µ–ª—ñ–Ω–≥ II), —â–æ –∑–º—ñ—à—É—é—Ç—å—Å—è –±–µ–∑–ø–æ—Å–µ—Ä–µ–¥–Ω—å–æ –ø—ñ–¥ —á–∞—Å –¥–æ—Å–ª—ñ–¥—É –∑ –∞–ª—å–¥–µ–≥—ñ–¥–æ–º. –§–µ–ª—ñ–Ω–≥ I ‚Äì —Ü–µ –≤–æ–¥–Ω–∏–π —Ä–æ–∑—á–∏–Ω –°uSO4; –§–µ–ª—ñ–Ω–≥ II ‚Äì –ª—É–∂–Ω–∏–π —Ä–æ–∑—á–∏–Ω —Å–µ–≥–Ω–µ—Ç–æ–≤–æ—ó —Å–æ–ª—ñ (–Ω–∞—Ç—Ä—ñ–π-–∫–∞–ª—ñ–π —Ç–∞—Ä—Ç—Ä–∞—Ç). –ü—Ä–∏ –∑–º—ñ—à—É–≤–∞–Ω–Ω—ñ –§–µ–ª—ñ–Ω–≥—É I —ñ –§–µ–ª—ñ–Ω–≥—É II, –ø–æ-–ø–µ—Ä—à–µ, —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –≥—ñ–¥—Ä–æ–∫—Å–∏–¥ –ö—É–ø—Ä—É–º—É (–°u2+ ): + +CuSO4 2NaOH Cu(OH)2 Na2SO4 –¶–µ–π —Å–≤—ñ–∂–µ–æ—Å–∞–¥–∂–µ–Ω–∏–π Cu(–û–ù)2 —Ä–µ–∞–≥—É—î –∑ —Å–µ–≥–Ω–µ—Ç–æ–≤–æ—é —Å—ñ–ª–ª—é –ø–æ–¥—ñ–±–Ω–æ –¥–æ –±–∞–≥–∞—Ç–æ–∞—Ç–æ–º–Ω–æ–≥–æ —Å–ø–∏—Ä—Ç—É, –∞ —Å–∞–º–µ: H H CHOH CHOH COOK COONa OH Cu OH CH CH COOK COONa O O Cu CH CH COOK O O COONa - H2O +2 –¢–æ–±—Ç–æ –∞–Ω–∞–ª—ñ–∑–æ–≤–∞–Ω–∏–π —Ä–æ–∑—á–∏–Ω –Ω–∞–±—É–≤–∞—î —ñ–Ω—Ç–µ–Ω—Å–∏–≤–Ω–æ-—Å–∏–Ω—å–æ–≥–æ –∑–∞–±–∞—Ä–≤–ª–µ–Ω–Ω—è. –ü—Ä–∏ –ø–æ–¥–∞–ª—å—à–æ–º—É –Ω–∞–≥—Ä—ñ–≤–∞–Ω–Ω—ñ –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è –æ–∫–∏—Å–Ω–µ–Ω–Ω—è –∞–ª—å–¥–µ–≥—ñ–¥—É —É—Ç–≤–æ—Ä–µ–Ω–∏–º –∫–æ–º–ø–ª–µ–∫—Å–æ–º —ñ –≤—ñ–¥–Ω–æ–≤–ª–µ–Ω–Ω—è –ö—É–ø—Ä—É–º—É (–°u2+ ) –¥–æ –°u1+ , –∞ –ø—Ä–∏ –ø–µ–≤–Ω–æ–º—É —Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ —Ä–µ–∞–≥–µ–Ω—Ç—ñ–≤ —ñ –¥–æ –º–µ—Ç–∞–ª—ñ—á–Ω–æ—ó –º—ñ–¥—ñ —á–µ—Ä–µ–∑ —Ç–∞–∫—ñ —Å–ø–æ–ª—É–∫–∏: Cu(OH)2 CuOH Cu2O Cu H2O –ü—Ä–∏ —Ü—å–æ–º—É –∞–ª—å–¥–µ–≥—ñ–¥ –æ–∫–∏—Å–Ω—é—î—Ç—å—Å—è –¥–æ –∫–∏—Å–ª–æ—Ç–∏, –≤–∏–ø–∞–¥–∞—î —á–µ—Ä–≤–æ–Ω–∏–π –æ—Å–∞–¥ –°u2–û, —ñ–∑ –∑—Ä—É–π–Ω–æ–≤–∞–Ω–æ–≥–æ –∫–æ–º–ø–ª–µ–∫—Å—É –≤–∏–≤—ñ–ª—å–Ω—è—î—Ç—å—Å—è —Å–µ–≥–Ω–µ—Ç–æ–≤–∞ —Å—ñ–ª—å. 3. –Ý–µ–∞–∫—Ü—ñ—è –∑ —Ñ—É–∫—Å–∏–Ω—Å—É–ª—å—Ñ—ñ—Ç–Ω–æ—é –∫–∏—Å–ª–æ—Ç–æ—é ‚Äì —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –º–∞–ª–∏–Ω–æ–≤–æ- —á–µ—Ä–≤–æ–Ω–æ–≥–æ –∑–∞–±–∞—Ä–≤–ª–µ–Ω–Ω—è —É —Ä–∞–∑—ñ –ø—Ä–∏—Å—É—Ç–Ω–æ—Å—Ç—ñ –∞–ª—å–¥–µ–≥—ñ–¥—É. 4. –ö–µ—Ç–æ–Ω–∏ –æ–∫–∏—Å–Ω—é—é—Ç—å—Å—è –≤ –Ω–∞–±–∞–≥–∞—Ç–æ –∂–æ—Ä—Å—Ç–∫—ñ—à–∏—Ö —É–º–æ–≤–∞—Ö (—Ç—ñ–ª—å–∫–∏ —Å–∏–ª—å–Ω–∏–º–∏ –æ–∫–∏—Å–Ω—é–≤–∞—á–∞–º–∏ –ø—ñ–¥ —á–∞—Å –Ω–∞–≥—Ä—ñ–≤–∞–Ω–Ω—è). –ü—Ä–∏ —Ü—å–æ–º—É –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è —Ä–æ–∑—Ä–∏–≤ –∑–≤‚Äô—è–∑–∫—ñ–≤ –°‚àí–° –∑ –æ–±–æ—Ö –±–æ–∫—ñ–≤ –∫–∞—Ä–±–æ–Ω—ñ–ª—å–Ω–æ—ó –≥—Ä—É–ø–∏. –¢–∞–∫–∏–π —Ö—ñ–¥ —Ä–µ–∞–∫—Ü—ñ—ó –≤–∏–∑–Ω–∞—á–∞—î—Ç—å—Å—è –ø—Ä–∞–≤–∏–ª–æ–º –í–∞–≥–Ω–µ—Ä–∞-–ü–æ–ø–æ–≤–∞ (—É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è —Å—É–º—ñ—à –∫–∞—Ä–±–æ–Ω–æ–≤–∏—Ö –∫–∏—Å–ª–æ—Ç). C O R OHCH2 R C R' O C O CH2 OH R C OH R' O C OH R' O [O] + +1) 1) 2) 2)
- 8. III. –Ý–µ–∞–∫—Ü—ñ—ó –∑–∞–º—ñ—â–µ–Ω–Ω—è. 1. –ó–∞–º—ñ—â–µ–Ω–Ω—è –∫–∞—Ä–±–æ–Ω—ñ–ª—å–Ω–æ–≥–æ –û–∫—Å–∏–≥–µ–Ω—É –Ω–∞ 2 –∞—Ç–æ–º–∏ –≥–∞–ª–æ–≥–µ–Ω–∞. C O R R' CR R' Cl Cl PCl5 + - POCl3 (H)(H) 2. –í–∑–∞—î–º–æ–¥—ñ—è –∑ –≥—ñ–¥—Ä–æ–∫—Å–∏–ª–∞–º—ñ–Ω–æ–º (—è–∫—ñ—Å–Ω–∞ —Ä–µ–∞–∫—Ü—ñ—è –Ω–∞ –æ–∫—Å–æ–≥—Ä—É–ø—É): C O R R' C NR R' OH NH2 OH+ –û–∫—Å–∏–º -H2O (H)(H) 3. –í–∑–∞—î–º–æ–¥—ñ—è –∑ –≥—ñ–¥—Ä–∞–∑–∏–Ω–æ–º ‚Äì —â–µ –æ–¥–Ω–∞ —è–∫—ñ—Å–Ω–∞ —Ä–µ–∞–∫—Ü—ñ—è –Ω–∞ –æ–∫—Å–æ–≥—Ä—É–ø—É, –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ —è–∫–æ—ó —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –æ—Å–∞–¥ –≥—ñ–¥—Ä–∞–∑–æ–Ω—É: C O R R' C NR R' NH2 -H2O –ì—ñ–¥—Ä–∞–∑–æ–Ω (H)(H) NH2-NH2 4. –ù–∞–π–∫—Ä–∞—â–æ—é —è–∫—ñ—Å–Ω–æ—é —Ä–µ–∞–∫—Ü—ñ—î—é –Ω–∞ –æ–∫—Å–æ–≥—Ä—É–ø—É —î —Ä–µ–∞–∫—Ü—ñ—è —É—Ç–≤–æ—Ä–µ–Ω–Ω—è —Ñ–µ–Ω—ñ–ª–≥—ñ–¥—Ä–∞–∑–æ–Ω—ñ–≤ –ø—Ä–∏ –≤–∑–∞—î–º–æ–¥—ñ—ó –∑ —Ñ–µ–Ω—ñ–ª–≥—ñ–¥—Ä–∞–∑–∏–Ω–æ–º: C O R R' C NR R' NH C6 H5 NH2 NH C6 H5 -H2O –§–µ–Ω—ñ–ª–≥—ñ–¥—Ä–∞–∑–æ–Ω (H)(H) –§–µ–Ω—ñ–ª–≥—ñ–¥—Ä–∞–∑–æ–Ω–∏ —Ä—ñ–∑–Ω–∏—Ö –∞–ª—å–¥–µ–≥—ñ–¥—ñ–≤ —ñ –∫–µ—Ç–æ–Ω—ñ–≤ –º–∞—é—Ç—å —á—ñ—Ç–∫–æ –≤–∏–∑–Ω–∞—á–µ–Ω—ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –ø–ª–∞–≤–ª–µ–Ω–Ω—è. –¶—ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ –≤–∏–∑–Ω–∞—á–µ–Ω—ñ —Ç–∞ –Ω–∞–≤–µ–¥–µ–Ω—ñ –≤ –¥–æ–≤—ñ–¥–Ω–∏–∫–∞—Ö. –¢–æ–º—É –∑–∞ —Ç–æ—á–∫–æ—é –ø–ª–∞–≤–ª–µ–Ω–Ω—è –º–æ–∂–Ω–∞ –≤–∏–∑–Ω–∞—á–∏—Ç–∏ –∫–æ–Ω–∫—Ä–µ—Ç–Ω—É —Ñ–æ—Ä–º—É–ª—É –∞–ª—å–¥–µ–≥—ñ–¥—ñ–≤ —Ç–∞ –∫–µ—Ç–æ–Ω—ñ–≤. IV. –Ý–µ–∞–∫—Ü—ñ—ó –ø–æ–ª—ñ–º–µ—Ä–∏–∑–∞—Ü—ñ—ó —Ç–∞ –∫–æ–Ω–¥–µ–Ω—Å–∞—Ü—ñ—ó. –•–∞—Ä–∞–∫—Ç–µ—Ä–Ω—ñ –ª–∏—à–µ –¥–ª—è –∞–ª—å–¥–µ–≥—ñ–¥—ñ–≤, –≤ –ø–µ—Ä—à—É —á–µ—Ä–≥—É –¥–ª—è —Ñ–æ—Ä–º–∞–ª—å–¥–µ–≥—ñ–¥—É. –ü—Ä–∏ —Å—Ç—É–ø—ñ–Ω—á–∞—Ç—ñ–π –ø–æ–ª—ñ–º–µ—Ä–∏–∑–∞—Ü—ñ—ó –º—É—Ä–∞—à–∏–Ω–∏–π –∞–ª—å–¥–µ–≥—ñ–¥ —É—Ç–≤–æ—Ä—é—î –ø–æ–ª—ñ–º–µ—Ä–Ω—ñ –ª–∞–Ω—Ü—é–≥–∏ –∑ –∫—ñ–ª—å–∫–æ—Ö –∞—Ç–æ–º—ñ–≤ –ö–∞—Ä–±–æ–Ω—É –∑–∞ —Å—Ö–µ–º–æ—é: C O H H C O H H C O H C O H H C O H H C H OH + ... ...+ + –Ý–µ–∞–∫—Ü—ñ—ó –ø–æ–ª—ñ–∫–æ–Ω–¥–µ–Ω—Å–∞—Ü—ñ—ó –∑–∞—Å–Ω–æ–≤–∞–Ω—ñ –Ω–∞ –ø—ñ–¥–≤–∏—â–µ–Ω—ñ–π —Ä–µ–∞–∫—Ü—ñ–π–Ω—ñ–π –∑–¥–∞—Ç–Ω–æ—Å—Ç—ñ –∞—Ç–æ–º—ñ–≤ –ì—ñ–¥—Ä–æ–≥–µ–Ω—É –≤ Œ±-–ø–æ–ª–æ–∂–µ–Ω–Ω—ñ –≤—ñ–¥–Ω–æ—Å–Ω–æ –∫–∞—Ä–±–æ–Ω—ñ–ª—å–Ω–æ—ó –≥—Ä—É–ø–∏. –ó–¥–µ–±—ñ–ª—å—à–æ–≥–æ —Ç–∞–∫—ñ
- 9. реакції проходять у присутності основних або кислотних каталізаторів (альдольно-кротонова конденсація):. C O CH2 H CHOHCH3C O CH3 H C O CH3 H C O CH H CHCH3 - H2O C Альдоль оцтового альдегідуtº Кротоновий альдегід +  Ароматичні альдегіди та альдегіди жирного ряду, що не мають Гідрогену в α-положенні, вступають в реакцію диспропорціювання або реакцію Канніццаро: C O C HCH3 CH3 CH3 C O C OKCH3 CH3 CH3 CH2 OHC CH3 CH3 CH3 Ctº (КОН) + Для альдегідів, які містять атоми Гідрогену в α-положенні, можлива естерова конденсація Тищенка: C O R O CH2 R C O R H C O R H Al(OC2H5)3 Естер + Для переходу від оксосполук до алканів використовується реакція Кіжнера-Вольфа: CH2 R H C O R H C NR H NH2 - H2 O tºC (R')(R')(R') NH2-NH2 (KOH тв.) N2 Алкан + 4. Дикарбонільні сполуки. Кето-енольна таутомерія Сполуки, що містять в молекулі дві карбонільні групи С=О, називають дикарбонільними. До них відносять діальдегіди, дикетони, кетоальдегіди, альдегідо- та кетокислоти (та їх похідні). Такі сполуки крім властивостей, що притаманні звичайним карбонільним сполукам, виявляють специфічні властивості, які залежать від взаємного розташування груп С=О. -Дикарбонільні сполуки. Найпростіший представник -дикарбонільні сполук (1,2-дикарбонільних сполук) – гліоксаль CHO–CHO (этандіаль), жовто-зелена летка рідина, яка легко полімеризується. Одержують гліоксаль окисненням ацетальдегіду нітратною кислотою. В лужному розчині гліоксаль перетворюється на гліколеву HOCH2COOH.
- 10. Найпростішим -дикетоном є діацетил CH3COCOCH3 (бутан-2,3-діон), жовта летка рідина. що міститься в деяких ефірних оліях, наприклад. в ефірній олії кмину. Діоксим цієї сполуки (диметилгліоксим) застосовується в аналітичній хімії для якісного та кількісного визначення іонів Нікелю. Серед дикарбонільних сполук дуже важливими є β-дикарбонільні сполуки, зокрема ацетилацетон (пентан-2,4-діон) та ацетооцтовий естер (этиловий естер ацетооцтової кислоти, етилацетоацетат): CH3 C C O C H H O O C2 H5 CH3 C C O C H H O CH3 Ацетилацетон Ацетооцтовий естер β-Дикарбонільні сполуки є слабкими кислотами, оскільки атоми Гідрогену метиленової групи активовані сусідніми карбонільними групами. За рахунок цього β-дикарбонільні сполуки здатні існувати у сані рівноваги з ізомером - енольною формою. Такий вид ізомерії называют таутомерією, а ізомери, що знаходяться в стані рівноваги – таутомерами. CH3 C C O C H H O CH3 CH3 C C OH C H O CH3 Кето-форма Енольна форма В монокарбонильних сполуках (альдегидах, кетонах) рівновага практично полностью зміщена в бік кетонної форми. Наприклад, вміст енольної форми в ацетоні складає лише 0,0002%. Положення рівноваги залежить від розчинника та температури. В ацетооцтовому естері при кімнатній температурі концентрація енольної форми складає 7,5%, а в ацетилацетоні – близько 76%. Велика кількість реакцій карбонільних сполук in vivo проходять через утворення проміжних енольних форм. 5. Окремі представники. Галузі застосування Мурашиний альдегід (формальдегід) – прозорий газ з різким запахом, отруйний. 37 — 40 % водний розчин формальдегіду, який містить 6— 5 % метанолу (інгібітор полімеризації формальдегіду), застосовується під назвою «формалін» як дезінфікуючий засіб, консервант для анатомічних препаратів. У промисловості формалін застосовується у виробництві феноло- формальдегідних та інших смол, необхідних в електропромисловості та машинобудуванні. На основі формальдегіду у великій кількості отримують уротропін, який застосовується у виробництві пластичних мас, вибухівки, ліків. Оцтовий альдегід – рідина з різким запахом, виробляється у великих кількостях для одержання оцтової кислоти, етанолу, дивінілу, етилацетату, оцтового ангідриду тощо.
- 11. –ê—Ü–µ—Ç–æ–Ω ‚Äì –ø—Ä–æ–∑–æ—Ä–∞ —Ä—ñ–¥–∏–Ω–∞, –µ—Ñ–µ–∫—Ç–∏–≤–Ω–∏–π —Ä–æ–∑—á–∏–Ω–Ω–∏–∫ –¥–ª—è –±–∞–≥–∞—Ç—å–æ—Ö –æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Å–ø–æ–ª—É–∫. –®–∏—Ä–æ–∫–æ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è —É –≤–∏—Ä–æ–±–Ω–∏—Ü—Ç–≤—ñ –∞—Ü–µ—Ç–∞—Ç–Ω–æ–≥–æ —à–æ–≤–∫—É, –ø–æ—Ä–æ—Ö—É, —Ñ–æ—Ç–æ- —ñ –∫—ñ–Ω–æ–ø–ª—ñ–≤–∫–∏, –æ—Ä–≥–∞–Ω—ñ—á–Ω–æ–≥–æ —Å–∫–ª–∞ —Ç–æ—â–æ. —Å–ª—É–∂–∏—Ç—å –¥–ª—è —Å–∏–Ω—Ç–µ–∑—É –π–æ–¥–æ—Ñ–æ—Ä–º—É, —Ö–ª–æ—Ä–æ—Ñ–æ—Ä–º—É. –ê—Ü–µ—Ç–æ—Ñ–µ–Ω–æ–Ω —ñ–∑ –∑–∞–ø–∞—Ö–æ–º —á–µ—Ä–µ–º—Ö–∏ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è –¥–ª—è —Å—Ç–≤–æ—Ä–µ–Ω–Ω—è –ø–∞—Ä—Ñ—É–º–µ—Ä–Ω–∏—Ö –∫–æ–º–ø–æ–∑–∏—Ü—ñ–π, –∫–æ—Å–º–µ—Ç–∏—á–Ω–∏—Ö –≤—ñ–¥–¥—É—à–æ–∫, —É –≤–∏—Å–æ–∫–∏—Ö –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü—ñ—è—Ö –≤—ñ–¥–æ–º–∏–π —è–∫ —Å–Ω–æ–¥—ñ–π–Ω–∞ —Ä–µ—á–æ–≤–∏–Ω–∞. –ë–µ–Ω–∑–æ—Ñ–µ–Ω–æ–Ω ‚Äî —Ñ—ñ–∫—Å–∞—Ç–æ—Ä –∑–∞–ø–∞—Ö—ñ–≤, —ñ–Ω–≥—ñ–±—ñ—Ç–æ—Ä –ø–æ–ª—ñ–º–µ—Ä–∏–∑–∞—Ü—ñ—ó, —è–∫–∏–π –∑–∞—Å—Ç–æ—Å–æ–≤—É—î—Ç—å—Å—è –≤ —Å–∏–Ω—Ç–µ–∑—ñ –≥–µ—Ç–µ—Ä–æ—Ü–∏–∫–ª—ñ–≤: –∞–Ω—Ç–∏–±—ñ–æ—Ç–∏–∫—ñ–≤ –≥—Ä—É–ø –ª–µ–≤–æ–º—ñ—Ü–µ—Ç–∏–Ω—É —Ç–∞ —Å–∏–Ω—Ç–æ–º—ñ—Ü–∏–Ω—É. –ú–µ—Ç–∏–ª—ñ–∑–æ–±—É—Ç–∏–ª–∫–µ—Ç–æ–Ω —É –≤–∏—Å–æ–∫—ñ–π –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü—ñ—ó –º–∞—î –º—ñ—Å—Ü–µ–≤–æ–∞–Ω–µ—Å—Ç–µ–∑—É–≤–∞–ª—å–Ω—É –¥—ñ—é, —Ä–µ—á–æ–≤–∏–Ω–∞ –≤—ñ–¥–æ–º–∞ —è–∫ –µ–∫—Å—Ç—Ä–∞–≥–µ–Ω—Ç –º–∞—Å–µ–ª. –î–ª—è –≤–∏—Ä–æ–±–Ω–∏—Ü—Ç–≤–∞ –∞–¥–∏–ø—ñ–Ω–æ–≤–æ—ó –∫–∏—Å–ª–æ—Ç–∏, Œµ-–∫–∞–ø—Ä–æ–ª–∞–∫—Ç–∞–º—É —Å–ª—É–∂–∏—Ç—å —Ü–∏–∫–ª–æ–≥–µ–∫—Å–∞–Ω–æ–Ω. –ê—Ü–µ—Ç–∏–ª–∞—Ü–µ—Ç–æ–Ω ‚Äì –±–µ–∑–∫–æ–ª—ñ—Ä–Ω–∞ —Ä—ñ–¥–∏–Ω–∞, —â–æ –º–∞—î –∑–∞–ø–∞—Ö –∞—Ü–µ—Ç–æ–Ω—É —Ç–∞ –æ—Ü—Ç–æ–≤–æ—ó –∫–∏—Å–ª–æ—Ç–∏. –ó —ñ–æ–Ω–∞–º–∏ –º–µ—Ç–∞–ª—ñ–≤ —É—Ç–≤–æ—Ä—é—î –º—ñ—Ü–Ω—ñ –∫–æ–º–ø–ª–µ–∫—Å–Ω—ñ —Å–ø–æ–ª—É–∫–∏, —è–∫—ñ –∑–∞—Å—Ç–æ—Å–æ–≤—É—é—Ç—å –≤ –∞–Ω–∞–ª—ñ—Ç–∏—á–Ω—ñ–π —Ö—ñ–º—ñ—ó –¥–ª—è –≤–∏–∑–Ω–∞—á–µ–Ω–Ω—è —Ç–∞ —Ä–æ–∑–¥—ñ–ª–µ–Ω–Ω—è –¥–µ—è–∫–∏—Ö –º–µ—Ç–∞–ª—ñ–≤. –ó–∞—Å—Ç–æ—Å–æ–≤—É—î—Ç—å—Å—è –≤ –æ—Ä–≥–∞–Ω—ñ—á–Ω–æ–º—É —Å–∏–Ω—Ç–µ–∑—ñ –¥–ª—è –æ–¥–µ—Ä–∂–∞–Ω–Ω—è —Ä—ñ–∑–Ω–æ–º–∞–Ω—ñ—Ç–Ω–∏—Ö —Å–ø–æ–ª—É–∫, –∑–æ–∫—Ä–µ–º–∞ –≥–µ—Ç–µ—Ä–æ—Ü–∏–∫–ª—ñ—á–Ω–∏—Ö. –ê—Ü–µ—Ç–æ–æ—Ü—Ç–æ–≤–∏–π –µ—Å—Ç–µ—Ä ‚Äì –±–µ–∑–∫–æ–ª—ñ—Ä–Ω–∞ —Ä—ñ–¥–∏–Ω–∞, —è–∫–∏–π –ø—Ä–∏—Ç–∞–º–∞–Ω–Ω–∏–π —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω–∏–π –Ω–µ—Ä—ñ–∑–∫–∏–π –∑–∞–ø–∞—Ö. –Ý–æ–∑—á–∏–Ω—è—î—Ç—å—Å—è —É –≤–æ–¥—ñ, –ø–æ–≤–Ω—ñ—Å—Ç—é –∑–º—ñ—à—É—î—Ç—å—Å—è –∑ –µ—Ç–∞–Ω–æ–ª–æ–º —Ç–∞ –¥—ñ–µ—Ç–∏–ª–æ–≤–∏–º –µ—Ç–µ—Ä–æ–º. –ó–∞–≤–¥—è–∫–∏ —Å–≤–æ—ó–π —É–Ω—ñ–∫–∞–ª—å–Ω—ñ–π –±—É–¥–æ–≤—ñ (–Ω–∞—è–≤–Ω—ñ—Å—Ç—å –µ—Å—Ç–µ—Ä–Ω–æ—ó —Ç–∞ –∫–µ—Ç–æ –≥—Ä—É–ø) –∞—Ü–µ—Ç–æ–æ—Ü—Ç–æ–≤–∏–π –µ—Å—Ç–µ—Ä —à–∏—Ä–æ–∫–æ –∑–∞—Å—Ç–æ—Å–æ–≤—É—î—Ç—å—Å—è —É —Å–∏–Ω—Ç–µ–∑—ñ –≥–µ—Ç–µ—Ä–æ—Ü–∏–∫–ª—ñ—á–Ω–∏—Ö —Å–ø–æ–ª—É–∫ —Ä—ñ–∑–Ω–æ—ó –±—É–¥–æ–≤–∏. –í –ø—Ä–æ–º–∏—Å–ª–æ–≤–æ—Å—Ç—ñ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è –¥–ª—è –æ–¥–µ—Ä–∂–∞–Ω–Ω—è —Ä—è–¥—É —Ñ–∞—Ä–º–∞—Ü–µ–≤—Ç–∏—á–Ω–∏—Ö –ø—Ä–µ–ø–∞—Ä–∞—Ç—ñ–≤ (–∞–Ω–∞–ª—å–≥—ñ–Ω—É, –∞–∫—Ä–∏—Ö—ñ–Ω—É, –≤—ñ—Ç–∞–º—ñ–Ω—É –í1).


![2. –ú–µ—Ç–æ–¥–∏ –¥–æ–±—É–≤–∞–Ω–Ω—è
1. Окиснення спиртів: первинні спирти дають альдегіди; вторинні –
–∫–µ—Ç–æ–Ω–∏:
R CH2
OH R C
O
H
R CH R'
OH
R C R'
O
[O] [O]
–¢—Ä–µ—Ç–∏–Ω–Ω—ñ —Å–ø–∏—Ä—Ç–∏ –æ–∫–∏—Å–Ω—é—é—Ç—å—Å—è –∑ —Ä–æ–∑—Ä–∏–≤–æ–º –∫–∞—Ä–±–æ–Ω–æ–≤–æ–≥–æ –ª–∞–Ω—Ü—é–≥–∞ –±—ñ–ª—è
–∞—Ç–æ–º–∞ –ö–∞—Ä–±–æ–Ω—É, —Å–ø–æ–ª—É—á–µ–Ω–æ–≥–æ –∑ ‚àí–û–ù –≥—Ä—É–ø–æ—é —ñ —É—Ç–≤–æ—Ä—é—é—Ç—å —Å—É–º—ñ—à –ø—Ä–æ–¥—É–∫—Ç—ñ–≤
–æ–∫–∏—Å–Ω–µ–Ω–Ω—è.
2. –î–µ–≥—ñ–¥—Ä—É–≤–∞–Ω–Ω—è —Å–ø–∏—Ä—Ç—ñ–≤:
R CH2
OH R C
O
H
R CH R'
OH
R C R'
O
Cu
Cu
+
H2
H2
+
300 - 400ºC
300 - 400ºC
3. –°—É—Ö–∞ –ø–µ—Ä–µ–≥–æ–Ω–∫–∞ –∫–∞–ª—å—Ü—ñ—î–≤–∏—Ö –∞–±–æ –±–∞—Ä—ñ—î–≤–∏—Ö —Å–æ–ª–µ–π –∫–∞—Ä–±–æ–Ω–æ–≤–∏—Ö –∫–∏—Å–ª–æ—Ç.
–ö–∏—Å–ª–æ—Ç–∏ –º–æ–∂—É—Ç—å –±—É—Ç–∏ –æ–¥–Ω–∞–∫–æ–≤–∏–º–∏ –∞–±–æ —Ä—ñ–∑–Ω–∏–º–∏. –Ø–∫—â–æ –æ–¥–Ω–∞ –∑ –∫–∏—Å–ª–æ—Ç –º—É—Ä–∞—à–∏–Ω–∞,
утворюються альдегіди, в решті випадків – кетони.
CH3
CH2
C
O
O
CH3
CH2
C
O
O
Ca
C
O
O
CH3
C
O
O
Ca
H
CH3
CH2
C CH2
CH3
O
CH3
C
O
H
Ctº
+ CaCO3
tºC
+ CaCO3
3-–ü–µ–Ω—Ç–∞–Ω–æ–Ω
–û—Ü—Ç–æ–≤–∏–π –∞–ª—å–¥–µ–≥—ñ–¥
4. Оксосинтез (пряме карбонілювання) – це важливий промисловий
–º–µ—Ç–æ–¥ –¥–æ–±—É–≤–∞–Ω–Ω—è –∞–ª—å–¥–µ–≥—ñ–¥—ñ–≤:
CH3
CH2
CH CH2
CH3
CH2
CH2
CH2
C
O
H
CH3
CH2
CH C
O
HCH3
+ +–°–û –ù2
–ü–µ–Ω—Ç–∞–Ω–∞–ª—å
2-–ú–µ—Ç–∏–ª–±—É—Ç–∞–Ω–∞–ª—å
5. –ì—ñ–¥—Ä–æ–ª—ñ–∑ –≥–µ–º—ñ–Ω–∞–ª—å–Ω–∏—Ö –¥–∏–≥–∞–ª–æ–≥–µ–Ω–æ–ø–æ—Ö—ñ–¥–Ω–∏—Ö:](https://image.slidesharecdn.com/12-180202085509/85/12-4-320.jpg)

![I. –Ý–µ–∞–∫—Ü—ñ—ó –ø—Ä–∏—î–¥–Ω–∞–Ω–Ω—è.
1. –í–∑–∞—î–º–æ–¥—ñ—è –∑ –∞–º–æ–Ω—ñ–∞–∫–æ–º:
C
O
R
R'
C NH2
R
R'
OH
H NH2
C NHR
R'
- H2
O

 
–ê–ª—å–¥—ñ–º—ñ–Ω,
–∫–µ—Ç—ñ–º—ñ–Ω
+
(H)(H) (H)
2. –í–∑–∞—î–º–æ–¥—ñ—è –∑—ñ —Å–ø–∏—Ä—Ç–∞–º–∏:
C
O
R
R'
C OR"R
R'
OH
H OR" C OR"R
R'
OR"
H-OR"
- H2O
–ù–∞–ø—ñ–≤–∞—Ü–µ—Ç–∞–ª—å


+
(H)(H) (H)
3. –í–∑–∞—î–º–æ–¥—ñ—è –∑ —Ü—ñ–∞–Ω–æ–≤–æ–¥–Ω–µ–º (–æ–∫—Å–∏–Ω—ñ—Ç—Ä–∏–ª—å–Ω–∏–π —Å–∏–Ω—Ç–µ–∑):
C
O
R
R'
C CR
R'
OH
NH C N C CR
R'
OH O
OH
H-OH+3
- NH3
–û–∫—Å–∏–Ω—ñ—Ç—Ä–∏–ª ÔÅ°-–ì—ñ–¥—Ä–æ–∫—Å–∏–∫–∏—Å–ª–æ—Ç–∞


+
(H)(H) (H)
4. Приєднання натрій гідросульфіту NaHSO3 – утворення безбарвних
–æ—Å–∞–¥—ñ–≤ –±—ñ—Å—É–ª—å—Ñ—ñ—Ç–Ω–∏—Ö –ø–æ—Ö—ñ–¥–Ω–∏—Ö —î —è–∫—ñ—Å–Ω–æ—é —Ä–µ–∞–∫—Ü—ñ—î—é –Ω–∞ –æ–∫—Å–æ—Å–ø–æ–ª—É–∫–∏:
C
O
R
R'
H SO3
Na C SO3
NaR
R'
OH

 
+
(H) (H)
5. –ü—Ä–∏—î–¥–Ω–∞–Ω–Ω—è –º–∞–≥–Ω—ñ–π–æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Å–ø–æ–ª—É–∫ (—Ä–µ–∞–∫—Ç–∏–≤—ñ–≤ –ì—Ä—ñ–Ω—å—è—Ä–∞):
C
O
R
R'
C R"R
R'
O MgI
R" MgI C R"R
R'
OH
H-OH



 
(H)

(H) (H) + Mg(OH)I
C–ø–∏—Ä—Ç
+
(H)(H) (H)
II. –Ý–µ–∞–∫—Ü—ñ—ó –æ–∫–∏—Å–Ω–µ–Ω–Ω—è —î —è–∫—ñ—Å–Ω–∏–º–∏ —Ä–µ–∞–∫—Ü—ñ—è–º–∏ –Ω–∞ –∞–ª—å–¥–µ–≥—ñ–¥–∏, –∞–±–æ –∂
—Ä–µ–∞–∫—Ü—ñ—è–º–∏, —â–æ –≤—ñ–¥—Ä—ñ–∑–Ω—è—é—Ç—å –∞–ª—å–¥–µ–≥—ñ–¥–∏ –≤—ñ–¥ –∫–µ—Ç–æ–Ω—ñ–≤.
1. –Ý–µ–∞–∫—Ü—ñ—è ¬´—Å—Ä—ñ–±–Ω–æ–≥–æ –¥–∑–µ—Ä–∫–∞–ª–∞¬ª:
C
O
R
H
C
O
R
OH
[Ag(NH3
)2
]OH


_
+
+
tº
+ NH3 + H2O+ Ag](https://image.slidesharecdn.com/12-180202085509/85/12-6-320.jpg)
![2. –Ý–µ–∞–∫—Ü—ñ—è –∑ —Ñ–µ–ª—ñ–Ω–≥–æ–≤–æ—é —Ä—ñ–¥–∏–Ω–æ—é. –§–µ–ª—ñ–Ω–≥–æ–≤–∞ —Ä—ñ–¥–∏–Ω–∞ —Å–∫–ª–∞–¥–∞—î—Ç—å—Å—è –∑ –¥–≤–æ—Ö
–∫–æ–º–ø–æ–Ω–µ–Ω—Ç—ñ–≤ (–§–µ–ª—ñ–Ω–≥ I —Ç–∞ –§–µ–ª—ñ–Ω–≥ II), —â–æ –∑–º—ñ—à—É—é—Ç—å—Å—è –±–µ–∑–ø–æ—Å–µ—Ä–µ–¥–Ω—å–æ –ø—ñ–¥ —á–∞—Å
–¥–æ—Å–ª—ñ–¥—É –∑ –∞–ª—å–¥–µ–≥—ñ–¥–æ–º.
Фелінг I – це водний розчин СuSO4; Фелінг II – лужний розчин сегнетової
—Å–æ–ª—ñ (–Ω–∞—Ç—Ä—ñ–π-–∫–∞–ª—ñ–π —Ç–∞—Ä—Ç—Ä–∞—Ç). –ü—Ä–∏ –∑–º—ñ—à—É–≤–∞–Ω–Ω—ñ –§–µ–ª—ñ–Ω–≥—É I —ñ –§–µ–ª—ñ–Ω–≥—É II, –ø–æ-–ø–µ—Ä—à–µ,
—É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –≥—ñ–¥—Ä–æ–∫—Å–∏–¥ –ö—É–ø—Ä—É–º—É (–°u2+
):
+ +CuSO4 2NaOH Cu(OH)2 Na2SO4
–¶–µ–π —Å–≤—ñ–∂–µ–æ—Å–∞–¥–∂–µ–Ω–∏–π Cu(–û–ù)2 —Ä–µ–∞–≥—É—î –∑ —Å–µ–≥–Ω–µ—Ç–æ–≤–æ—é —Å—ñ–ª–ª—é –ø–æ–¥—ñ–±–Ω–æ –¥–æ
–±–∞–≥–∞—Ç–æ–∞—Ç–æ–º–Ω–æ–≥–æ —Å–ø–∏—Ä—Ç—É, –∞ —Å–∞–º–µ:
H
H
CHOH
CHOH
COOK
COONa
OH
Cu
OH
CH
CH
COOK
COONa
O
O
Cu
CH
CH
COOK
O
O
COONa
- H2O
+2
–¢–æ–±—Ç–æ –∞–Ω–∞–ª—ñ–∑–æ–≤–∞–Ω–∏–π —Ä–æ–∑—á–∏–Ω –Ω–∞–±—É–≤–∞—î —ñ–Ω—Ç–µ–Ω—Å–∏–≤–Ω–æ-—Å–∏–Ω—å–æ–≥–æ –∑–∞–±–∞—Ä–≤–ª–µ–Ω–Ω—è. –ü—Ä–∏
–ø–æ–¥–∞–ª—å—à–æ–º—É –Ω–∞–≥—Ä—ñ–≤–∞–Ω–Ω—ñ –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è –æ–∫–∏—Å–Ω–µ–Ω–Ω—è –∞–ª—å–¥–µ–≥—ñ–¥—É —É—Ç–≤–æ—Ä–µ–Ω–∏–º
–∫–æ–º–ø–ª–µ–∫—Å–æ–º —ñ –≤—ñ–¥–Ω–æ–≤–ª–µ–Ω–Ω—è –ö—É–ø—Ä—É–º—É (–°u2+
) –¥–æ –°u1+
, –∞ –ø—Ä–∏ –ø–µ–≤–Ω–æ–º—É
—Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—ñ —Ä–µ–∞–≥–µ–Ω—Ç—ñ–≤ —ñ –¥–æ –º–µ—Ç–∞–ª—ñ—á–Ω–æ—ó –º—ñ–¥—ñ —á–µ—Ä–µ–∑ —Ç–∞–∫—ñ —Å–ø–æ–ª—É–∫–∏:
Cu(OH)2 CuOH
Cu2O
Cu
H2O
–ü—Ä–∏ —Ü—å–æ–º—É –∞–ª—å–¥–µ–≥—ñ–¥ –æ–∫–∏—Å–Ω—é—î—Ç—å—Å—è –¥–æ –∫–∏—Å–ª–æ—Ç–∏, –≤–∏–ø–∞–¥–∞—î —á–µ—Ä–≤–æ–Ω–∏–π –æ—Å–∞–¥
–°u2–û, —ñ–∑ –∑—Ä—É–π–Ω–æ–≤–∞–Ω–æ–≥–æ –∫–æ–º–ø–ª–µ–∫—Å—É –≤–∏–≤—ñ–ª—å–Ω—è—î—Ç—å—Å—è —Å–µ–≥–Ω–µ—Ç–æ–≤–∞ —Å—ñ–ª—å.
3. –Ý–µ–∞–∫—Ü—ñ—è –∑ —Ñ—É–∫—Å–∏–Ω—Å—É–ª—å—Ñ—ñ—Ç–Ω–æ—é –∫–∏—Å–ª–æ—Ç–æ—é ‚Äì —É—Ç–≤–æ—Ä–µ–Ω–Ω—è –º–∞–ª–∏–Ω–æ–≤–æ-
—á–µ—Ä–≤–æ–Ω–æ–≥–æ –∑–∞–±–∞—Ä–≤–ª–µ–Ω–Ω—è —É —Ä–∞–∑—ñ –ø—Ä–∏—Å—É—Ç–Ω–æ—Å—Ç—ñ –∞–ª—å–¥–µ–≥—ñ–¥—É.
4. –ö–µ—Ç–æ–Ω–∏ –æ–∫–∏—Å–Ω—é—é—Ç—å—Å—è –≤ –Ω–∞–±–∞–≥–∞—Ç–æ –∂–æ—Ä—Å—Ç–∫—ñ—à–∏—Ö —É–º–æ–≤–∞—Ö (—Ç—ñ–ª—å–∫–∏ —Å–∏–ª—å–Ω–∏–º–∏
окиснювачами під час нагрівання). При цьому відбувається розрив зв’язків С−С
–∑ –æ–±–æ—Ö –±–æ–∫—ñ–≤ –∫–∞—Ä–±–æ–Ω—ñ–ª—å–Ω–æ—ó –≥—Ä—É–ø–∏. –¢–∞–∫–∏–π —Ö—ñ–¥ —Ä–µ–∞–∫—Ü—ñ—ó –≤–∏–∑–Ω–∞—á–∞—î—Ç—å—Å—è –ø—Ä–∞–≤–∏–ª–æ–º
–í–∞–≥–Ω–µ—Ä–∞-–ü–æ–ø–æ–≤–∞ (—É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è —Å—É–º—ñ—à –∫–∞—Ä–±–æ–Ω–æ–≤–∏—Ö –∫–∏—Å–ª–æ—Ç).
C
O
R
OHCH2
R C R'
O
C
O
CH2
OH
R
C
OH
R'
O
C
OH
R'
O
[O]
+
+1)
1)
2) 2)](https://image.slidesharecdn.com/12-180202085509/85/12-7-320.jpg)
































































