2 ÐģŅ
- 1. ÐÐÐĪÐÐÐ Ð ÐĪÐÐ ÐÐÐĶÐÐÐĒÐЧÐÐĄÐÐÐ ÐĨÐÐÐÐ http://pharmchem.nuph.edu.ua ÐÐĩКŅÐļŅ: ÐÐēŅÐūŅ ÐŧÐĩКŅÐļÐļ - ÐīÐūŅ. ÐÐąŅ ÐĻаŅК Ð.Ð. ÐĄÐŧаÐđÐī 1
- 2. ÐÐ―ŅÐūŅОаŅÐļÐūÐ―Ð―ŅÐĩ ÐļŅŅÐūŅÐ―ÐļКÐļ 1. ÐÐĩŅÐķаÐēÐ―Ð° ŅаŅОаКÐūÐŋÐĩŅ ÐĢКŅаŅÐ―Ðļ. â 1-Ðĩ ÐēÐļÐī. â ÐĨ.: Ð ÐÐ ÐÐ, 2001. â 556 Ņ. 2. ÐÐĩŅÐķаÐēÐ―Ð° ŅаŅОаКÐūÐŋÐĩŅ ÐĢКŅаŅÐ―Ðļ. â 1-Ðĩ ÐēÐļÐī. ÐÐūÐŋÐūÐēÐ―ÐĩÐ―Ð―Ņ 1. â ÐĨ.: Ð ÐÐ ÐÐ, 2004. â 494 Ņ. 3. ÐÐūŅŅÐīаŅŅŅÐēÐĩÐ―Ð―Ð°Ņ ŅаŅОаКÐūÐŋÐĩŅ ÐĄÐĄÐĄÐ . XI ÐļзÐīÐ°Ð―ÐļÐĩ. ÐŅÐŋŅŅК I. â Ð.: ÐÐĩÐīÐļŅÐļÐ―Ð°, 1987. â 334 Ņ. 2. ÐÐūŅŅÐīаŅŅŅÐēÐĩÐ―Ð―Ð°Ņ ŅаŅОаКÐūÐŋÐĩŅ ÐĄÐĄÐĄÐ . XI ÐļзÐīÐ°Ð―ÐļÐĩ. ÐŅÐŋŅŅК II. â Ð.: ÐÐĩÐīÐļŅÐļÐ―Ð°, 1989. â 398 Ņ. 3. ÐÐūŅŅÐīаŅŅŅÐēÐĩÐ―Ð―Ð°Ņ ŅаŅОаКÐūÐŋÐĩŅ ÐĄÐĄÐĄÐ . X ÐļзÐīÐ°Ð―ÐļÐĩ. â Ð.: ÐÐĩÐīÐļŅÐļÐ―Ð°, 1968. â 1079 Ņ. 4. Ð ŅКÐūÐēÐūÐīŅŅÐēÐū К ÐŧÐ°ÐąÐūŅаŅÐūŅÐ―ŅО Ð·Ð°Ð―ŅŅÐļŅО ÐŋÐū ŅаŅОаŅÐĩÐēŅÐļŅÐĩŅКÐūÐđ Ņ ÐļОÐļÐļ. /ÐÐūÐī ŅÐĩÐī. Ð.Ð. ÐŅзаОаŅŅÐĩÐēа. â Ð.: ÐÐĩÐīÐļŅÐļÐ―Ð°, 1987. â 303 Ņ. 7. Ð. Ð. ÐаКŅŅŅÐļÐ―Ð°, ÐĪ. Ð. ÐаÐģÐ°Ð―, Ð. Ð. ÐÐļŅÐļŅÐĩÐ―ÐšÐū Ðļ ÐĪ. Ð. ÐÐļŅŅÐĩÐ―ÐšÐū. ÐÐĩŅÐūÐīŅ Ð°Ð―Ð°ÐŧÐļза ÐŧÐĩКаŅŅŅÐē. â Ð.: ÐÐīÐūŅÐūÐēâŅ, 1984. â 224 Ņ. 5. ÐŅ ŅŅÐąŅŅÐ°Ð―ŅÐļÐļ К ÐŧÐĩКаŅŅŅÐēŅ: ÐĢŅÐĩÐą. ÐŋÐūŅÐūÐąÐļÐĩ/ Ð. Ð. ÐÐĩзŅÐģÐŧŅÐđ, Ð. Ð. ÐÐūÐŧÐūŅÐūÐē, Ð. ÐĄ. ÐŅÐļŅÐĩÐ―ÐšÐū Ðļ ÐīŅ.; ÐÐūÐī ŅÐĩÐī. Ð. Ð. ЧÐĩŅÐ―ŅŅ . â ÐĨаŅŅКÐūÐē: ÐзÐī-ÐēÐū ÐÐĪаÐĢ: ÐÐūÐī ŅÐĩÐī. Ð. Ð. ЧÐĩŅÐ―ŅŅ . â ÐĨаŅŅКÐūÐē: ÐзÐī-ÐēÐū ÐÐĪаÐĢ: ÐÐūÐŧÐūŅŅÐĩ ŅŅŅÐ°Ð―ÐļŅŅ, 2005 â 1244. 6. ÐĪŅÐ―ÐšŅÐļÐūÐ―Ð°ÐŧŅÐ―ŅÐđ Ð°Ð―Ð°ÐŧÐļз ÐūŅÐģÐ°Ð―ÐļŅÐĩŅКÐļŅ ÐŧÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅŅ ÐēÐĩŅÐĩŅŅÐē /Ð. Ð. ÐĄÐŧÐļÐēКÐļÐ―, Ð. Ð. ÐĄÐ°ÐīŅÐļКÐūÐēа: ÐŋÐūÐī. ŅÐĩÐī. аКаÐīÐĩОÐļКа Ð ÐÐÐ, ÐŋŅÐūŅ. Ð. Ð. ÐŅзаОаŅŅÐĩÐēа. â ÐÐūŅÐūÐ―ÐĩÐķ: ÐÐūŅÐūÐ―ÐĩÐķŅКÐļÐđ ÐģÐūŅŅÐīаŅŅŅÐēÐĩÐ―Ð―ŅÐđ ŅÐ―ÐļÐēÐĩŅŅÐļŅÐĩŅ, 2007. â 426 Ņ. 7. ÐĪаŅОаŅÐĩÐēŅÐļŅÐ―ÐļÐđ Ð°Ð―Ð°ÐŧŅз: ÐаÐēŅ ÐŋÐūŅŅÐą. ÐīÐŧŅ ŅŅŅÐī. ÐēÐļŅ. ŅаŅОаŅ. Ð―Ð°ÐēŅ. заКÐŧ. ÐÐÐâIV ŅŅÐēÐ―ŅÐē аКŅÐĩÐīÐļŅаŅŅŅ / Ð. Ð. ÐÐĩзŅÐģÐŧÐļÐđ, Ð. Ð. ÐŅŅÐīŅКÐū, ÐĄ. Ð. ÐÐĩÐūÐ―ÐūÐēа Ņа ŅÐ―.; Ðа ŅÐĩÐī. Ð. Ð. ÐÐĩзŅÐģÐŧÐūÐģÐū. â ÐĨ.: ÐÐļÐī-ÐēÐū ÐÐĪаÐĢ; ÐÐūÐŧÐūŅŅ ŅŅÐūŅŅÐ―ÐšÐļ, 2001. â 240 Ņ. ÐĄÐŧаÐđÐī 2
- 3. ÐÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅÐĩ ÐēÐĩŅÐĩŅŅÐēа, КÐūŅÐūŅŅÐĩ ŅÐūÐīÐĩŅÐķаŅ ОаÐģÐ―ÐļÐđ: ïž ÐаÐģÐ―ÐļŅ ÐūКŅÐļÐī ÐŧÐĩÐģКÐļÐđ ïž ÐаÐģÐ―ÐļŅ ÐūКŅÐļÐī ŅŅÐķÐĩÐŧŅÐđ ïž ÐаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅ ÐģÐĩÐŋŅаÐģÐļÐīŅаŅ ïž ÐаÐģÐ―ÐļŅ КаŅÐąÐūÐ―Ð°Ņ ÐŧÐĩÐģКÐļÐđ ïž ÐаÐģÐ―ÐļŅŅŅ КаŅÐąÐūÐ―Ð°Ņ ŅŅÐķÐĩÐŧŅÐđ ÐÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅÐĩ ÐēÐĩŅÐĩŅŅÐēа, КÐūŅÐūŅŅÐĩ ŅÐūÐīÐĩŅÐķаŅ КаÐŧŅŅÐļÐđ : ïž ÐаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐī ÐīÐļÐģÐļÐīŅаŅ ïž ÐаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐī ÐģÐĩКŅаÐģÐļÐīŅаŅ 3 ÐÐŧÐ°Ð― ÐÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅÐĩ ÐēÐĩŅÐĩŅŅÐēа - ÐŋŅÐūÐļзÐēÐūÐīÐ―ŅÐĩ ŅÐŧÐĩОÐĩÐ―ŅÐūÐē II ÐģŅŅÐŋÐŋŅ ÐŋÐĩŅÐļÐūÐīÐļŅÐĩŅКÐūÐđ ŅÐļŅŅÐĩОŅ Ð. Ð. ÐÐĩÐ―ÐīÐĩÐŧÐĩÐĩÐēа ÐĄÐŧаÐđÐī 3
- 4. ÐÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅÐĩ ÐēÐĩŅÐĩŅŅÐēа, ŅÐūÐīÐĩŅÐķаŅÐļÐĩ ÐąÐ°ŅÐļÐđ: ïž ÐаŅÐļŅ ŅŅÐŧŅŅаŅ ÐÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅÐĩ ÐēÐĩŅÐĩŅŅÐēа, ŅÐūÐīÐĩŅÐķаŅÐļÐĩ ŅÐļÐ―Ðš: ïž ÐĶÐļÐ―ÐšÐ° ÐūКŅÐļÐī ïž ÐĶÐļÐ―ÐšÐ° ŅŅÐŧŅŅаŅ ÐģÐĩÐŋŅаÐģÐļÐīŅаŅ ÐÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅÐĩ ÐēÐĩŅÐĩŅŅÐēа, ŅÐūÐīÐĩŅÐķаŅÐļÐĩ ŅŅŅŅŅ: ïž Ð ŅŅŅÐļ (ÐÐ) Ņ ÐŧÐūŅÐļÐī ïž Ð ŅŅŅÐļ (ÐÐ) ÐūКŅÐļÐī ÐķÐĩÐŧŅŅÐđ ïž Ð ŅŅŅÐļ (ÐÐ) ÐūКŅÐļŅÐļÐ°Ð―ÐļÐī ÐĄÐŧаÐđÐī 4
- 5. ÐаÐģÐ―ÐļŅ ÐūКŅÐļÐī ÐŧÐĩÐģКÐļÐđ (Magnesii oxydum leve)(ÐÐĪÐĢ) MgO M.О. 40.30 ÐаÐģÐ―ÐļŅ ÐūКŅÐļÐī ŅŅÐķÐĩÐŧŅÐđ (Magnesii oxydum ponderosum)(ÐÐĪÐĢ) MgO M.О. 40.30 ÐĄÐŧаÐđÐī 5
- 6. 3MgCO3 · Mg(OH)2 · 3H2O â â 4MgO + 3CO2ï + 4H2O ÐÐūÐŧŅŅÐĩÐ―ÐļÐĩ. ÐŅÐūКаÐŧÐļÐēÐ°Ð―ÐļÐĩО ОаÐģÐ―ÐļŅ КаŅÐąÐūÐ―Ð°Ņа ÐūŅÐ―ÐūÐēÐ―ÐūÐģÐū ÐŋŅÐļ 900â1000 °C: ÐĄÐēÐūÐđŅŅÐēа. ÐÐĩÐŧКÐļÐĩ аОÐūŅŅÐ―ŅÐĩ ÐŋÐūŅÐūŅКÐļ ÐąÐĩÐŧÐūÐģÐū ŅÐēÐĩŅа. ÐŅаКŅÐļŅÐĩŅКÐļ Ð―ÐĩŅаŅŅÐēÐūŅÐļОŅÐĩ Ðē ÐēÐūÐīÐĩ, Ðē КÐūŅÐūŅÐūÐđ ÐŋŅÐūŅÐēÐŧŅŅŅ ŅÐĩÐŧÐūŅÐ―ŅŅ ŅÐĩаКŅÐļŅ ÐŋÐū ŅÐĩÐ―ÐūÐŧŅŅаÐŧÐĩÐļÐ―Ņ. РаŅŅÐēÐūŅŅŅŅŅŅ Ðē ŅÐ°Ð·ÐąÐ°ÐēÐŧÐĩÐ―Ð―ŅŅ КÐļŅÐŧÐūŅаŅ , Ðē ÐąÐūÐŧŅŅÐļÐ―ŅŅÐēÐĩ ŅÐŧŅŅаÐĩÐē ŅÐū ŅÐŧÐ°ÐąŅО ÐēŅÐīÐĩÐŧÐĩÐ―ÐļÐĩО ÐŋŅзŅŅŅКÐūÐē Ðģаза. Ðа ÐēÐūзÐīŅŅ Ðĩ, ÐŋÐūŅŅÐĩÐŋÐĩÐ―Ð―Ðū ÐŋÐūÐģÐŧÐūŅаŅ ŅÐģÐŧÐĩŅÐūÐīа (IV) ÐūКŅÐļÐī, ÐŋÐĩŅÐĩŅ ÐūÐīÐļŅ Ðē ОаÐģÐ―ÐļŅ КаŅÐąÐūÐ―Ð°Ņ. ÐаŅŅÐŋÐ―ÐūÐđ ÐūÐąŅÐĩО. 15,0 Ðģ ОаÐģÐ―ÐļŅ ÐūКŅÐļÐīа ÐŧÐĩÐģКÐūÐģÐū Ð·Ð°Ð―ÐļОаÐĩŅ ÐūÐąŅÐĩО ÐūКÐūÐŧÐū 150 ОÐŧ. 15,0 Ðģ ОаÐģÐ―ÐļŅ ÐūКŅÐļÐīа ŅŅÐķÐĩÐŧÐūÐģÐū Ð·Ð°Ð―ÐļОаÐĩŅ ÐūÐąŅÐĩО ÐūКÐūÐŧÐū 30 ОÐŧ. ÐĄÐŧаÐđÐī 6
- 7. ÐаŅŅÐŋÐ―ÐūÐđ ÐūÐąŅÐĩО. ÐŅÐŋŅŅÐ°Ð―ÐļŅ ÐŋÐūзÐēÐūÐŧŅÐĩŅ ÐūÐŋŅÐĩÐīÐĩÐŧÐļŅŅ ÐŋŅÐļ заÐīÐ°Ð―Ð―ŅŅ ŅŅÐŧÐūÐēÐļŅŅ Ð―Ð°ŅŅÐŋÐ―ÐūÐđ ÐūÐąŅÐĩО Ðļ Ð―Ð°ŅŅÐŋÐ―ŅŅ ÐŋÐŧÐūŅÐ―ÐūŅŅŅ ОаŅÐĩŅÐļаÐŧа, ŅÐūŅŅÐūŅŅÐĩÐģÐū Ðļз ŅÐēÐĩŅÐīŅŅ ŅаŅŅÐļŅ (Ð―Ð°ÐŋŅÐļОÐĩŅ, ÐŋÐūŅÐūŅКÐūÐē, ÐģŅÐ°Ð―ŅÐŧ), ŅŅаÐīКÐĩ, ŅÐŋÐūŅÐūÐąÐ―ÐūŅŅŅ ОаŅÐĩŅÐļаÐŧа К ŅŅаÐīКÐĩ, а ŅаКÐķÐĩ ÐĩÐģÐū ÐūÐąŅÐĩО Ðļ ÐŋÐŧÐūŅÐ―ÐūŅŅŅ ÐŋÐūŅÐŧÐĩ ŅŅаÐīКÐļ. ÐÐąÐūŅŅÐīÐūÐēÐ°Ð―ÐļŅ. ÐŅÐļÐąÐūŅ ŅÐūŅŅÐūÐļŅ Ðļз ŅÐŧÐĩÐīŅŅŅÐļŅ ŅаŅŅÐĩÐđ: - ÐĄŅŅŅŅ ÐļÐēаŅŅÐĩÐģÐū ŅŅŅŅÐūÐđŅŅÐēÐū, ÐūÐąÐĩŅÐŋÐĩŅÐļÐēаŅŅÐĩÐĩ 250 Âą 15 ŅÐūŅКÐūКÐūÐē ŅÐļÐŧÐļÐ―ÐīŅа Ðē ОÐļÐ―ŅŅŅ Ņ ÐēŅŅÐūŅŅ (3 Âą 0.2) mm; ÐŋÐūÐīŅŅаÐēКа ÐīÐŧŅ ÐģŅаÐīŅÐļŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū ŅÐļÐŧÐļÐ―ÐīŅа, ŅÐ―Ð°ŅŅÐķÐĩÐ―Ð―Ð°Ņ ÐīÐĩŅÐķаŅÐĩÐŧÐĩО, ÐļОÐĩÐĩŅ ОаŅŅŅ (450 Âą 5) Ðģ; - ÐŅаÐīŅÐļŅÐūÐēÐ°Ð―Ð―ŅÐđ ŅÐļÐŧÐļÐ―ÐīŅ ÐĩОКÐūŅŅŅŅ 250 ОÐŧ (ŅÐĩÐ―Ð° ÐīÐĩÐŧÐĩÐ―ÐļŅ - 2 ОÐŧ); ОаŅŅа ŅÐļÐŧÐļÐ―ÐīŅа - (220 + 40) Ðģ. ÐĄÐŧаÐđÐī 7
- 8. ÐÐīÐĩÐ―ŅÐļŅÐļКаŅÐļŅ: 1. РаŅŅÐēÐūŅ ŅŅÐąŅŅÐ°Ð―ŅÐļÐļ ÐīаÐĩŅ ŅÐĩаКŅÐļŅ ОаÐģÐ―ÐļÐĩО: MgO + 2HNO3 â Mg(NO3)2 + H2O MgCl2 + Na2HPO4 + NH3âMgNH4PO4â+ 2NaCl ÐąÐĩÐŧŅÐđ ÐÐĩŅаŅОаКÐūÐŋÐĩÐđÐ―Ð°Ņ ŅÐĩаКŅÐļŅ: 2. ÐÐūÐ― ОаÐģÐ―ÐļŅ Ņ 8-ÐūКŅÐļŅ ÐļÐ―ÐūÐŧÐļÐ―Ð° Ðē ŅŅÐĩÐīÐĩ аООÐļаŅÐ―ÐūÐģÐū ÐąŅŅÐĩŅа ÐūÐąŅазŅÐĩŅ ÐķÐĩÐŧŅÐū-зÐĩÐŧÐĩÐ―ŅÐđ КŅÐļŅŅаÐŧÐŧÐļŅÐĩŅКÐļÐđ ÐūŅаÐīÐūК: N OH + Mg2+ 2 N O N OMg + 2H+ ÐĄÐŧаÐđÐī 8
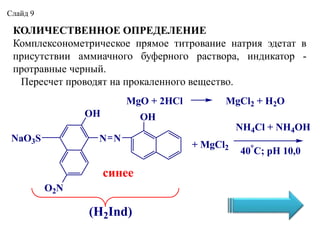
- 9. ÐÐÐÐЧÐÐĄÐĒÐÐÐÐÐÐ ÐÐÐ ÐÐÐÐÐÐÐÐ ÐÐūОÐŋÐŧÐĩКŅÐūÐ―ÐūОÐĩŅŅÐļŅÐĩŅКÐūÐĩ ÐŋŅŅОÐūÐĩ ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅ Ðē ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ аООÐļаŅÐ―ÐūÐģÐū ÐąŅŅÐĩŅÐ―ÐūÐģÐū ŅаŅŅÐēÐūŅа, ÐļÐ―ÐīÐļКаŅÐūŅ - ÐŋŅÐūŅŅаÐēÐ―ŅÐĩ ŅÐĩŅÐ―ŅÐđ. ÐÐĩŅÐĩŅŅÐĩŅ ÐŋŅÐūÐēÐūÐīŅŅ Ð―Ð° ÐŋŅÐūКаÐŧÐĩÐ―Ð―ÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēÐū. MgO + 2HCl MgCl2 + H2O OH N N OH O2N NH4Cl + NH4OH + MgÐĄl2 40ï° ÐĄ; pH 10,0 NaO3S (H2Ind) ŅÐļÐ―ÐĩÐĩ ÐĄÐŧаÐđÐī 9
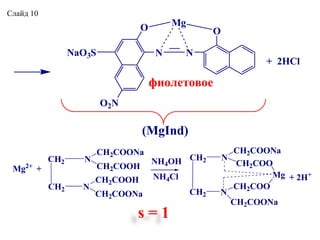
- 10. O N N O O2N Mg + 2ÐCl NaO3S (MgInd) ŅÐļÐūÐŧÐĩŅÐūÐēÐūÐĩ CH2 CH2 N N CH2COONa CH2COO CH2COO CH2COONa Mg CH2 CH2 N N CH2COONa CH2COOH CH2COOH CH2COONa Mg2+ + NH4OH NH4Cl + 2H+ s = 1 ÐĄÐŧаÐđÐī 10
- 11. CH2 CH2 N N CH2COONa CH2COO CH2COO CH2COONa Mg CH2 CH2 N N CH2COONa CH2COOH CH2COOH CH2COONa MgInd + H2Ind + ŅÐļÐ―Ņ ŅŅÐūÐŧÐĩŅÐūÐēÐĩ ÐĄÐŧаÐđÐī 11 ŅÐļÐūÐŧÐĩŅÐūÐēÐūÐĩ ŅÐļÐ―ÐĩÐĩ
- 12. ÐģÐīÐĩ: ÐĄÐ â ОÐūÐŧŅŅÐ―Ð°Ņ КÐūÐ―ŅÐĩÐ―ŅŅаŅÐļŅ ŅÐļŅŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū ŅаŅŅÐēÐūŅа, ОÐūÐŧŅ/Ðŧ; Ð.О. â ОÐūÐŧÐĩКŅÐŧŅŅÐ―Ð°Ņ ОаŅŅа ÐļŅŅÐŧÐĩÐīŅÐĩОÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēа, Ðģ/ОÐūÐŧŅ; s â ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―Ð―ÐūÐĩ ÐŋÐū ŅŅаÐēÐ―ÐĩÐ―ÐļŅ ŅÐĩаКŅÐļÐļ ŅŅÐĩŅ ÐļÐūОÐĩŅŅÐļŅÐĩŅКÐūÐĩ ŅÐūÐūŅÐ―ÐūŅÐĩÐ―ÐļÐĩ - КÐūÐŧÐļŅÐĩŅŅÐēÐū ОÐūÐŧÐĩÐđ ÐļŅŅÐŧÐĩÐīŅÐĩОÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēа, ŅÐĩаÐģÐļŅŅŅŅÐĩÐģÐū Ņ ÐūÐīÐ―ÐļО ОÐūÐŧÐĩО ŅÐļŅŅÐ°Ð―Ņа. ÐĒÐļŅŅ Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа ÐŋÐū ОаÐģÐ―ÐļŅ ÐūКŅÐļÐīŅ ŅаŅŅŅÐļŅŅÐēаŅŅ ÐŋÐū ŅÐūŅОŅÐŧÐĩ: 12 ОÐŧ/Ðģ .О.ÐÐĄÐž T gOÐÐÐĒÐNa gO ÐÐÐĒÐNa 1000 sM M ïï ï― ÐĄÐŧаÐđÐī 12
- 13. ÐģÐīÐĩ: V â ÐūÐąŅÐĩО 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ÐĩÐīÐĩŅаŅа, ÐļзŅаŅŅ ÐūÐīÐūÐēÐ°Ð―Ð―ÐūÐģÐū Ð―Ð° ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ ОаÐģÐ―ÐļŅ ÐūКŅÐļÐīа , ОÐŧ; Ð â КÐūŅŅŅÐļŅÐļÐĩÐ―Ņ ÐŋÐūÐŋŅаÐēКÐļ К ОÐūÐŧŅŅÐ―ÐūŅŅÐļ 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа; ÐĒ â ŅÐļŅŅ 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа ÐŋÐū ОаÐģÐ―ÐļŅ ÐūКŅÐļÐīŅ, ОÐģ / ОÐŧ; m â ОаŅŅа Ð―Ð°ÐēÐĩŅКÐļ ОаÐģÐ―ÐļŅ ÐūКŅÐļÐīа, Ðģ; VО.К. â ÐūÐąŅÐĩО ОÐĩŅÐ―ÐūÐđ КÐūÐŧÐąŅ, ОÐŧ; VÐŋ. â ÐūÐąŅÐĩО ÐŋŅÐŋÐĩŅКÐļ, ОÐŧ РаŅŅÐĩŅ КÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐģÐū ŅÐūÐīÐĩŅÐķÐ°Ð―ÐļŅ ОаÐģÐ―ÐļŅ ÐūКŅÐļÐīа Ðē ÐŋŅÐūŅÐĩÐ―ŅаŅ ÐŋŅÐūÐēÐūÐīŅŅ ÐŋÐū ŅÐūŅОŅÐŧÐĩ: 13 100 100 100 8 ОК Ð― Ðŋ ÐēŅŅаŅа Ðē ОаŅŅ ÐŋŅÐļ ÐŋŅÐūÐķаŅŅÐēÐ°Ð―Ð―Ņ V K T V X(%)MgO m V ( % ) ï ï ï ï ï ï― ï ï ï ÐĄÐŧаÐđÐī 13 ÐŋÐūŅÐĩŅŅ Ðē ОаŅŅÐĩ ÐŋŅÐļ ÐŋŅÐūКаÐŧÐļÐēÐ°Ð―ÐļÐļ
- 14. 2. ÐŅÐļÐīÐļОÐĩŅŅÐļŅ, ÐūÐąŅаŅÐ―ÐūÐĩ ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ. ÐаÐēÐĩŅКŅ ОаÐģÐ―ÐļŅ ÐūКŅÐļÐīа ŅаŅŅÐēÐūŅŅŅŅ Ðē ÐļÐ·ÐąŅŅКÐĩ ŅаŅŅÐēÐūŅа КÐļŅÐŧÐūŅŅ ŅÐūÐŧŅÐ―ÐūÐđ, КÐūŅÐūŅŅÐđ заŅÐĩО ÐūŅŅÐļŅŅÐūÐēŅÐēаŅŅ ŅаŅŅÐēÐūŅÐūО Ð―Ð°ŅŅÐļŅ ÐģÐļÐīŅÐūКŅÐļÐīа Ðē ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ ОÐĩŅÐļÐŧÐūÐēÐūÐģÐū ÐūŅÐ°Ð―ÐķÐĩÐēÐūÐģÐū: s = 1/2 MgO + 2HCl â MgCl2 + H2O Ð―Ð°ÐīÐŧ. HCl + NaOH â NaCl + H2O ОÐŧ/Ðģ; .О.ÐÐĄÐž T gOHCl MgO HCl 1000 sM ïï ï― 100HCl HCl NaOH NaOH(V K V K ) T X(%) m ï ï ï ï ï ï― ÐĄÐŧаÐđÐī 14 ÐļÐ·Ðą.
- 15. ÐĨŅÐ°Ð―ÐĩÐ―ÐļÐĩ. Ð Ņ ÐūŅÐūŅÐū заКŅÐŋÐūŅÐĩÐ―Ð―ÐūÐđ ŅаŅÐĩ, ÐŋÐūŅКÐūÐŧŅКŅ ОаÐģÐ―ÐļŅ ÐūКŅÐļÐī ÐēзаÐļОÐūÐīÐĩÐđŅŅÐēŅÐĩŅ Ņ КаŅÐąÐūÐ―Ð°Ņа (IV) ÐūКŅÐļÐīÐūО Ðļ ÐēÐŧаÐģÐūÐđ, ŅÐūÐīÐĩŅÐķаŅÐĩÐđŅŅ Ðē ÐēÐūзÐīŅŅ Ðĩ, ÐūÐąŅазŅŅ ОаÐģÐ―ÐļŅ КаŅÐąÐūÐ―Ð°Ņ Ðļ ОаÐģÐ―ÐļŅ ÐģÐļÐīŅÐūКŅÐļÐī: MgO + CO2 â MgCO3 MgO + H2O â Mg(OH)2 ÐŅÐļОÐĩÐ―ÐĩÐ―ÐļÐĩ. ÐÐ―ŅаŅÐļÐīÐ―ŅÐđ ŅŅÐĩÐīŅŅÐēÐū ÐŋŅÐļ ÐŋÐūÐēŅŅÐĩÐ―Ð―ÐūÐđ КÐļŅÐŧÐūŅÐ―ÐūŅŅÐļ ÐķÐĩÐŧŅÐīÐūŅÐ―ÐūÐģÐū ŅÐūКа (ÐŋŅÐļ ÐģаŅŅŅÐļŅаŅ , ŅзÐēÐĩÐ―Ð―ÐūÐđ ÐąÐūÐŧÐĩÐ·Ð―Ðļ ÐķÐĩÐŧŅÐīКа Ðļ ÐīÐēÐĩÐ―Ð°ÐīŅаŅÐļÐŋÐĩŅŅŅÐ―ÐūÐđ КÐļŅКÐļ). ÐÐĩÐđŅŅаÐŧÐļзŅŅ КÐļŅÐŧÐūŅŅ Ņ ÐŧÐūŅÐļŅŅÐūÐēÐūÐīÐūŅÐūÐīÐ―ŅŅ ÐķÐĩÐŧŅÐīÐūŅÐ―ÐūÐģÐū ŅÐūКа, ÐŋŅÐĩÐēŅаŅаÐĩŅŅŅ Ðē ОаÐģÐ―ÐļŅ Ņ ÐŧÐūŅÐļÐī, КÐūŅÐūŅŅÐđ ÐūÐąÐŧаÐīаÐĩŅ ŅÐŧÐ°ÐąÐļŅÐĩÐŧŅÐ―ŅО ŅŅŅÐĩКŅÐūО. ÐŅÐļОÐĩÐ―ŅÐĩŅŅŅ ŅаКÐķÐĩ Ðē ÐąÐūÐŧŅŅÐļŅ ÐīÐūзаŅ ÐŋŅÐļ ÐūŅŅаÐēÐŧÐĩÐ―ÐļÐļ КÐļŅÐŧÐūŅаОÐļ. ÐаÐģÐ―ÐļŅ ÐūКŅÐļÐī ŅÐēÐŧŅÐĩŅŅŅ ÐūÐīÐ―ÐūÐđ Ðļз ŅÐūŅŅаÐēÐ―ŅŅ ŅаŅŅÐĩÐđ ÐŋŅÐĩÐŋаŅаŅа "ÐÐŧŅОаÐģÐĩÐŧŅ" Ðļ Ð°Ð―ŅÐļÐīÐūŅа ÐŋŅÐļ ÐūŅŅаÐēÐŧÐĩÐ―ÐļÐļ ОŅŅŅŅКÐūО. ÐĄÐŧаÐđÐī 15
- 16. ÐаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅ ÐģÐĩÐŋŅаÐģÐļÐīŅаŅ(ÐÐĪÐĢ) Magnesii sulfas heptahydricus MAGNESIUM SULPHATE HEPTAHYDRATE MgSO4 · 7Ð2Ð Ð.О.246,5 ÐаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅ ÐģÐĩÐŋŅаÐģÐļÐīŅаŅ ŅÐūÐīÐĩŅÐķÐļŅ Ð―Ðĩ ОÐĩÐ―ÐĩÐĩ 99.0% Ð―Ðĩ ÐąÐūÐŧÐĩÐĩ 100.5% MgSÐ4, Ðē ÐŋÐĩŅÐĩŅŅÐĩŅÐĩ Ð―Ð° ŅŅŅ ÐūÐĩ ÐēÐĩŅÐĩŅŅÐēÐū. ÐĄÐŧаÐđÐī 16
- 17. ÐÐÐÐĢЧÐÐÐÐ. РаŅŅÐēÐūŅÐĩÐ―ÐļÐĩО ОаÐģÐ―ÐĩзÐļŅа Ðē ÐģÐūŅŅŅÐĩÐđ КÐļŅÐŧÐūŅÐĩ ŅÐĩŅÐ―ÐūÐđ ŅазÐēÐĩÐīÐĩÐ―Ð―ÐūÐđ: MgCO3 + H2SO4 â MgSO4 + CO2â + H2O РаŅŅÐēÐūŅ ŅÐļÐŧŅŅŅŅŅŅ Ðļ КÐūÐ―ŅÐĩÐ―ŅŅÐļŅŅŅŅ ÐŋŅÐļ ÐēŅÐŋаŅÐļÐēÐ°Ð―ÐļÐļ ÐīÐū КŅÐļŅŅаÐŧÐŧÐļзаŅÐļÐļ. ÐĄÐĩŅÐ―Ð°Ņ КÐļŅÐŧÐūŅа ÐąÐĩŅÐĩŅŅŅ Ðē ÐļÐ·ÐąŅŅКÐĩ ÐīÐŧŅ ÐŋŅÐĩÐīŅÐŋŅÐĩÐķÐīÐĩÐ―ÐļŅ ÐģÐļÐīŅÐūÐŧÐļза ОаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅа Ņ ÐūÐąŅазÐūÐēÐ°Ð―ÐļÐĩО ÐūŅÐ―ÐūÐēÐ―ÐūÐđ ŅÐūÐŧÐļ ÐĄÐÐÐÐĄÐĒÐÐ. ÐŅÐļŅŅаÐŧÐŧÐļŅÐĩŅКÐļÐđ ÐŋÐūŅÐūŅÐūК ÐąÐĩÐŧÐūÐģÐū ŅÐēÐĩŅа ÐļÐŧÐļ ÐąÐŧÐĩŅŅŅŅÐļÐĩ ÐąÐĩŅŅÐēÐĩŅÐ―ŅÐĩ КŅÐļŅŅаÐŧÐŧŅ. ÐÐĩÐģКÐū ŅаŅŅÐēÐūŅÐļО Ðē ÐēÐūÐīÐĩ, ÐūŅÐĩÐ―Ņ ÐŧÐĩÐģКÐū ŅаŅŅÐēÐūŅÐļО Ðē КÐļÐŋŅŅÐĩÐđ ÐēÐūÐīÐĩ, ÐŋŅаКŅÐļŅÐĩŅКÐļ Ð―ÐĩŅаŅŅÐēÐūŅÐļОŅÐđ Ðē 96% ŅÐŋÐļŅŅÐĩ. S O O Mg Mg O O H H ÐĄÐŧаÐđÐī 17
- 18. ÐÐÐÐÐĒÐÐĪÐÐÐÐĶÐÐŊ 1. Ð ÐĩаКŅÐļŅ Ð―Ð° ŅŅÐŧŅŅаŅŅ: а) Ņ ŅаŅŅÐēÐūŅÐūО ÐąÐ°ŅÐļŅ Ņ ÐŧÐūŅÐļÐīа Ðē ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ КÐļŅÐŧÐūŅŅ Ņ ÐŧÐūŅÐļŅŅÐū- ÐēÐūÐīÐūŅÐūÐīÐ―ÐūÐđ ŅазÐēÐĩÐīÐĩÐ―Ð―ÐūÐđ â ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ÐūŅаÐīÐūК: MgSO4 + BaCl2 â â BaSO4 + MgCl2 ÐĄÐŧаÐđÐī 18
- 19. 2. ÐĄŅÐąŅŅÐ°Ð―ŅÐļŅ ÐīаÐĩŅ ŅÐĩаКŅÐļŅ Ð―Ð° ОаÐģÐ―ÐļÐđ Ņ ŅаŅŅÐēÐūŅÐūО Ð―Ð°ŅŅÐļŅ ÐģÐļÐīŅÐūŅÐūŅŅаŅа â ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ КŅÐļŅŅаÐŧÐŧÐļŅÐĩŅКÐļÐđ ÐūŅаÐīÐūК: MgSO4 + Na2HPO4 + NH3 â â MgNH4PO4â+ Na2SO4 ÐÐĩŅаŅОаКÐūÐŋÐĩÐđÐ―Ð°Ņ ŅÐĩаКŅÐļŅ: ÐÐūÐ― ОаÐģÐ―ÐļŅ Ņ 8-ÐūКŅÐļŅ ÐļÐ―ÐūÐŧÐļÐ―Ð° Ðē ŅŅÐĩÐīÐĩ аООÐļаŅÐ―ÐūÐģÐū ÐąŅŅÐĩŅа ÐūÐąŅазŅÐĩŅ ÐķÐĩÐŧŅÐū-зÐĩÐŧÐĩÐ―ŅÐđ КŅÐļŅŅаÐŧÐŧÐļŅÐĩŅКÐļÐđ ÐūŅаÐīÐūК: N OH + Mg2+ 2 N O N OMg + 2H+ ÐĄÐŧаÐđÐī 19
- 20. OH N N OH O2N O N N O O2N Mg NH4Cl + NH4OH + MgSO4 40ï° ÐĄ; pH 10,0 + 2ÐCl NaO3S NaO3S (MgInd) (H2Ind) ŅÐļÐ―Ņ ŅŅÐūÐŧÐĩŅÐūÐēÐĩ КÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐĩ ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―ÐļÐĩ ÐÐūОÐŋÐŧÐĩКŅÐūÐ―ÐūОÐĩŅŅÐļŅÐĩŅКÐūÐĩ ÐŋŅŅОÐūÐĩ ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ ŅаŅŅÐēÐūŅÐūО Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа Ðē ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ аООÐļаŅÐ―ÐūÐģÐū ÐąŅŅÐĩŅÐ―ÐūÐģÐū ŅаŅŅÐēÐūŅа, ÐļÐ―ÐīÐļКаŅÐūŅ - ÐŋŅÐūŅŅаÐēÐ―ŅÐĩ ŅÐĩŅÐ―ŅÐđ. ÐÐĩŅÐĩŅŅÐĩŅ ÐŋŅÐūÐēÐūÐīŅŅ Ð―Ð° ŅŅŅ ÐūÐĩ ÐēÐĩŅÐĩŅŅÐēÐū. ÐĄÐŧаÐđÐī 20 ŅÐļÐūÐŧÐĩŅÐūÐēÐūÐĩ ŅÐļÐ―ÐĩÐĩ
- 21. CH2 CH2 N N CH2COONa CH2COO CH2COO CH2COONa Mg CH2 CH2 N N CH2COONa CH2COOH CH2COOH CH2COONa MgInd + H2Ind + ŅÐļÐ―Ņ ŅŅÐūÐŧÐĩŅÐūÐēÐĩ CH2 CH2 N N CH2COONa CH2COO CH2COO CH2COONa Mg CH2 CH2 N N CH2COONa CH2COOH CH2COOH CH2COONa Mg2+ + NH4OH NH4Cl + 2H+ s = 1 ÐĄÐŧаÐđÐī 21 ŅÐļÐūÐŧÐĩŅÐūÐēÐūÐĩ ŅÐļÐ―ÐĩÐĩ
- 22. ÐĒÐļŅŅ Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа ÐŋÐū ОаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅŅ ŅаŅŅŅÐļŅŅÐēаŅŅ ÐŋÐū ŅÐūŅОŅÐŧÐĩ: 22 4 4 Na ÐÐÐĒÐ MgSO Na ÐÐÐĒÐ MgSOÐĄÐž Ð .О. s T Ðģ / ОÐŧ 1000 ï ï ï― ÐĄÐŧаÐđÐī 22 ÐģÐīÐĩ: ÐĄÐ â ОÐūÐŧŅŅÐ―Ð°Ņ КÐūÐ―ŅÐĩÐ―ŅŅаŅÐļŅ ŅÐļŅŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū ŅаŅŅÐēÐūŅа, ОÐūÐŧŅ/Ðŧ; Ð.О. â ОÐūÐŧÐĩКŅÐŧŅŅÐ―Ð°Ņ ОаŅŅа ÐļŅŅÐŧÐĩÐīŅÐĩОÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēа, Ðģ/ОÐūÐŧŅ; s â ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―Ð―ÐūÐĩ ÐŋÐū ŅŅаÐēÐ―ÐĩÐ―ÐļŅ ŅÐĩаКŅÐļÐļ ŅŅÐĩŅ ÐļÐūОÐĩŅŅÐļŅÐĩŅКÐūÐĩ ŅÐūÐūŅÐ―ÐūŅÐĩÐ―ÐļÐĩ - КÐūÐŧÐļŅÐĩŅŅÐēÐū ОÐūÐŧÐĩÐđ ÐļŅŅÐŧÐĩÐīŅÐĩОÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēа, ŅÐĩаÐģÐļŅŅŅŅÐĩÐģÐū Ņ ÐūÐīÐ―ÐļО ОÐūÐŧÐĩО ŅÐļŅŅÐ°Ð―Ņа.
- 23. ÐģÐīÐĩ: V - ÐūÐąŅÐĩО 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ Ð, ÐļзŅаŅŅ ÐūÐīÐūÐēÐ°Ð―Ð―ÐūÐģÐū Ð―Ð° ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ ОаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅа, ОÐŧ; Ð - КÐūŅŅŅÐļŅÐļÐĩÐ―Ņ ÐŋÐūÐŋŅаÐēКÐļ К ОÐūÐŧŅŅÐ―ÐūŅŅÐļ 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа; ÐĒ - ŅÐļŅŅ 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа за ОаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅÐūО, ОÐģ / ОÐŧ; m - ОаŅŅа Ð―Ð°ÐēÐĩŅКÐļ ОаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅа, Ðģ; VО.К. - ÐÐąŅÐĩО ОÐĩŅÐ―ÐūÐđ КÐūÐŧÐąŅ, ОÐŧ; V Ðŋ. - ÐÐąŅÐĩО ÐŋÐļÐŋÐĩŅКÐļ, ОÐŧ РаŅŅÐĩŅ КÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐģÐū ŅÐūÐīÐĩŅÐķÐ°Ð―ÐļŅ ОаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅа Ðē ÐŋŅÐūŅÐĩÐ―ŅаŅ ÐŋŅÐūÐēÐūÐīŅŅ ÐŋÐū ŅÐūŅОŅÐŧÐĩ: 23 4 100 100 100 NaÐÐÐĒРОК Ðŋ ÐēÐūÐŧ V K T V X(%)MgSO m V ( % ) ï ï ï ï ï ï― ï ï ï ÐĄÐŧаÐđÐī 23 ÐēÐŧ.
- 24. 24 ÐĨŅÐ°Ð―ÐĩÐ―ÐļÐĩ. Ð Ņ ÐūŅÐūŅÐū заКŅÐŋÐūŅÐĩÐ―Ð―ÐūÐđ ŅаŅÐĩ (ŅŅÐūÐąŅ ÐŋŅÐĩÐīÐūŅÐēŅаŅÐļŅŅ ÐēŅÐēÐĩŅŅÐļÐēÐ°Ð―ÐļŅ). ÐŅÐļОÐĩÐ―ÐĩÐ―ÐļÐĩ. ÐĢŅÐŋÐūКаÐļÐēаŅŅÐĩÐĩ, ŅÐŋазОÐūÐŧÐļŅÐļŅÐĩŅКÐūÐĩ, ŅÐŧÐ°ÐąÐļŅÐĩÐŧŅÐ―ÐūÐĩ ŅŅÐĩÐīŅŅÐēÐū. ÐÐĩÐđŅŅÐēÐļÐĩ заÐēÐļŅÐļŅ ÐūŅ ŅÐŋÐūŅÐūÐąÐ° ÐēÐēÐĩÐīÐĩÐ―ÐļŅ Ðļ ÐīÐūзŅ. ÐŅÐļ ÐūŅŅаÐēÐŧÐĩÐ―ÐļÐļ ОаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅÐūО КаК Ð°Ð―ŅÐļÐīÐūŅ ÐļŅÐŋÐūÐŧŅзŅŅŅ ŅÐūÐŧÐļ КаÐŧŅŅÐļŅ. ÐĄÐŧаÐđÐī 24
- 25. ÐÐÐÐÐÐŊ ÐÐÐ ÐÐÐÐÐĒ ÐĒÐŊÐÐÐÐŦÐ ÐÐÐÐÐÐŊ ÐÐÐ ÐÐÐÐÐĒ ÐÐÐÐÐÐ Magnesii subcarbonas ponderosus Magnesii subcarbonas levis MAGNESIUM CARBONATE, HEAVY MAGNESIUM CARBONATE, LIGHT 3MgCO3 · Mg(OH)2 · 3H2O (ÐÐĪÐĢ) ÐÐūÐŧŅŅÐĩÐ―ÐļÐĩ: ÐĄÐēÐūÐđŅŅÐēа. ïž ÐÐūŅÐūŅКÐļ ÐąÐĩÐŧÐūÐģÐū ŅÐēÐĩŅа. ïž ÐŅаКŅÐļŅÐĩŅКÐļ Ð―ÐĩŅаŅŅÐēÐūŅÐļОŅ Ðē ÐēÐūÐīÐĩ. ïž Ð Ð°ŅŅÐēÐūŅŅŅŅŅŅ Ðē ŅÐ°Ð·ÐąÐ°ÐēÐŧÐĩÐ―Ð―ŅŅ КÐļŅÐŧÐūŅаŅ Ņ ÐąŅŅÐ―ŅО ÐēŅÐīÐĩÐŧÐĩÐ―ÐļÐĩО ÐŋŅзŅŅŅКÐūÐē Ðģаза. 4MgSO4 + 4Na2CO3 + 4H2O â â 3MgCO3 · Mg(OH)2 · 3H2Oâ + 4Na2SO4 + CO2â ÐĄÐŧаÐđÐī 25
- 26. ÐÐÐÐÐĒÐÐĪÐÐÐÐĶÐÐŊ 1. ÐаŅŅÐŋÐ―ÐūÐđ ÐūÐąŅÐĩО ОаÐģÐ―ÐļŅ КаŅÐąÐūÐ―Ð°Ņа ŅŅÐķÐĩÐŧÐūÐģÐū ÐīÐūÐŧÐķÐĩÐ― ÐąŅŅŅ ÐūКÐūÐŧÐū 30 ОÐŧ. ÐаŅŅÐŋÐ―ÐūÐđ ÐūÐąŅÐĩО ОаÐģÐ―ÐļŅ КаŅÐąÐūÐ―Ð°Ņа ÐŧÐĩÐģКÐūÐģÐū ÐīÐūÐŧÐķÐĩÐ― ÐąŅŅŅ ÐūКÐūÐŧÐū 180 ОÐŧ. 2. ÐĄŅÐąŅŅÐ°Ð―ŅÐļŅ ÐīаÐĩŅ ŅÐĩаКŅÐļŅ Ð―Ð° КаŅÐąÐūÐ―Ð°ŅŅ: а) ÐŋŅÐļ + КÐļŅÐŧÐūŅŅ ŅКŅŅŅÐ―ÐūÐđ ŅазÐēÐĩÐīÐĩÐ―Ð―ÐūÐđ â Ð―Ð°ÐąÐŧŅÐīаÐĩŅŅŅ ÐąŅŅÐ―ÐūÐĩ ÐēŅÐīÐĩÐŧÐĩÐ―ÐļÐĩ ÐŋŅзŅŅŅКÐūÐē Ðģаза ÐąÐĩз ŅÐēÐĩŅа Ðļ заÐŋаŅ а. ÐŅÐļ ÐīаÐŧŅÐ―ÐĩÐđŅÐĩО Ð―Ð°ÐģŅÐĩÐēÐ°Ð―ÐļÐļ Ðļ ÐŋŅÐūÐŋŅŅÐšÐ°Ð―ÐļÐļ Ðģаза, ÐēŅÐīÐĩÐŧŅŅŅÐĩÐģÐūŅŅ ŅÐĩŅÐĩз ŅаŅŅÐēÐūŅ ÐąÐ°ŅÐļŅ ÐģÐļÐīŅÐūКŅÐļÐīа â ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ÐūŅаÐīÐūК, ŅаŅŅÐēÐūŅŅŅŅÐļÐđŅŅ ÐŋŅÐļ ÐīÐūÐąÐ°ÐēÐŧÐĩÐ―ÐļÐļ ÐļÐ·ÐąŅŅКа КÐļŅÐŧÐūŅŅ Ņ ÐŧÐūŅÐļŅŅÐūÐēÐūÐīÐūŅÐūÐīÐ―ÐūÐđ. CO3 2- + 2CH3COOH ïŪ CO2ï + 2CH3COO- + H2O CO2 + Ba(OH)2 ïŪ BaCO3ïŊ + H2O BaCO3 + 2HCl ïŪ BaCl2 + CO2ï + H2O ÐĄÐŧаÐđÐī 26
- 27. C. ÐĄŅÐąŅŅÐ°Ð―ŅÐļŅ ŅаŅŅÐēÐūŅŅŅŅ Ðē КÐļŅÐŧÐūŅÐĩ азÐūŅÐ―ÐūÐđ ŅазÐēÐĩÐīÐĩÐ―Ð―ÐūÐđ Ðļ Ð―ÐĩÐđŅŅаÐŧÐļзŅŅŅ ŅаŅŅÐēÐūŅÐūО Ð―Ð°ŅŅÐļŅ ÐģÐļÐīŅÐūКŅÐļÐīа Ņ., ÐаÐŧÐĩÐĩ ÐŋŅÐūÐēÐūÐīŅŅ ÐļŅÐŋŅŅÐ°Ð―ÐļÐĩ Ð―Ð° ОаÐģÐ―ÐļÐđ: b) Ņ Ð―Ð°ŅŅŅÐĩÐ―Ð―ŅО ŅаŅŅÐēÐūŅÐūО ОаÐģÐ―ÐļŅ ŅŅÐŧŅŅаŅа - ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ÐūŅаÐīÐūК (ÐūŅÐŧÐļŅÐļÐĩ ÐūŅ ÐģÐļÐīŅÐūКаŅÐąÐūÐ―Ð°ŅÐūÐē, ŅаŅŅÐēÐūŅŅ КÐūŅÐūŅŅŅ ÐūÐąŅазŅŅŅ ÐūŅаÐīÐūК ŅÐūÐŧŅКÐū ÐŋŅÐļ КÐļÐŋŅŅÐĩÐ―ÐļÐļ ŅОÐĩŅÐļ). 4CO3 2- + 4MgSO4 + 4H2O 3MgCO3 ïï Mg(OH)2 ïï 3H2OïŊï + 4SO4 2- + CO2ï Ņ) Ņ ŅаŅŅÐēÐūŅÐūО ŅÐĩÐ―ÐūÐŧŅŅаÐŧÐĩÐļÐ―Ð° - ÐŋÐūŅÐēÐŧŅÐĩŅŅŅ КŅаŅÐ―ÐūÐĩ ÐūКŅаŅÐļÐēÐ°Ð―ÐļÐĩ (ÐūŅÐŧÐļŅÐļÐĩ ÐūŅ ÐģÐļÐīŅÐūКаŅÐąÐūÐ―Ð°ŅÐūÐē, ŅаŅŅÐēÐūŅŅ КÐūŅÐūŅŅŅ ÐūŅŅаŅŅŅŅ ÐąÐĩŅŅÐēÐĩŅÐ―ŅОÐļ). MgCO3 + 2H+ Mg2+ + CO2ï + H2O MgCl2 + Na2HPO4 + NH3 MgNH4PO4ïŊ + 2NaCl ÐĄÐŧаÐđÐī 27
- 28. ÐÐÐÐЧÐÐĄÐĒÐÐÐÐÐÐ ÐÐÐ ÐÐÐÐÐÐÐÐ ÐÐūОÐŋÐŧÐĩКŅÐūÐ―ÐūОÐĩŅŅÐļŅ, ÐŋŅŅОÐūÐĩ ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ ÐŋÐūŅÐŧÐĩ ŅаŅŅÐēÐūŅÐĩÐ―ÐļŅ Ðē КÐļŅÐŧÐūŅÐĩ Ņ ÐŧÐūŅÐļŅŅÐūÐēÐūÐīÐūŅÐūÐīÐ―ÐūÐđ. РаŅŅÐĩŅ ÐēÐĩÐīŅŅ Ð―Ð° ОаÐģÐ―ÐļŅ ÐūКŅÐļÐī (40â45 %). s = 1 CH2 CH2 N N CH2COONa CH2COOH CH2COOH CH2COONa O N N O O2N Mg NaO3S H2OH2O + CH2 CH2 N N CH2COONa CH2COO CH2COO CH2COONa Mg CH2 CH2 N N CH2COONa CH2COOH CH2COOH CH2COONa Mg2+ + NH4OH NH4Cl + 2H+ ŅÐļÐūÐŧÐĩŅÐūÐēÐūÐĩ 3MgCO3 â Mg(OH)2 â 3H2O + 8HCl â 4MgCl2 + 3CO2â + 8H2O ÐĄÐŧаÐđÐī 28
- 29. CH2 CH2 N N CH2COONa CH2COO CH2COO CH2COONa Mg + 2H+ OH N N OH O2N NaO3S + ОÐŧ/Ðģ .О.ÐÐĄÐž T gÐĄOÐÐÐĒÐNa gÐĄO ÐÐÐĒÐNa 1000 sM M ïï ï― 3 3 m TKV %X NaÐÐÐĒÐ 100ïïï ï― ÐĨŅÐ°Ð―ÐĩÐ―ÐļÐĩ. РзаКŅÐŋÐūŅÐĩÐ―Ð―ÐūÐđ ŅаŅÐĩ. ÐŅÐļОÐĩÐ―ÐĩÐ―ÐļÐĩ. ÐŅÐķŅŅÐĩÐĩ Ðļ Ð°Ð―Ð°ŅÐļÐīÐ―ŅÐđ ŅŅÐĩÐīŅŅÐēÐū. ÐĄÐŧаÐđÐī 29
- 30. ÐŅКаŅŅŅКŅ ŅÐĩŅÐūÐēÐļÐ―Ðļ, ŅКŅ ОŅŅŅŅŅŅ КаÐŧŅŅŅÐđ ÐÐÐÐŽÐĶÐÐŊ ÐĨÐÐÐ ÐÐ ÐÐÐÐĄÐÐÐÐÐ ÐÐĒ(ÐÐĪÐĢ) Calcii chloridum hexahydricum CALCIUM CHLORIDE HEXAHYDRATE CaCl2 · 6H2O M.О. 219.1 ÐаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐī ÐģÐĩКŅаÐģÐļÐīŅаŅ ŅÐūÐīÐĩŅÐķÐļŅ Ð―Ðĩ ОÐĩÐ―ÐĩÐĩ 97.0% Ðļ Ð―Ðĩ ÐąÐūÐŧÐĩÐĩ 103.0 % ÐĄÐ°ÐĄ12 · 6Ð2Ð ÐÐÐÐŽÐĶÐÐŊ ÐĨÐÐÐ ÐÐ ÐÐÐÐÐÐ ÐÐĒ(ÐÐĪÐĢ) Calcii chloridum dihydricum CALCIUM CHLORIDE DIHYDRATE CaCl2 · 2H2O M.О. 147.0 ÐаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐī ÐīÐļÐģÐļÐīŅаŅ ŅÐūÐīÐĩŅÐķÐļŅ Ð―Ðĩ ОÐĩÐ―ÐĩÐĩ 97.0% Ðļ Ð―Ðĩ ÐąÐūÐŧÐĩÐĩ 103.0 % ÐĄÐ°ÐĄ12 · 2Ð2Ð ÐĄÐŧаÐđÐī 30
- 31. ÐÐÐÐÐĒÐÐĪÐÐÐÐĶÐÐŊ A. ŅÐĩаКŅÐļŅ (а) Ð―Ð° Ņ ÐŧÐūŅÐļÐīŅ - Ņ ŅаŅŅÐēÐūŅÐūО ŅÐĩŅÐĩÐąŅа Ð―ÐļŅŅаŅа - ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ŅÐēÐūŅÐūÐķÐļŅŅŅÐđ ÐūŅаÐīÐūК: B. ÐĄŅÐąŅŅÐ°Ð―ŅÐļŅ ÐīаÐĩŅ ŅÐĩаКŅÐļÐļ КаÐŧŅŅÐļÐđ: a) Ņ ŅаŅŅÐēÐūŅÐūО ÐģÐŧÐļÐūКŅаÐŧŅÐģÐļÐīŅÐūКŅÐļÐ°Ð―ÐļÐŧŅ Ðē ŅÐŋÐļŅŅÐĩ Ðē ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ Ņ ÐŧÐūŅÐūŅÐūŅОа â Ņ ÐŧÐūŅÐūŅÐūŅÐžÐ―ŅÐđ ŅÐŧÐūÐđ ÐŋŅÐļÐūÐąŅÐĩŅаÐĩŅ КŅаŅÐ―ŅŅ ÐūКŅаŅКŅ : CaCl2 + + 2HCl CHCl3 C H C H N N CaO O C H C H N N OH HO CaCl2 + 2AgNO3 ïŪ 2AgClïŊ + Ca(NO3)2 AgCl + 2NH4OH ïŪ [Ag(NH3)2]Cl + 2H2O ÐĄÐŧаÐđÐī 31
- 32. c) Ņ ŅаŅŅÐēÐūŅÐūО аООÐūÐ―ÐļŅ ÐūКŅаÐŧаŅа - ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ÐūŅаÐīÐūК: d) ÐĄÐūÐŧŅ КаÐŧŅŅÐļŅ, ŅОÐūŅÐĩÐ―Ð―Ð°Ņ КÐļŅÐŧÐūŅÐūÐđ Ņ ÐŧÐūŅÐļŅŅÐūÐēÐūÐīÐūŅÐūÐīÐ―ÐūÐđ Ðļ ÐēÐ―ÐĩŅÐĩÐ―Ð° Ðē ÐąÐĩŅŅÐēÐĩŅÐ―ÐūÐĩ ÐŋÐŧаОŅ, ÐūКŅаŅÐļÐēаÐĩŅ ÐĩÐģÐū Ðē ÐūŅÐ°Ð―ÐķÐĩÐēÐū-КŅаŅÐ―ŅÐđ ŅÐēÐĩŅ. CaCl2 + (NH4)2C2O4 ïŪ ïŪ CaC2O4ïŊ + 2NH4Cl ÐĄÐŧаÐđÐī 32
- 33. ÐÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐĩ ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―ÐļÐĩ ÐÐūОÐŋÐŧÐĩКŅÐūÐ―ÐūОÐĩŅŅÐļŅÐĩŅКÐūÐĩ ÐŋŅŅОÐūÐĩ ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ ŅаŅŅÐēÐūŅÐūО Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа, Ðē ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ÐģÐļÐīŅÐūКŅÐļÐīа КÐūÐ―ŅÐĩÐ―ŅŅÐļŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū. ÐÐ―ÐīÐļКаŅÐūŅ - ÐļÐ―ÐīÐļКаŅÐūŅÐ―Ð°Ņ ŅОÐĩŅŅ КаÐŧŅКÐūÐ―ÐšÐ°ŅÐąÐūÐ―ÐūÐēÐūÐđ КÐļŅÐŧÐūŅŅ: s = 1 N N OHHOOC HO SO3H Ca2+ + N N ONaOOC O SO3Na Ca H2O OH2 NaOH -2H+ 2H2O CH2 CH2 N N CH2COONa CH2COO CH2COO CH2COONa Ca CH2 CH2 N N CH2COONa CH2COOH CH2COOH CH2COONa Ca2+ + NaOH + 2H+ ÐĄÐŧаÐđÐī 33
- 34. ŅÐļŅŅŅŅŅ ÐūŅ ŅÐļÐūÐŧÐĩŅÐūÐēÐūÐģÐū ÐīÐū ŅÐļÐ―ÐĩÐģÐū ÐūКŅаŅÐļÐēÐ°Ð―ÐļŅ CH2 CH2 N N CH2COONa CH2COO CH2COO CH2COONa Ca CH2 CH2 N N CH2COONa CH2COOH CH2COOH CH2COONa NaOH CaInd + + H2Ind ÐĄÐŧаÐđÐī 34
- 35. ÐĒÐļŅŅ Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа ÐŋÐū КаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐīŅ ŅаŅŅŅÐļŅŅÐēаŅŅ ÐŋÐū ŅÐūŅОŅÐŧÐĩ: 35 2 2 Na ÐÐÐĒÐ CaCl Na ÐÐÐĒÐ CaClÐĄÐž Ð .О. s T Ðģ / ОÐŧ 1000 ï ï ï― ÐĄÐŧаÐđÐī 35 ÐģÐīÐĩ: ÐĄÐ â ОÐūÐŧŅŅÐ―Ð°Ņ КÐūÐ―ŅÐĩÐ―ŅŅаŅÐļŅ ŅÐļŅŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū ŅаŅŅÐēÐūŅа, ОÐūÐŧŅ/Ðŧ; Ð.О. â ОÐūÐŧÐĩКŅÐŧŅŅÐ―Ð°Ņ ОаŅŅа ÐļŅŅÐŧÐĩÐīŅÐĩОÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēа, Ðģ/ОÐūÐŧŅ; s â ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―Ð―ÐūÐĩ ÐŋÐū ŅŅаÐēÐ―ÐĩÐ―ÐļŅ ŅÐĩаКŅÐļÐļ ŅŅÐĩŅ ÐļÐūОÐĩŅŅÐļŅÐĩŅКÐūÐĩ ŅÐūÐūŅÐ―ÐūŅÐĩÐ―ÐļÐĩ - КÐūÐŧÐļŅÐĩŅŅÐēÐū ОÐūÐŧÐĩÐđ ÐļŅŅÐŧÐĩÐīŅÐĩОÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēа, ŅÐĩаÐģÐļŅŅŅŅÐĩÐģÐū Ņ ÐūÐīÐ―ÐļО ОÐūÐŧÐĩО ŅÐļŅŅÐ°Ð―Ņа.
- 36. ÐģÐīÐĩ: V - ÐūÐąŅÐĩО 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа, ÐļзŅаŅŅ ÐūÐīÐūÐēÐ°Ð―Ð―ÐūÐģÐū Ð―Ð° ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ КаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐīа, ОÐŧ; Ð - КÐūŅŅŅÐļŅÐļÐĩÐ―Ņ ÐŋÐūÐŋŅаÐēКÐļ К ОÐūÐŧŅŅÐ―ÐūŅŅÐļ 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа; ÐĒ - ŅÐļŅŅ 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа за КаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐīа, ОÐģ / ОÐŧ; m - ОаŅŅа Ð―Ð°ÐēÐĩŅКÐļ КаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐīа, Ðģ. Ð ÐūзŅаŅ ŅÐ―ÐūК КŅÐŧŅКŅŅÐ―ÐūÐģÐū ÐēОŅŅŅŅ ОаÐģÐ―ŅŅ ÐūКŅÐļÐīŅ Ņ ÐēŅÐīŅÐūŅКаŅ ÐŋŅÐūÐēÐūÐīŅŅŅ за ŅÐūŅОŅÐŧÐūŅ: 36 2 100ï ï ï ï― NaÐÐÐĒÐ Ð― V Ð ÐĒ X(%)ÐĄaCl m ÐĄÐŧаÐđÐī 36
- 37. ÐĨŅÐ°Ð―ÐĩÐ―ÐļÐĩ. Ð ÐŋÐŧÐūŅÐ―Ðū заКŅÐŋÐūŅÐĩÐ―Ð―ÐūÐđ ŅаŅÐĩ Ņ ÐŋаŅаŅÐļÐ―ÐļŅÐūÐēÐ°Ð―Ð―ÐūÐđ ÐŋŅÐūÐąÐšÐ°ÐžÐļ Ðē ŅŅŅ ÐūО ОÐĩŅŅÐĩ. ÐÐūŅКÐūÐŧŅКŅ КаÐŧŅŅÐļŅ Ņ ÐŧÐūŅÐļÐī ŅŅÐĩзÐēŅŅаÐđÐ―Ðū ÐģÐļÐģŅÐūŅКÐūÐŋÐļŅÐĩÐ― Ðļ ÐŋÐūÐī ÐīÐĩÐđŅŅÐēÐļÐĩО ÐēÐŧаÐģÐļ ŅаŅŅÐĩÐļÐēаÐĩŅŅŅ ŅÐĩКÐūОÐĩÐ―ÐīŅÐĩŅŅŅ ŅÐ―Ð°ŅаÐŧа ÐģÐūŅÐūÐēÐļŅŅ 50%-Ð―ŅÐđ ŅаŅŅÐēÐūŅ Ðļ ÐļŅÐŋÐūÐŧŅзÐūÐēаŅŅ ÐĩÐģÐū ÐīÐŧŅ ÐŋŅÐļÐģÐūŅÐūÐēÐŧÐĩÐ―ÐļŅ ÐŧÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅŅ ŅÐūŅО. ÐŅÐļОÐĩÐ―ÐĩÐ―ÐļÐĩ. ÐŅÐļ ŅŅÐļÐŧÐĩÐ―Ð―ÐūО ÐēŅÐēÐĩÐīÐĩÐ―ÐļÐļ КаÐŧŅŅÐļŅ Ðļз ÐūŅÐģÐ°Ð―ÐļзОа, ÐŋŅÐļ аÐŧÐŧÐĩŅÐģÐļŅÐĩŅКÐļŅ Ð·Ð°ÐąÐūÐŧÐĩÐēÐ°Ð―ÐļŅŅ ÐēОÐĩŅŅÐĩ Ņ ÐŋŅÐūŅÐļÐēÐūÐģÐļŅŅаОÐļÐ―Ð―ŅОÐļ ÐēÐĩŅÐĩŅŅÐēаОÐļ, КаК ŅŅÐĩÐīŅŅÐēÐū, ŅОÐĩÐ―ŅŅаÐĩŅ ÐŋŅÐūÐ―ÐļŅаÐĩОÐūŅŅŅ ŅÐūŅŅÐīÐūÐē, КаК КŅÐūÐēÐūÐūŅŅÐ°Ð―Ð°ÐēÐŧÐļÐēаŅŅÐĩÐĩ ŅŅÐĩÐīŅŅÐēÐū, КаК Ð°Ð―ŅÐļÐīÐūŅ ÐŋŅÐļ ÐūŅŅаÐēÐŧÐĩÐ―ÐļÐļ ŅÐūÐŧŅОÐļ ОаÐģÐ―ÐļŅ. ÐĄÐŧаÐđÐī 37
- 38. ÐĶÐÐÐÐ ÐĄÐĢÐÐŽÐĪÐÐĒ ÐÐÐÐĒÐÐÐÐÐ ÐÐĒ(ÐÐĪÐĢ) Zinci sulfas heptahydricus ZINC SULPHATE HEPTAHYDRATE ÐĶÐļÐ―ÐšÐ° ŅŅÐŧŅŅаŅ ŅÐūÐīÐĩŅÐķÐļŅ Ð―Ðĩ ОÐĩÐ―ÐĩÐĩ 99.0% Ðļ Ð―Ðĩ ÐąÐūÐŧÐĩÐĩ 104.0% ZnSO4 · 7H2O ZnSO4·7H2O M.О. 287.5 ÐÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅÐĩ ÐēÐĩŅÐĩŅŅÐēа, КÐūŅÐūŅŅÐĩ ŅÐūÐīÐĩŅÐķаŅ ŅÐļÐ―Ðš ÐĄÐŧаÐđÐī 38
- 39. ÐÐÐÐÐĒÐÐĪÐÐÐÐĶÐÐŊ 1. Ð ÐĩаКŅÐļŅ Ð―Ð° ŅŅÐŧŅŅаŅŅ: а) Ņ ŅаŅŅÐēÐūŅÐūО ÐąÐ°ŅÐļŅ Ņ ÐŧÐūŅÐļÐīа Ðē ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ КÐļŅÐŧÐūŅŅ ŅÐūÐŧŅÐ―ÐūÐđ ŅазÐēÐĩÐīÐĩÐ―Ð―ÐūÐđ â ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ÐūŅаÐīÐūК: SO4 2- + BaCl2 â â BaSO4â + 2Clâ ÐĄÐŧаÐđÐī 39
- 40. 2. ÐĄŅÐąŅŅÐ°Ð―ŅÐļŅ ÐīаÐĩŅ ŅÐĩаКŅÐļÐļ Ð―Ð° ŅÐļÐ―Ðš: а) Ņ ŅаŅŅÐēÐūŅÐūО Ð―Ð°ŅŅÐļŅ ÐģÐļÐīŅÐūКŅÐļÐīа КÐūÐ―ŅÐĩÐ―ŅŅÐļŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū; ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ÐūŅаÐīÐūК: ŅаŅŅÐēÐūŅÐļОŅÐđ Ðē ÐļÐ·ÐąŅŅКÐĩ ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ÐģÐļÐīŅÐūКŅÐļÐīа КÐūÐ―ŅÐĩÐ―ŅŅÐļŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū: b) Ņ ŅаŅŅÐēÐūŅÐūО КаÐŧÐļŅ ŅÐĩŅŅÐūŅÐļÐ°Ð―ÐļÐīа; ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ÐūŅаÐīÐūК: Zn2+ +2NaOH ïŪ Zn(OH)2ïŊ + 2Na+ Zn(OH)2 + 2NaOH ïŪ Na2ZnO2 + 2H2O Zn2+ + K4[Fe(CN)6] ïŪ K2Zn[Fe(CN)6]ïŊ + 2K+ ÐĄÐŧаÐđÐī 40
- 41. ÐÐÐÐЧÐÐĄÐĒÐÐÐÐÐÐ ÐÐÐ ÐÐÐÐÐÐÐÐŊ ÐÐūОÐŋÐŧÐĩКŅÐūОÐĩŅŅÐļŅÐĩŅКÐūÐĩ ÐŋŅŅОÐūÐĩ ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ ŅаŅŅÐēÐūŅÐūО Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа, Ðē ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ ÐģÐĩКŅаОÐĩŅÐļÐŧÐĩÐ―ŅÐĩŅŅаОÐļÐ―Ð° Ðļ ÐļÐ―ÐīÐļКаŅÐūŅÐ―ÐūÐđ ŅОÐĩŅÐļ КŅÐļÐŧÐĩÐ―ÐūÐŧÐūÐēÐūÐģÐū ÐūŅÐ°Ð―ÐķÐĩÐēÐūÐģÐū. ÐĒÐļŅŅŅÐĩО К ÐŋÐĩŅÐĩŅ ÐūÐīŅ ŅÐļÐūÐŧÐĩŅÐūÐēÐū - ŅÐūзÐūÐēÐūÐđ ÐūКŅаŅКÐļ Ðē ÐķÐĩÐŧŅŅÐđ. (CH2)6N4Zn2+ CH3 OH CH2 CH2 OCH3 SO3H N CH2COOH CH2COO N CH2COO CH2COOH Zn CH3 OH CH2 CH2 OCH3 SO3H N CH2COOH CH2COOH N CH2COOH CH2COOH + H2Ind ÐķÐūÐēŅÐĩ ZnInd ŅŅÐūÐŧÐĩŅÐūÐēÐū-ŅÐūÐķÐĩÐēÐĩ ÐĄÐŧаÐđÐī 41 ÐķÐĩÐŧŅÐūÐĩ ŅÐļÐūÐŧÐĩŅÐūÐēÐū-ŅÐūзÐūÐēÐūÐĩ
- 42. N CH2COONa CH2COO N CH2COO CH2COONa H2C H2C ZnZn2+ H+ N CH2COONa CH2COOH N CH2COOH CH2COONa H2C H2C + 2+ s = 1 N CH2COONa CH2COOH N CH2COOH CH2COONa H2C H2C ZnInd + N CH2COONa CH2COO N CH2COO CH2COONa H2C H2C Zn H++ 2H2Ind + ÐĄÐŧаÐđÐī 42
- 43. ÐĒÐļŅŅ Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа ÐŋÐū ŅÐļÐ―ÐšÐ° ŅŅÐŧŅŅаŅŅ ŅаŅŅŅÐļŅŅÐēаŅŅ ÐŋÐū ŅÐūŅОŅÐŧÐĩ: 43 Na ÐÐÐĒÐ/ ZnSO Na ÐÐÐĒÐ ZnSOÐĄÐž s ÐО T Ðģ / ОÐŧ ï ï ï― 4 4 1000 ÐĄÐŧаÐđÐī 43 ÐģÐīÐĩ: ÐĄÐ â ОÐūÐŧŅŅÐ―Ð°Ņ КÐūÐ―ŅÐĩÐ―ŅŅаŅÐļŅ ŅÐļŅŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū ŅаŅŅÐēÐūŅа, ОÐūÐŧŅ/Ðŧ; Ð.О. â ОÐūÐŧÐĩКŅÐŧŅŅÐ―Ð°Ņ ОаŅŅа ÐļŅŅÐŧÐĩÐīŅÐĩОÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēа, Ðģ/ОÐūÐŧŅ; s â ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―Ð―ÐūÐĩ ÐŋÐū ŅŅаÐēÐ―ÐĩÐ―ÐļŅ ŅÐĩаКŅÐļÐļ ŅŅÐĩŅ ÐļÐūОÐĩŅŅÐļŅÐĩŅКÐūÐĩ ŅÐūÐūŅÐ―ÐūŅÐĩÐ―ÐļÐĩ - КÐūÐŧÐļŅÐĩŅŅÐēÐū ОÐūÐŧÐĩÐđ ÐļŅŅÐŧÐĩÐīŅÐĩОÐūÐģÐū ÐēÐĩŅÐĩŅŅÐēа, ŅÐĩаÐģÐļŅŅŅŅÐĩÐģÐū Ņ ÐūÐīÐ―ÐļО ОÐūÐŧÐĩО ŅÐļŅŅÐ°Ð―Ņа.
- 44. ÐģÐīÐĩ: V - ÐūÐąŅÐĩО 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа, ÐļзŅаŅŅ ÐūÐīÐūÐēÐ°Ð―Ð―ÐūÐģÐū Ð―Ð° ŅÐļŅŅÐūÐēÐ°Ð―ÐļÐĩ ŅÐļÐ―ÐšÐ° ŅŅÐŧŅŅаŅа, ОÐŧ; Ð - КÐūŅŅŅÐļŅÐļÐĩÐ―Ņ ÐŋÐūÐŋŅаÐēКÐļ К ОÐūÐŧŅŅÐ―ÐūŅŅÐļ 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа; ÐĒ - ŅÐļŅŅ 0,1 Ð ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ŅÐīÐĩŅаŅа ÐŋÐū ŅÐļÐ―ÐšÐ° ŅŅÐŧŅŅаŅŅ, ОÐģ / ОÐŧ; m - ОаŅŅа Ð―Ð°ÐēÐĩŅКÐļ ŅÐļÐ―ÐšÐ° ŅŅÐŧŅŅаŅа, Ðģ. Ð ÐūзŅаŅ ŅÐ―ÐūК КŅÐŧŅКŅŅÐ―ÐūÐģÐū ÐēОŅŅŅŅ ŅÐļÐ―ÐšŅ ŅŅÐŧŅŅаŅŅ Ņ ÐēŅÐīŅÐūŅКаŅ ÐŋŅÐūÐēÐūÐīŅŅŅ за ŅÐūŅОŅÐŧÐūŅ: 44 ï ï ï ï― Ð― V K T X(%)ZnSO m 4 100 ÐĄÐŧаÐđÐī 44
- 45. ÐĨÐ ÐÐÐÐÐÐ Ð Ð―ÐĩОÐĩŅаÐŧÐŧÐļŅÐĩŅКÐūО ÐēÐūзÐīŅŅ ÐūÐ―ÐĩÐŋŅÐūÐ―ÐļŅаÐĩОÐūО КÐūÐ―ŅÐĩÐđÐ―ÐĩŅÐĩ. ÐŅÐļОÐĩÐ―ÐĩÐ―ÐļÐĩ ÐÐ―ŅÐļŅÐĩÐŋŅÐļК Ðļ ÐīÐĩзÐļÐ―ŅÐļŅÐļŅŅŅŅÐļŅ ŅŅÐĩÐīŅŅÐē, ÐļŅŅÐūŅÐ―ÐļК ОаКŅÐū- Ðļ ОÐļКŅÐūŅÐŧÐĩОÐĩÐ―ŅÐūÐē. ÐŅÐļОÐĩÐ―ÐļО ÐŋŅÐļ: КÐūÐ―ŅŅÐ―ÐšŅÐļÐēÐļŅаŅ , ÐŧаŅÐļÐ―ÐģÐļŅаŅ , ŅŅÐĩŅŅÐļŅаŅ , ÐēаÐģÐļÐ―ÐļŅаŅ - ОÐĩŅŅÐ―Ðū; Ð―ÐĩÐūÐąŅ ÐūÐīÐļОÐūŅŅŅ ÐēŅзŅÐēÐ°Ð―ÐļŅ ŅÐēÐūŅŅ - ÐēÐ―ŅŅŅŅ Ðē ÐēŅŅÐūКÐļŅ ÐīÐūзаŅ ÐīÐĩŅÐļŅÐļŅ ŅÐļÐ―ÐšÐ° Ðē ÐūŅÐģÐ°Ð―ÐļзОÐĩ Ņ Ð―Ð°ŅŅŅÐĩÐ―ÐļŅОÐļ Ð°Ð―Ð°ÐąÐūÐŧÐļŅÐĩŅКÐļŅ , ÐļООŅÐ―ÐūÐŧÐūÐģÐļŅÐĩŅКÐļŅ (ÐŋŅÐūŅÐļÐŧаКŅÐļКа Ðļ ÐŧÐĩŅÐĩÐ―ÐļÐĩ) - ÐēÐ―ŅŅŅŅ; ÐģÐļÐŋÐūÐģÐūÐ―Ð°ÐīÐļзО, ÐģÐ―ÐĩзÐīÐūÐēÐūÐĩ ÐūÐąÐŧŅŅÐĩÐ―ÐļÐĩ, ÐīÐĩŅŅКÐļÐđ ŅÐĩŅÐĩÐąŅаÐŧŅÐ―ŅÐđ ÐŋаŅаÐŧÐļŅ, Ð·Ð°ÐąÐūÐŧÐĩÐēÐ°Ð―ÐļŅ ÐŋÐĩŅÐĩÐ―Ðļ, ŅаŅ аŅÐ―ŅÐđ ÐīÐļÐ°ÐąÐĩŅ, ÐīÐļŅŅŅÐ·Ð―ŅÐĩ Ð·Ð°ÐąÐūÐŧÐĩÐēÐ°Ð―ÐļŅ ŅÐūÐĩÐīÐļÐ―ÐļŅÐĩÐŧŅÐ―ÐūÐđ ŅÐšÐ°Ð―Ðļ Ðļ ÐīŅ. (Ð ŅÐūŅŅаÐēÐĩ КÐūОÐŋÐŧÐĩКŅÐ―ÐūÐđ ŅÐĩŅаÐŋÐļÐļ) - ÐēÐ―ŅŅŅŅ. ÐĄÐŧаÐđÐī 45
- 46. ÐŅÐēÐūÐīŅÐĄÐŧаÐđÐī 46 1. ÐÐ·Ð―Ð°ÐšÐūОÐļÐŧÐļŅŅ Ņ ОÐĩŅÐūÐīаОÐļ ÐŋÐūÐŧŅŅÐĩÐ―ÐļŅ, ÐūŅÐūÐąÐĩÐ―Ð―ÐūŅŅŅОÐļ ŅÐĩаКŅÐļÐđ ÐļÐīÐĩÐ―ŅÐļŅÐļКаŅÐļÐļ Ðļ КÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐģÐū ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―ÐļŅ ÐŧÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅŅ ŅŅÐĩÐīŅŅÐē, ŅÐūÐīÐĩŅÐķаŅÐļŅ ОаÐģÐ―ÐļÐđ. 2. ÐÐ·Ð―Ð°ÐšÐūОÐļÐŧÐļŅŅ Ņ ОÐĩŅÐūÐīаОÐļ ÐŋÐūÐŧŅŅÐĩÐ―ÐļŅ, ÐūŅÐūÐąÐĩÐ―Ð―ÐūŅŅŅОÐļ ŅÐĩаКŅÐļÐđ ÐļÐīÐĩÐ―ŅÐļŅÐļКаŅÐļÐļ Ðļ КÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐģÐū ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―ÐļŅ ÐŧÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅŅ ŅŅÐĩÐīŅŅÐē, ŅÐūÐīÐĩŅÐķаŅÐļŅ КаÐŧŅŅÐļÐđ. 3. ÐÐ·Ð―Ð°ÐšÐūОÐļÐŧÐļŅŅ Ņ ОÐĩŅÐūÐīаОÐļ ÐŋÐūÐŧŅŅÐĩÐ―ÐļŅ, ÐūŅÐūÐąÐĩÐ―Ð―ÐūŅŅŅОÐļ ŅÐĩаКŅÐļÐđ ÐļÐīÐĩÐ―ŅÐļŅÐļКаŅÐļÐļ Ðļ КÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐģÐū ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―ÐļŅ ÐŧÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅŅ ŅŅÐĩÐīŅŅÐē, ŅÐūÐīÐĩŅÐķаŅÐļŅ ÐąÐ°ŅÐļÐđ. 4. ÐÐ·Ð―Ð°ÐšÐūОÐļÐŧÐļŅŅ Ņ ОÐĩŅÐūÐīаОÐļ ÐŋÐūÐŧŅŅÐĩÐ―ÐļŅ, ÐūŅÐūÐąÐĩÐ―Ð―ÐūŅŅŅОÐļ ŅÐĩаКŅÐļÐđ ÐļÐīÐĩÐ―ŅÐļŅÐļКаŅÐļÐļ Ðļ КÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐģÐū ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―ÐļŅ ÐŧÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅŅ ŅŅÐĩÐīŅŅÐē, ŅÐūÐīÐĩŅÐķаŅÐļŅ ŅÐļÐ―Ðš. 5. ÐÐ·Ð―Ð°ÐšÐūОÐļÐŧÐļŅŅ Ņ ОÐĩŅÐūÐīаОÐļ ÐŋÐūÐŧŅŅÐĩÐ―ÐļŅ, ÐūŅÐūÐąÐĩÐ―Ð―ÐūŅŅŅОÐļ ŅÐĩаКŅÐļÐđ ÐļÐīÐĩÐ―ŅÐļŅÐļКаŅÐļÐļ Ðļ КÐūÐŧÐļŅÐĩŅŅÐēÐĩÐ―Ð―ÐūÐģÐū ÐūÐŋŅÐĩÐīÐĩÐŧÐĩÐ―ÐļŅ ÐŧÐĩКаŅŅŅÐēÐĩÐ―Ð―ŅŅ ŅŅÐĩÐīŅŅÐē, ÐÐūŅÐūŅŅÐĩ ŅÐūÐīÐĩŅÐķаŅ ŅŅŅŅŅ.
Editor's Notes
- #13: ÐĪÐūŅОŅÐŧа ŅÐūзŅаŅ ŅÐ―ÐšŅ ÐĒÐļŅŅŅ з ÐŋÐūŅŅÐ―ÐĩÐ―Ð―ŅОÐļ Ð―Ð°ÐēÐĩÐīÐĩÐ―Ð° Ð―Ð° ÐĩКŅÐ°Ð―Ņ.
- #14: ÐĪÐūŅОŅÐŧа ŅÐūзŅаŅ ŅÐ―ÐšŅ КŅÐŧŅКŅŅÐ―ÐūÐģÐū ÐēОŅŅŅŅ КаÐŧŅŅ ÐŋÐĩŅÐžÐ°Ð―ÐģÐ°Ð―Ð°ŅŅ Ņ ÐēŅÐīŅÐūŅКаŅ з ÐŋÐūŅŅÐ―ÐĩÐ―Ð―ŅОÐļ Ð―Ð°ÐēÐĩÐīÐĩÐ―Ð° Ð―Ð° ÐĩКŅÐ°Ð―Ņ.
- #23: ÐĪÐūŅОŅÐŧа ŅÐūзŅаŅ ŅÐ―ÐšŅ ÐĒÐļŅŅŅ з ÐŋÐūŅŅÐ―ÐĩÐ―Ð―ŅОÐļ Ð―Ð°ÐēÐĩÐīÐĩÐ―Ð° Ð―Ð° ÐĩКŅÐ°Ð―Ņ.
- #24: ÐĪÐūŅОŅÐŧа ŅÐūзŅаŅ ŅÐ―ÐšŅ КŅÐŧŅКŅŅÐ―ÐūÐģÐū ÐēОŅŅŅŅ КаÐŧŅŅ ÐŋÐĩŅÐžÐ°Ð―ÐģÐ°Ð―Ð°ŅŅ Ņ ÐēŅÐīŅÐūŅКаŅ з ÐŋÐūŅŅÐ―ÐĩÐ―Ð―ŅОÐļ Ð―Ð°ÐēÐĩÐīÐĩÐ―Ð° Ð―Ð° ÐĩКŅÐ°Ð―Ņ.
- #36: ÐĪÐūŅОŅÐŧа ŅÐūзŅаŅ ŅÐ―ÐšŅ ÐĒÐļŅŅŅ з ÐŋÐūŅŅÐ―ÐĩÐ―Ð―ŅОÐļ Ð―Ð°ÐēÐĩÐīÐĩÐ―Ð° Ð―Ð° ÐĩКŅÐ°Ð―Ņ.
- #37: ÐĪÐūŅОŅÐŧа ŅÐūзŅаŅ ŅÐ―ÐšŅ КŅÐŧŅКŅŅÐ―ÐūÐģÐū ÐēОŅŅŅŅ КаÐŧŅŅ ÐŋÐĩŅÐžÐ°Ð―ÐģÐ°Ð―Ð°ŅŅ Ņ ÐēŅÐīŅÐūŅКаŅ з ÐŋÐūŅŅÐ―ÐĩÐ―Ð―ŅОÐļ Ð―Ð°ÐēÐĩÐīÐĩÐ―Ð° Ð―Ð° ÐĩКŅÐ°Ð―Ņ.
- #44: ÐĪÐūŅОŅÐŧа ŅÐūзŅаŅ ŅÐ―ÐšŅ ÐĒÐļŅŅŅ з ÐŋÐūŅŅÐ―ÐĩÐ―Ð―ŅОÐļ Ð―Ð°ÐēÐĩÐīÐĩÐ―Ð° Ð―Ð° ÐĩКŅÐ°Ð―Ņ.
- #45: ÐĪÐūŅОŅÐŧа ŅÐūзŅаŅ ŅÐ―ÐšŅ КŅÐŧŅКŅŅÐ―ÐūÐģÐū ÐēОŅŅŅŅ КаÐŧŅŅ ÐŋÐĩŅÐžÐ°Ð―ÐģÐ°Ð―Ð°ŅŅ Ņ ÐēŅÐīŅÐūŅКаŅ з ÐŋÐūŅŅÐ―ÐĩÐ―Ð―ŅОÐļ Ð―Ð°ÐēÐĩÐīÐĩÐ―Ð° Ð―Ð° ÐĩКŅÐ°Ð―Ņ.




























![ÐÐÐÐÐĒÐÐĪÐÐÐÐĶÐÐŊ
A. ŅÐĩаКŅÐļŅ (а) Ð―Ð° Ņ
ÐŧÐūŅÐļÐīŅ - Ņ ŅаŅŅÐēÐūŅÐūО ŅÐĩŅÐĩÐąŅа Ð―ÐļŅŅаŅа -
ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ŅÐēÐūŅÐūÐķÐļŅŅŅÐđ ÐūŅаÐīÐūК:
B. ÐĄŅÐąŅŅÐ°Ð―ŅÐļŅ ÐīаÐĩŅ ŅÐĩаКŅÐļÐļ КаÐŧŅŅÐļÐđ:
a) Ņ ŅаŅŅÐēÐūŅÐūО ÐģÐŧÐļÐūКŅаÐŧŅÐģÐļÐīŅÐūКŅÐļÐ°Ð―ÐļÐŧŅ Ðē ŅÐŋÐļŅŅÐĩ Ðē
ÐŋŅÐļŅŅŅŅŅÐēÐļÐļ Ņ
ÐŧÐūŅÐūŅÐūŅОа â Ņ
ÐŧÐūŅÐūŅÐūŅÐžÐ―ŅÐđ ŅÐŧÐūÐđ
ÐŋŅÐļÐūÐąŅÐĩŅаÐĩŅ КŅаŅÐ―ŅŅ ÐūКŅаŅКŅ :
CaCl2 +
+ 2HCl
CHCl3
C
H
C
H
N N
CaO O
C
H
C
H
N N
OH HO
CaCl2 + 2AgNO3 ïŪ 2AgClïŊ + Ca(NO3)2
AgCl + 2NH4OH ïŪ [Ag(NH3)2]Cl + 2H2O
ÐĄÐŧаÐđÐī 31](https://image.slidesharecdn.com/2-150619075552-lva1-app6891/85/2-31-320.jpg)








![2. ÐĄŅÐąŅŅÐ°Ð―ŅÐļŅ ÐīаÐĩŅ ŅÐĩаКŅÐļÐļ Ð―Ð° ŅÐļÐ―Ðš:
а) Ņ ŅаŅŅÐēÐūŅÐūО Ð―Ð°ŅŅÐļŅ ÐģÐļÐīŅÐūКŅÐļÐīа
КÐūÐ―ŅÐĩÐ―ŅŅÐļŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū; ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ ÐūŅаÐīÐūК:
ŅаŅŅÐēÐūŅÐļОŅÐđ Ðē ÐļÐ·ÐąŅŅКÐĩ ŅаŅŅÐēÐūŅа Ð―Ð°ŅŅÐļŅ ÐģÐļÐīŅÐūКŅÐļÐīа
КÐūÐ―ŅÐĩÐ―ŅŅÐļŅÐūÐēÐ°Ð―Ð―ÐūÐģÐū:
b) Ņ ŅаŅŅÐēÐūŅÐūО КаÐŧÐļŅ ŅÐĩŅŅÐūŅÐļÐ°Ð―ÐļÐīа; ÐūÐąŅазŅÐĩŅŅŅ ÐąÐĩÐŧŅÐđ
ÐūŅаÐīÐūК:
Zn2+ +2NaOH ïŪ Zn(OH)2ïŊ + 2Na+
Zn(OH)2 + 2NaOH ïŪ Na2ZnO2 + 2H2O
Zn2+ + K4[Fe(CN)6] ïŪ K2Zn[Fe(CN)6]ïŊ + 2K+
ÐĄÐŧаÐđÐī 40](https://image.slidesharecdn.com/2-150619075552-lva1-app6891/85/2-40-320.jpg)







































































