–њ—А–µ–Ј–µ–љ—В–∞—Ж—Ц—П –і–Њ –µ–Љ–Є 9. –∞—А–Њ–Љ–∞—В–Є—З–љ—Ц –Ї–Є—Б–ї–Њ—В–Є, –Њ–Ї—Б–Є–Ї—Ц—Б–ї–Њ—В–Є, –∞–Љ—Ц–љ–Њ–Ї–Є—Б–ї–Њ—В–Є
- 1. –Ы–Ж–Ъ–Р–†–°–ђ–Ъ–Ж –†–Х–І–Ю–Т–Ш–Э–Ш, –Я–Ю–•–Ж–Ф–Э–Ж –Р–†–Ю–Ь–Р–Ґ–Ш–І–Э–Ш–• –Ъ–Ш–°–Ы–Ю–Ґ, –Ю–Ъ–°–Ш–Ъ–Ш–°–Ы–Ю–Ґ –Ґ–Р –З–• –°–Ю–Ы–Х–Щ, –Р–†–Ю–Ь–Р–Ґ–Ш–І–Э–Ш–• –Р–Ь–Ж–Э–Ю–Ъ–Ш–°–Ы–Ю–Ґ –Ї–∞—Д–µ–і—А–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–љ–Њ—Ч —Е—Ц–Љ—Ц—Ч –Ї–∞—Д–µ–і—А–∞ –Љ–µ–і–Є—З–љ–Њ—Ч —Е—Ц–Љ—Ц—Ч –Р—Б—Б. –У—А–Є–љ–µ–≤–Є—З –Ы.–Ю. –Ф–Њ—Ж. –Р–±—Г –®–∞—А—Е –Р.–Ж. http://medchem.nuph.edu.ua http://pharmchem.nuph.edu.ua
- 2. 1. –Ы—Ц–Ї–∞—А—Б—М–Ї—Ц —А–µ—З–Њ–≤–Є–љ–Є, –њ–Њ—Е—Ц–і–љ—Ц –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –Ї–Є—Б–ї–Њ—В —В–∞ —Ч—Е —Б–Њ–ї–µ–є 1.1. –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –љ–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В—Г 1.2. –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –љ–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В—Г 2. –Ы—Ц–Ї–∞—А—Б—М–Ї—Ц —А–µ—З–Њ–≤–Є–љ–Є, –њ–Њ—Е—Ц–і–љ—Ц –Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В 2.1. –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є 2.2. –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є 2.3. –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є 2.4. –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є 2.5. –Р–љ–∞–ї—Ц–Ј –ї—Ц–Ї–∞—А—Б—М–Ї–Њ—Ч —Д–Њ—А–Љ–Є 3. –Ы—Ц–Ї–∞—А—Б—М–Ї—Ц —А–µ—З–Њ–≤–Є–љ–Є, –њ–Њ—Е—Ц–і–љ—Ц –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –∞–Љ—Ц–љ–Њ–Ї–Є—Б–ї–Њ—В 3.1. –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г 3.2. –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г 3.3. –Р–љ–∞–ї—Ц–Ј –ї—Ц–Ї–∞—А—Б—М–Ї–Њ—Ч —Д–Њ—А–Љ–Є –Я–Ы–Р–Э –Ы–Х–Ъ–¶–Ж–З
- 3. 1. –Р–љ–∞–ї—Ц—В–Є—З–љ–∞ —Е—Ц–Љ—Ц—П : –љ–∞–≤—З. –њ–Њ—Б—Ц–±. / –Ю. –Ь. –У–∞–є–і—Г–Ї–µ–≤–Є—З, –Т. –Т. –С–Њ–ї–Њ—В–Њ–≤, –Ѓ. –Т. –°–Є—З —В–∞ —Ц–љ. вАУ –•. : –Ю—Б–љ–Њ–≤–∞, –Т–Є–і. –Э–§–Р–£, 2000. вАУ 432 —Б. 2. –Р—А–Ј–∞–Љ–∞—Б—Ж–µ–≤, –Р. –Я. –§–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–∞—П —Е–Є–Љ–Є—П : —Г—З–µ–±. –њ–Њ—Б–Њ–±–Є–µ / –њ–Њ–і —А–µ–і. –Р. –Я. –Р—А–Ј–∞–Љ–∞—Б—Ж–µ–≤–∞. вАУ 3-–µ –Є–Ј–і., –Є—Б–њ—А. вАУ –Ь. : –У–≠–Ю–Ґ–Р–†- –Ь–µ–і–Є–∞, 2006. вАУ 640 —Б. 3. –Ф–µ—А–ґ–∞–≤–љ–∞ –§–∞—А–Љ–∞–Ї–Њ–њ–µ—П –£–Ї—А–∞—Ч–љ–Є: –≤ 3 —В. / –Ф–µ—А–ґ. –њ-–≤–Њ –£–Ї—А–∞—Ч–љ—Б—М–Ї–Є–є –љ–∞—Г–Ї–Њ–≤–Є–є —Д–∞—А–Љ–∞–Ї–Њ–њ–µ–є–љ–Є–є —Ж–µ–љ—В—А —П–Ї–Њ—Б—В—Ц –ї—Ц–Ї–∞—А—Б—М–Ї–Є—Е –Ј–∞—Б–Њ–±—Ц–≤вАЭ. вАУ 2вАУ–µ –≤–Є–і. вАУ –•. : –Ф–µ—А–ґ–∞–≤–љ–µ –њ—Ц–і–њ—А–Є—Ф–Љ—Б—В–≤–Њ вАЬ–£–Ї—А–∞—Ч–љ—Б—М–Ї–Є–є –љ–∞—Г–Ї–Њ–≤–Є–є —Д–∞—А–Љ–∞–Ї–Њ–њ–µ–є–љ–Є–є —Ж–µ–љ—В—А —П–Ї–Њ—Б—В—Ц –ї—Ц–Ї–∞—А—Б—М–Ї–Є—Е –Ј–∞—Б–Њ–±—Ц–≤вАЭ, 2015. вАУ –Ґ.1. вАУ 1128 —Б. 4. –Ф–µ—А–ґ–∞–≤–љ–∞ –§–∞—А–Љ–∞–Ї–Њ–њ–µ—П –£–Ї—А–∞—Ч–љ–Є: –≤ 3 —В. / –Ф–µ—А–ґ. –њ-–≤–Њ –£–Ї—А–∞—Ч–љ—Б—М–Ї–Є–є –љ–∞—Г–Ї–Њ–≤–Є–є —Д–∞—А–Љ–∞–Ї–Њ–њ–µ–є–љ–Є–є —Ж–µ–љ—В—А —П–Ї–Њ—Б—В—Ц –ї—Ц–Ї–∞—А—Б—М–Ї–Є—Е –Ј–∞—Б–Њ–±—Ц–≤вАЭ. вАУ 2вАУ–µ –≤–Є–і. вАУ –•. : –Ф–µ—А–ґ–∞–≤–љ–µ –њ—Ц–і–њ—А–Є—Ф–Љ—Б—В–≤–Њ вАЬ–£–Ї—А–∞—Ч–љ—Б—М–Ї–Є–є –љ–∞—Г–Ї–Њ–≤–Є–є —Д–∞—А–Љ–∞–Ї–Њ–њ–µ–є–љ–Є–є —Ж–µ–љ—В—А —П–Ї–Њ—Б—В—Ц –ї—Ц–Ї–∞—А—Б—М–Ї–Є—Е –Ј–∞—Б–Њ–±—Ц–≤вАЭ, 2014. вАУ –Ґ.2. вАУ 724 —Б. 5. –Ф–µ—А–ґ–∞–≤–љ–∞ –§–∞—А–Љ–∞–Ї–Њ–њ–µ—П –£–Ї—А–∞—Ч–љ–Є: –≤ 3 —В. / –Ф–µ—А–ґ. –њ-–≤–Њ –£–Ї—А–∞—Ч–љ—Б—М–Ї–Є–є –љ–∞—Г–Ї–Њ–≤–Є–є —Д–∞—А–Љ–∞–Ї–Њ–њ–µ–є–љ–Є–є —Ж–µ–љ—В—А —П–Ї–Њ—Б—В—Ц –ї—Ц–Ї–∞—А—Б—М–Ї–Є—Е –Ј–∞—Б–Њ–±—Ц–≤вАЭ. вАУ 2вАУ–µ –≤–Є–і. вАУ –•. : –Ф–µ—А–ґ–∞–≤–љ–µ –њ—Ц–і–њ—А–Є—Ф–Љ—Б—В–≤–Њ вАЬ–£–Ї—А–∞—Ч–љ—Б—М–Ї–Є–є –љ–∞—Г–Ї–Њ–≤–Є–є —Д–∞—А–Љ–∞–Ї–Њ–њ–µ–є–љ–Є–є —Ж–µ–љ—В—А —П–Ї–Њ—Б—В—Ц –ї—Ц–Ї–∞—А—Б—М–Ї–Є—Е –Ј–∞—Б–Њ–±—Ц–≤вАЭ, 2014. вАУ –Ґ.3. вАУ 732 —Б. 6. –Ы–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –∞–ї–Є—Д–∞—В–Є—З–µ—Б–Ї–Њ–є –Є –∞—А–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л : –ї–µ–Ї—Ж–Є–Є –њ–Њ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Е–Є–Љ–Є–Є –і–ї—П —Б—В—Г–і–µ–љ—В–Њ–≤ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—Г–ї—М—В–µ—В–Њ–≤ –≤—Л—Б—И–Є—Е —Г—З–µ–±–љ—Л—Е –Ј–∞–≤–µ–і–µ–љ–Є–є III-IV —Г—А–Њ–≤–љ–µ–є –∞–Ї–Ї—А–µ–і–Є—В–∞—Ж–Є–Є / –Ш. –°. –У—А–Є—Ж–µ–љ–Ї–Њ, –°. –У. –Ґ–∞—А–∞–љ, –°. –У. –Ш—Б–∞–µ–≤ –Є –і—А. вАУ X. : –Ш–Ј–і-–≤–Њ –Э–§–∞–£, 2014. вАУ 147 —Б. 7. –§–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–љ–∞ —Е—Ц–Љ—Ц—П : –њ—Ц–і—А—Г—З. –і–ї—П —Б—В—Г–і. –≤–Є—Й. —Д–∞—А–Љ–∞—Ж. –љ–∞–≤—З. –Ј–∞–Ї–ї. —Ц —Д–∞—А–Љ–∞—Ж. —Д-—В—Ц–≤ –≤–Є—Й. –Љ–µ–і. –і–ї—П —Б—В—Г–і. –≤–Є—Й. —Д–∞—А–Љ–∞—Ж. –љ–∞–≤—З. –Ј–∞–Ї–ї. IIIвАУIV —А—Ц–≤–љ—Ц–≤ –∞–Ї—А–µ–і–Є—В–∞—Ж—Ц—Ч / –Ј–∞ –Ј–∞–≥. —А–µ–і. –њ—А–Њ—Д. –Я. –Ю. –С–µ–Ј—Г–≥–ї–Њ–≥–Њ. вИТ 2-–≥–µ –≤–Є–і., –≤–Є–њ—А., –і–Њ–њ. вАУ –Т—Ц–љ–љ–Є—Ж—П : –Э–Њ–≤–∞ –Ъ–љ–Є–≥–∞, 2011. вАУ 560 —Б. 8. –§–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–љ–Є–є –∞–љ–∞–ї—Ц–Ј : –љ–∞–≤—З. –њ–Њ—Б—Ц–±. –і–ї—П —Б—В—Г–і. –≤–Є—Й. —Д–∞—А–Љ–∞—Ж. –љ–∞–≤—З. –Ј–∞–Ї–ї. III IV —А—Ц–≤–љ—Ц–≤ –∞–Ї—А–µ–і–Є—В–∞—Ж—Ц—Ч / –Я.вАС –Ю. –С–µ–Ј—Г–≥–ї–Є–є, –Т. –Ю. –У—А—Г–і—М–Ї–Њ, –°. –У. –Ы–µ–Њ–љ–Њ–≤–∞ —В–∞ —Ц–љ.; –Ј–∞ —А–µ–і. –Я. –Ю. –С–µ–Ј—Г–≥–ї–Њ–≥–Њ. вИТ X. : –Т–Є–і-–≤–Њ –Э–§–Р–£; –Ч–Њ–ї–Њ—В—Ц —Б—В–Њ—А—Ц–љ–Ї–Є, 2001. вАУ 240 —Б. 9. The European Pharmacopea. 7th edition. вАУ Published by the Directorate for the Quality of Medicines&Healthcare of the Council of Europe. вАУ Council of Europe, 6707 Strasbourg Gedex, France. вАУ 2010. –Ы–Ж–Ґ–Х–†–Р–Ґ–£–†–Р
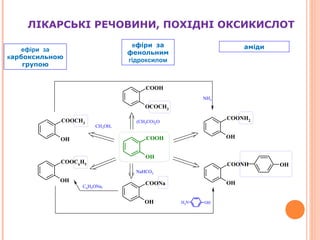
- 4. –Р—А–Њ–Љ–∞—В–Є—З–љ—Ц –Ї–Є—Б–ї–Њ—В–Є вАУ —Ж–µ –њ–Њ—Е—Ц–і–љ—Ц –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –≤—Г–≥–ї–µ–≤–Њ–і–љ—Ц–≤, —Й–Њ –Љ—Ц—Б—В—П—В—М –Њ–і–љ—Г –∞–±–Њ –і–µ–Ї—Ц–ї—М–Ї–∞ –Ї–∞—А–±–Њ–Ї—Б–Є–ї—М–љ—Л—Е –≥—А—Г–њ –Ы—Ц–Ї–∞—А—Б—М–Ї—Ц —А–µ—З–Њ–≤–Є–љ–Є, –њ–Њ—Е—Ц–і–љ—Ц –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –Ї–Є—Б–ї–Њ—В —В–∞ —Ч—Е —Б–Њ–ї–µ–є пВҐ –Ъ–Є—Б–ї–Њ—В–∞ –±–µ–љ–Ј–Њ–є–љ–∞ пВҐ –Э–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В пВҐ –Ъ–Є—Б–ї–Њ—В–∞ —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–∞ пВҐ –Э–∞—В—А—Ц—О —Б–∞–ї—Ц—Ж–Є–ї–∞—В COOH COOH OH COONa OH COONa
- 5. 5 –Ъ–Є—Б–ї–Њ—В–∞ –±–µ–љ–Ј–Њ–є–љ–∞–Ъ–Є—Б–ї–Њ—В–∞ –±–µ–љ–Ј–Њ–є–љ–∞ (Acidum benzoicum)(Acidum benzoicum) –С–µ–љ–Ј–Њ–є–љ–∞ –Ї–Є—Б–ї–Њ—В–∞ –±—Г–ї–∞ –≤—Ц–і–Ї—А–Є—В–∞ —Г 17 —Б—В–Њ–ї—Ц—В—В—Ц —В–∞ –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г–≤–∞–ї–∞—Б—П —Г 19 —Б—В–Њ–ї—Ц—В—В—Ц –і–ї—П –Ї–Њ–љ—Б–µ—А–≤–∞—Ж—Ц—Ч. –Ґ—А–Є–≤–∞–ї–Є–є —З–∞—Б –≤–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г–≤–∞–ї–∞—Б—П —П–Ї –Ј–Њ–≤–љ—Ц—И–љ—Ц–є –∞–љ—В–Є—Б–µ–њ—В–Є—З–љ–Є–є –∞–±–Њ –≤—Ц–і—Е–∞—А–Ї—Г–≤–∞–ї—М–љ–Є–є –Ј–∞—Б—Ц–±. –Т–Є—Е—Ц–і–љ–∞ —А–µ—З–Њ–≤–Є–љ–∞ –≤ —Б–Є–љ—В–µ–Ј—Ц –≤–µ–ї–Є–Ї–Њ—Ч –Ї—Ц–ї—М–Ї–Њ—Б—В—Ц –Њ—А–≥–∞–љ—Ц—З–љ–Є—Е —Б–њ–Њ–ї—Г–Ї. –Ч–∞—Б—В–Њ—Б—Г–≤–∞–љ–љ—П –≤ –Љ–µ–і–Є—Ж–Є–љ—Ц –∞–љ—В–Є–Љ—Ц–Ї—А–Њ–±–љ–µ–∞–љ—В–Є–Љ—Ц–Ї—А–Њ–±–љ–µ++ –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤–µ–њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤–µ –Э–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В–Э–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В (Natrii benzoas)(Natrii benzoas) –Э–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В –Ј–∞—Б—В–Њ—Б–Њ–≤—Г—О—В—М –≤–љ—Г—В—А—Ц—И–љ—М–Њ —П–Ї –≤—Ц–і—Е–∞—А–Ї—Г–≤–∞–ї—М–љ–Є–є –Ј–∞—Б—Ц–± –њ—А–Є –±—А–Њ–љ—Е—Ц—В–∞—Е —В–∞ —Ц–љ—И–Є—Е –Ј–∞—Е–≤–Њ—А—О–≤–∞–љ–љ—П—Е –≤–µ—А—Е–љ—Ц—Е –і–Є—Е–∞–ї—М–љ–Є—Е —И–ї—П—Е—Ц–≤ —Г –њ–Њ—А–Њ—И–Ї–∞—Е —Ц –Љ—Ц–Ї—Б—В—Г—А–∞—Е. –Ъ—А–Є—Б—В–∞–ї—Ц—З–љ–Є–є –∞–±–Њ –≥—А–∞–љ—Г–ї—М–Њ–≤–∞–љ–Є–є –њ–Њ—А–Њ—И–Њ–Ї –∞–±–Њ –њ–ї–∞—Б—В—Ц–≤—Ж—Ц –±—Ц–ї–Њ–≥–Њ –∞–±–Њ –Љ–∞–є–ґ–µ –±—Ц–ї–Њ–≥–Њ –Ї–Њ–ї—М–Њ—А—Г, —Б–ї–∞–±–Ї–Њ –≥—Ц–≥—А–Њ—Б–Ї–Њ–њ—Ц—З–љ–Є–є. –†–Њ–Ј—З–Є–љ–љ—Ц—Б—В—М. –Ы–µ–≥–Ї–Њ —А–Њ–Ј—З–Є–љ–љ–Є–є —Г –≤–Њ–і—Ц –†, –њ–Њ–Љ—Ц—А–љ–Њ —А–Њ–Ј—З–Є–љ–љ–Є–є –≤ –µ—В–∞–љ–Њ–ї—Ц 90% (–Њ–±/–Њ–±) –†. –Т–ї–∞—Б—В–Є–≤–Њ—Б—В—Ц
- 6. COO COO 3 + 2 Fe3+ + 3 H2O 3 Fe . Fe(OH)3 + 3 H+ ethanol - –±–ї—Ц–і–Њ-–ґ–Њ–≤—В–Є–є –Њ—Б–∞–і–±–ї—Ц–і–Њ-–ґ–Њ–≤—В–Є–є –Њ—Б–∞–і –†–µ–∞–Ї—Ж—Ц—Ч –љ–∞ –љ–∞—В—А—Ц–є (–∞) (2.3.1): a) –Ј –Ј–∞–ї—Ц–Ј–∞ (III) —Е–ї–Њ—А–Є–і–Њ–Љ b) –Ј –Ї–Є—Б–ї–Њ—В–Њ—О —Б—Ц—А—З–∞–љ–Њ—О –Ї–Њ–љ—Ж. (—Б—Г–±–ї—Ц–Љ–∞—Ж—Ц—П) c) –Ј –Ї–Є—Б–ї–Њ—В–Њ—О —Е–ї–Њ—А–Є—Б—В–Њ–≤–Њ–і–љ–µ–≤–Њ—О –±—Ц–ї–Є–є —Б—Г–±–ї—Ц–Љ–∞—В –љ–∞ –≤–љ—Г—В—А—Ц—И–љ—Ц—Е–±—Ц–ї–Є–є —Б—Г–±–ї—Ц–Љ–∞—В –љ–∞ –≤–љ—Г—В—А—Ц—И–љ—Ц—Е —Б—В—Ц–љ–Ї–∞—Е –њ—А–Њ–±—Ц—А–Ї–Є—Б—В—Ц–љ–Ї–∞—Е –њ—А–Њ–±—Ц—А–Ї–Є –Ґ–њ–ї–Ґ–њ–ї=120¬∞C to 124¬∞C=120¬∞C to 124¬∞C COO COOH + +HCl Cl - - COO COOHconc. H2SO4 to - –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –љ–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В—Г –†–µ–∞–Ї—Ж—Ц—Ч –љ–∞ –±–µ–љ–Ј–Њ–∞—В–Є(2.3.1): –Ј —А–Њ–Ј—З–Є–љ–Њ–Љ –Ї–∞–ї—Ц—О –њ—Ц—А–Њ–∞–љ—В–Є–Љ–Њ–љ–∞—В—Г –њ—А–Є –љ–∞–≥—А—Ц–≤–∞–љ–љ—Ц —Ц –љ–∞—Б—В—Г–њ–љ–Њ–Љ—Г –Њ—Е–Њ–ї–Њ–і–ґ–µ–љ–љ—Ц —Г—В–≤–Њ—А—О—Ф—В—М—Б—П –±—Ц–ї–Є–є –Њ—Б–∞–і: Na+ + K[Sb(OH)6] вЖТ Na[Sb(OH)6]вЖУ + K+
- 7. 7 –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –љ–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В—Г COONa COOH + +HClO4 NaClO4 CH3COOH %–≤–Њ–ї.)(100m 100100TKV % –љ HClOHClO 44 вИТвЛЕ вЛЕвЛЕвЛЕвЛЕ = ) –Љ–ї –≥( 1000 Msc T –±–µ–љ–Ј–Њ–∞—В—Г)(–љ–∞—В—А—Ц—О)(HClO4 вЛЕвЛЕ = COONa COOH + +HCl NaCl –љm 100TKV % вЛЕвЛЕвЛЕ = HClHCl ) –Љ–ї –≥( 1000 Msc T –±–µ–љ–Ј–Њ–∞—В—Г)(–љ–∞—В—А—Ц—О(HCl) вЛЕвЛЕ = 1. –Р—Ж–Є–і–Є–Љ–µ—В—А—Ц—П –≤ –љ–µ–≤–Њ–і–љ–Њ–Љ—Г —Б–µ—А–µ–і–Њ–≤–Є—Й—Ц, –њ—А—П–Љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П —А–Њ–Ј—З–Є–љ–Њ–Љ –Ї–Є—Б–ї–Њ—В–Є —Е–ї–Њ—А–љ–Њ—Ч, —Ц–љ–і–Є–Ї–∞—В–Њ—А вАУ –љ–∞—Д—В–Њ–ї–±–µ–љ–Ј–µ—Ч–љ, (–Ф–§–£): –Т–Љ—Ц—Б—В –і—Ц—О—З–Њ—Ч —А–µ—З–Њ–≤–Є–љ–Є —Г —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч (–≤ –њ–µ—А–µ—А–∞—Е—Г–љ–Ї—Г –љ–∞ —Б—Г—Е—Г —А–µ—З–Њ–≤–Є–љ—Г), —Г –≤—Ц–і—Б–Њ—В–Ї–∞—Е, —А–Њ–Ј—А–∞—Е–Њ–≤—Г—О—В—М –Ј–∞ —Д–Њ—А–Љ—Г–ї–Њ—О: 2. –Р—Ж–Є–і–Є–Љ–µ—В—А—Ц—П —Г –≤–Њ–і–љ–Њ–Љ—Г —Б–µ—А–µ–і–Њ–≤–Є—Й—Ц, –њ—А—П–Љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П —А–Њ–Ј—З–Є–љ–Њ–Љ –Ї–Є—Б–ї–Њ—В–Є —Е–ї–Њ—А–Є—Б—В–Њ–≤–Њ–і–љ–µ–≤–Њ—Ч –≤ –њ—А–Є—Б—Г—В–љ–Њ—Б—В—Ц –µ—Д—Ц—А—Г (–і–ї—П –≤–Є–ї—Г—З–µ–љ–љ—П –±–µ–љ–Ј–Њ–є–љ–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є), —Ц–љ–і–Є–Ї–∞—В–Њ—А - —Б—Г–Љ—Ц—И –Љ–µ—В–Є–ї–Њ–≤–Њ–≥–Њ –Њ—А–∞–љ–ґ–µ–≤–Њ–≥–Њ —В–∞ –Љ–µ—В–Є–ї–µ–љ–Њ–≤–Њ–≥–Њ —Б–Є–љ—М–Њ–≥–Њ: –Т–Љ—Ц—Б—В –і—Ц—О—З–Њ—Ч —А–µ—З–Њ–≤–Є–љ–Є —Г —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч —Г –≤—Ц–і—Б–Њ—В–Ї–∞—Е —А–Њ–Ј—А–∞—Е–Њ–≤—Г—О—В—М –Ј–∞ —Д–Њ—А–Љ—Г–ї–Њ—О: , –і–µ , –і–µ s = 1 s = 1
- 8. –Ы–Ж–Ъ–Р–†–°–ђ–Ъ–Ж –†–Х–І–Ю–Т–Ш–Э–Ш, –Я–Ю–•–Ж–Ф–Э–Ж –Ю–Ъ–°–Ш–Ъ–Ш–°–Ы–Ю–Ґ COOH OH OH COONa COOH OCOCH3 OH COOCH3 COOC6H5 OH OH COONH2 COONH OH OH OHNH2 (CH3CO)2O NaHCO3 NH3 CH3OH, H2SO4 C6H5ONa, –µ—Д—Ц—А–Є –Ј–∞ –Ї–∞—А–±–Њ–Ї—Б–Є–ї—М–љ–Њ—О –≥—А—Г–њ–Њ—О –µ—Д—Ц—А–Є –Ј–∞ —Д–µ–љ–Њ–ї—М–љ–Є–Љ –≥—Ц–і—А–Њ–Ї—Б–Є–ї–Њ–Љ –∞–Љ—Ц–і–Є
- 9. COOH OH White willow (Salix alba) –њ—А–Є—А–Њ–і–љ–µ –і–ґ–µ—А–µ–ї–Њ —Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є –Ъ–µ—А–∞—В–Њ–ї—Ц—В–Є—З–љ–Є–є —В–∞ –∞–љ—В–Є–±–∞–Ї—В–µ—А—Ц–∞–ї—М–љ–Є–є –Ј–∞—Б—Ц–±, –≤—Е–Њ–і–Є—В—М –і–Њ —Б–Ї–ї–∞–і—Г –њ—А–Њ–і—Г–Ї—В—Ц–≤ –і–ї—П –і–Њ–≥–ї—П–і—Г –Ј–∞ —И–Ї—Ц—А–Њ—О —В–∞ –і–ї—П –ї—Ц–Ї—Г–≤–∞–љ–љ—П —Б–µ–±–Њ—А–µ–є–љ–Њ–≥–Њ –і–µ—А–Љ–∞—В–Є—В—Г, –∞–Ї–љ–µ, –њ—Б–Њ—А—Ц–∞–Ј—Г. –Ч–∞—Б—В–Њ—Б—Г–≤–∞–љ–љ—П –≤ –Љ–µ–і–Є—Ж–Є–љ—Ц –Ъ–Є—Б–ї–Њ—В–∞ —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–∞–Ъ–Є—Б–ї–Њ—В–∞ —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–∞ (Acidum salicylicum)(Acidum salicylicum) –Т–ї–∞—Б—В–Є–≤–Њ—Б—В—Ц –Ъ—А–Є—Б—В–∞–ї—Ц—З–љ–Є–є –њ–Њ—А–Њ—И–Њ–Ї –±—Ц–ї–Њ–≥–Њ –∞–±–Њ –Љ–∞–є–ґ–µ –±—Ц–ї–Њ–≥–Њ –Ї–Њ–ї—М–Њ—А—Г –∞–±–Њ –±—Ц–ї—Ц –∞–±–Њ –±–µ–Ј–±–∞—А–≤–љ—Ц –≥–Њ–ї—З–∞—Б—В—Ц –Ї—А–Є—Б—В–∞–ї–Є –†–Њ–Ј—З–Є–љ–љ—Ц—Б—В—М: –Љ–∞–ї–Њ —А–Њ–Ј—З–Є–љ–љ–∞ —Г –≤–Њ–і—Ц –†, –ї–µ–≥–Ї–Њ —А–Њ–Ј—З–Є–љ–љ–∞ –≤ –µ—В–∞–љ–Њ–ї—Ц (96 %) –†, –њ–Њ–Љ—Ц—А–љ–Њ —А–Њ–Ј—З–Є–љ–љ–∞ –≤ –Љ–µ—В–Є–ї–µ–љ—Е–ї–Њ—А–Є–і—Ц –†.
- 10. –Т–ї–∞—Б—В–Є–≤–Њ—Б—В—Ц –Ч–∞—Б—В–Њ—Б—Г–≤–∞–љ–љ—П –≤ –Љ–µ–і–Є—Ж–Є–љ—Ц COOH O C O CH3 –Т–Є–Ї–Њ—А–Є—Б—В–Њ–≤—Г—Ф—В—М—Б—П —П–Ї –ґ–∞—А–Њ–Ј–љ–Є–ґ—Г—О—З–Є–є, –Ј–љ–µ–±–Њ–ї—О–≤–∞–ї—М–љ–Є–є –Ј–∞—Б—Ц–±, —В–∞–Ї–Њ–ґ –Љ–∞—Ф –њ—А–Њ—В–Є–Ј–∞–њ–∞–ї—М–љ—Г (–Э–Я–Т–Ч) —В–∞ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–љ—Г –і—Ц—О –Р—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–∞ –Ї–Є—Б–ї–Њ—В–∞–Р—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–∞ –Ї–Є—Б–ї–Њ—В–∞ (Acidum acetylsalicylicum)(Acidum acetylsalicylicum) –Ъ—А–Є—Б—В–∞–ї—Ц—З–љ–Є–є –њ–Њ—А–Њ—И–Њ–Ї –±—Ц–ї–Њ–≥–Њ –∞–±–Њ –Љ–∞–є–ґ–µ –±—Ц–ї–Њ–≥–Њ –Ї–Њ–ї—М–Њ—А—Г –∞–±–Њ –±–µ–Ј–±–∞—А–≤–љ—Ц –Ї—А–Є—Б—В–∞–ї–Є. –†–Њ–Ј—З–Є–љ–љ—Ц—Б—В—М. –Ь–∞–ї–Њ —А–Њ–Ј—З–Є–љ–љ–∞ —Г –≤–Њ–і—Ц, –ї–µ–≥–Ї–Њ —А–Њ–Ј—З–Є–љ–љ–∞ –≤ –µ—В–∞–љ–Њ–ї—Ц (96%) –†. –Я–ї–∞–≤–Є—В—М—Б—П –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Ц –±–ї–Є–Ј—М–Ї–Њ 143 ¬∞ –° (–Љ–Є—В—В—Ф–≤–Є–є –Љ–µ—В–Њ–і).
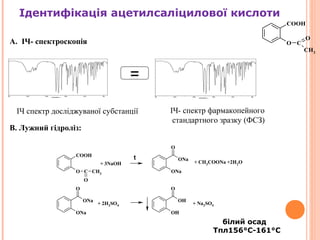
- 11. 11 A. –Ґ–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –њ–ї–∞–≤–ї–µ–љ–љ—П: 158¬∞C –і–Њ 161¬∞C. B. –Ж–І —Б–њ–µ–Ї—В—А–Њ—Б–Ї–Њ–њ—Ц—П: C. –†–µ–∞–Ї—Ж—Ц—П (a) –љ–∞ —Б–∞–ї—Ц—Ж–Є–ї–∞—В–Є: COOH OH —Д—Ц–Њ–ї–µ—В–Њ–≤–µ –Ј–∞–±–∞—А–≤–ї–µ–љ–љ—П OH C O OH C O O Fe O Cl FeCl3 2 HCl+ + –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є
- 12. –Ь–Њ–ґ–ї–Є–≤—Ц —А–µ–∞–Ї—Ж—Ц—Ч: пГШ –Ф–µ–Ї–∞—А–±–Њ–Ї—Б–Є–ї—О–≤–∞–љ–љ—П ( —Г –њ—А–Є—Б—В—Г–љ–Њ—Б—В—Ц –љ–∞—В—А—Ц—О —Ж–Є—В—А–∞—В—Г): пГШ –†–µ–∞–Ї—Ж—Ц—П —Г—В–≤–Њ—А–µ–љ–љ—П –∞—Г—А—Ц–љ–Њ–≤–Њ–≥–Њ –±–∞—А–≤–љ–Є–Ї–∞: COOH OH OH C O OH OH t o + CO2 phenol —Е—Ц–љ–Њ—Ч–і–љ–∞ —Б—В—А—Г–Ї—В—Г—А–∞ OH COOHH OH COOHC H H HOOC HO CHHOOC HO COOH O O C H H OH HOOC H [O]: conc. H2SO4 -H2O conc. H2SO4 —З–µ—А–≤–Њ–љ–µ –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є
- 13. COOH OH –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є –Р–ї–Ї–∞–ї—Ц–Љ–µ—В—А–Є—П –≤ —Б–њ–Є—А—В—Ц, –њ—А—П–Љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П 0,1–Ь —А–Њ–Ј—З–Є–љ–Њ–Љ –љ–∞—В—А—Ц—О –≥—Ц–і—А–Њ–Ї—Б–Є–і—Г, —Ц–љ–і–Є–Ї–∞—В–Њ—А вАУ —Д–µ–љ–Њ–ї–Њ–≤–Є–є —З–µ—А–≤–Њ–љ–Є–є, (–Ф–§–£): COOH OH OH COONa + NaOH + H2O –Т–Љ—Ц—Б—В –і—Ц—О—З–Њ—Ч —А–µ—З–Њ–≤–Є–љ–Є —Г —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч (–≤ –њ–µ—А–µ—А–∞—Е—Г–љ–Ї—Г –љ–∞ —Б—Г—Е—Г —А–µ—З–Њ–≤–Є–љ—Г) —Г –≤—Ц–і—Б–Њ—В–Ї–∞—Е —А–Њ–Ј—А–∞—Е–Њ–≤—Г—О—В—М –Ј–∞ —Д–Њ—А–Љ—Г–ї–Њ—О: %–≤–Њ–ї.)(100m 100100TKV % –љ NaOHNaOH вИТвЛЕ вЛЕвЛЕвЛЕвЛЕ = ) –Љ–ї –≥( 1000 Msc T —Б–∞–ї–Є—Ж.)(–Ї.(NaOH) вЛЕвЛЕ = , –і–µ s=1
- 14. KBrO3 + 5KBr + 3H2 SO4 вЖТ 3Br2 + 3K2 SO4 + 3H2 O + 3HBr + CO2 Br Br Br OH + 3Br2 OH COOH 2KI + Br2 вЖТ I2 + 2KBr I2 + 2Na2 S2 O3 вЖТ 2NaI + Na2 S4 O6 COOH OH –С—А–Њ–Љ–∞—В–Њ–Љ–µ—В—А—Ц—П–С—А–Њ–Љ–∞—В–Њ–Љ–µ—В—А—Ц—П,, –Ј–≤–Њ—А–Њ—В–љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П –Ј –Ї–Њ–љ—В—А–Њ–ї—М–љ–Є–Љ –і–Њ—Б–ї—Ц–і–Њ–Љ–Ј–≤–Њ—А–Њ—В–љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П –Ј –Ї–Њ–љ—В—А–Њ–ї—М–љ–Є–Љ –і–Њ—Б–ї—Ц–і–Њ–Љ s=1 —Ц–љ–і–Є–Ї–∞—В–Њ—А- –Ї—А–Њ—Е–Љ–∞–ї—М –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є –Ф–Њ –љ–∞–≤–∞–ґ–Ї–Є —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч –і–Њ–і–∞—О—В—М –љ–∞–і–ї–Є—И–Њ–Ї —В–Є—В—А–Њ–≤–∞–љ–Њ–≥–Њ —А–Њ–Ј—З–Є–љ—Г –±—А–Њ–Љ—Ц–і-–±—А–Њ–Љ–∞—В—Г, –њ—Ц–і–Ї–Є—Б–ї—О—О—В—М –Ї–Є—Б–ї–Њ—В–Њ—О —Б—Г–ї—М—Д–∞—В–љ–Њ—О, –њ–µ—А–µ–Љ—Ц—И—Г—О—В—М —Ц –Ј–∞–ї–Є—И–∞—О—В—М –љ–∞ –і–µ—П–Ї–Є–є —З–∞—Б. –Э–∞–і–ї–Є—И–Њ–Ї –±—А–Њ–Љ—Г –≤–Є–Ј–љ–∞—З–∞—О—В—М –є–Њ–і–Њ–Љ–µ—В—А–Є—З–љ–Њ (–њ—Ц—Б–ї—П –і–Њ–і–∞–≤–∞–љ–љ—П –і–Њ —А–µ–∞–Ї—Ж—Ц–є–љ–Њ—Ч —Б—Г–Љ—Ц—И—Ц –Ї–∞–ї—Ц—О –є–Њ–і–Є–і—Г): %–≤–Њ–ї.)(100m 100100TKV(V % –љ OSNaOSNaOSNa 322322322 вИТвЛЕ вЛЕвЛЕвЛЕвЛЕвИТ = ).... –і–Њ—Б–љ–і–Ї ) –Љ–ї –≥( 1000 Msc T —Б–∞–ї–Є—Ж.)(–Ї.)(KBrO3 вЛЕвЛЕ = –Т–Љ—Ц—Б—В –і—Ц—О—З–Њ—Ч —А–µ—З–Њ–≤–Є–љ–Є —Г —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч (–њ–µ—А–µ—А–∞—Е—Г–љ–Њ–Ї –љ–∞ —Б—Г—Е—Г —А–µ—З–Њ–≤–Є–љ—Г) —Г –≤—Ц–і—Б–Њ—В–Ї–∞—Е —А–Њ–Ј—А–∞—Е–Њ–≤—Г—О—В—М –Ј–∞ —Д–Њ—А–Љ—Г–ї–Њ—О: , –і–µ
- 15. –±—Ц–ї–Є–є –Њ—Б–∞–і –Ґ–њ–ї156¬∞C-161¬∞C A. –Ж–І- —Б–њ–µ–Ї—В—А–Њ—Б–Ї–Њ–њ—Ц—П B. –Ы—Г–ґ–љ–Є–є –≥—Ц–і—А–Њ–ї—Ц–Ј: O C O CH3 COOH ONa O ONa ONa O ONa OH O OH + 3NaOH + CH3COONa +2H2O + 2H2SO4 + Na2SO4 t COOH O C O CH3 –Ж–І —Б–њ–µ–Ї—В—А –і–Њ—Б–ї—Ц–і–ґ—Г–≤–∞–љ–Њ—Ч —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч –Ж–І- —Б–њ–µ–Ї—В—А —Д–∞—А–Љ–∞–Ї–Њ–њ–µ–є–љ–Њ–≥–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –Ј—А–∞–Ј–Ї—Г (–§–°–Ч) = –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є
- 16. 16 COOH O C O CH3 —Д—Ц–Њ–ї–µ—В–Њ–≤–µ –Ј–∞–±–∞—А–≤–ї–µ–љ–љ—П OH C O OH C O O Fe O Cl FeCl3 2 HCl+ + OH COOHH OH COOHC H H HOOC HO CHHOOC HO COOH O O C H H OH HOOC H [O]: conc. H2SO4 -H2O conc. H2SO4 –Ю—Б–∞–і, –Њ–і–µ—А–ґ–∞–љ–Є–є –≤ –њ–Њ–њ–µ—А–µ–і–љ—М–Њ–Љ—Г –≤–Є–њ—А–Њ–±—Г–≤–∞–љ–љ—Ц –і–∞—Ф —А–µ–∞–Ї—Ж—Ц—О (a) –љ–∞ —Б–∞–ї—Ц—Ж–Є–ї–∞—В–Є: —Ц–Ј –Ј–∞–ї—Ц–Ј–∞ —Е–ї–Њ—А–Є–і–Њ–Љ –Ь–Њ–ґ–ї–Є–≤–∞ —А–µ–∞–Ї—Ж—Ц—П –љ–∞ —Б–∞–ї—Ц—Ж–Є–ї–∞—В: —Г—В–≤–Њ—А–µ–љ–љ—П –∞—Г—А—Ц–љ–Њ–≤–Њ–≥–Њ –±–∞—А–≤–љ–Є–Ї—Г –Ј —Д–Њ—А–Љ–∞–ї—М–і–µ–≥—Ц–і–Њ–Љ —В–∞ –Ї–Њ–љ—Ж. —Б—Ц—А—З–∞–љ–Њ—О –Ї–Є—Б–ї–Њ—В–Њ—О –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є
- 17. COOH O C O CH3 –љ–∞–≥—А—Ц–≤–∞–љ–љ—П –Ј –Ї–∞–ї—М—Ж—Ц—О –≥—Ц–і—А–Њ–Ї—Б–Є–і–Њ–Љ O C O CH3 COOH OH 2 CH3 C O CH3 CH3 C O CH3 C H O NO2 OH C H NO2 C O N H C C N H O C CH2 COCH3 OH C H NO2 CH2 COCH3 CaO CO2 + 2Ca (OH)2 Ca2+ + (CH3COO)2Ca +2H2O2 (CH3COO)2Ca t0 COO t 0 HCl 2 + + + –≤–Є–і—Ц–ї–µ–љ–љ—П –∞—Ж–µ—В–Њ–љ—Г o-–љ—Ц—В—А–Њ–±–µ–љ–Ј–∞–ї—М–і–µ–≥—Ц–і –±–ї–∞–Ї–Є—В–љ–µ–±–ї–∞–Ї–Є—В–љ–µ–Ј–µ–ї–µ–љ—Г–≤–∞—В–Њ-–±–ї–∞–Ї–Є—В–љ–µ C. –†–µ–∞–Ї—Ж—Ц—П —Г—В–≤–Њ—А–µ–љ–љ—П —Ц–љ–і–Є–≥–Њ –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є
- 18. (–њ–µ—А–µ—А–∞—Е—Г–љ–Њ–Ї –љ–∞ —Б—Г—Е—Г —А–µ—З–Њ–≤–Є–љ—Г!) —Ц–љ–і–Є–Ї–∞—В–Њ—А вАУ —Д–µ–љ–Њ–ї—Д—В–∞–ї–µ—Ч–љ ss = 1= 1/2/2 COOH COONa OCOCH3 CH3COONa+ H2O+3NaOH ONa + to COONa COONa H2O+ ONa +HCl OH NaOH + HCl вЖТ NaCl + H2 O –Я–∞—А–∞–ї–µ–ї—М–љ–Њ –њ—А–Њ–≤–Њ–і—П—В—М –Ї–Њ–љ—В—А–Њ–ї—М–љ–Є–є –і–Њ—Б–ї—Ц–і: COOH O C O CH3 –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є –Р–ї–Ї–∞–ї—Ц–Љ–µ—В—А—Ц—П, –Ј–≤–Њ—А–Њ—В–љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П –Ј –Ї–Њ–љ—В—А–Њ–ї—М–љ–Є–Љ –і–Њ—Б–ї—Ц–і–Њ–Љ. –Ь–µ—В–Њ–і –≥—А—Г–љ—В—Г—Ф—В—М—Б—П –љ–∞ –Њ–Љ–Є–ї–µ–љ–љ—Ц —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч —В–Є—В—А–Њ–≤–∞–љ–Є–Љ —А–Њ–Ј—З–Є–љ–Њ–Љ –љ–∞—В—А—Ц—О –≥—Ц–і—А–Њ–Ї—Б–Є–і—Г, –љ–∞–і–ї–Є—И–Њ–Ї —П–Ї–Њ–≥–Њ –≤–Є–Ј–љ–∞—З–∞—О—В—М –∞—Ж–Є–і–Є–Љ–µ—В—А–Є—З–љ–Њ. %–≤–Њ–ї.)(100m 100100TK)V–Њ—Б–љ.(V–Ї.–і. % –љ HClHClHCl вИТвЛЕ вЛЕвЛЕвЛЕвЛЕвИТ = ) –Љ–ї –≥( 1000 MsC T —Ж.)–∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц(–Ї.(NaOH) вЛЕвЛЕ =
- 19. –Р–љ–∞–ї—Ц–Ј –ї—Ц–Ї–∞—А—Б—М–Ї–Њ—Ч —Д–Њ—А–Љ–Є Tabulettae Acidi acetylsalicylici 0.5 –Ґ–∞–±–ї–µ—В–Ї–Є –∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є 0.5 –≥ –Ю–њ–Є—Б. –Ґ–∞–±–ї–µ—В–Ї–Є –±—Ц–ї–Њ–≥–Њ –Ї–Њ–ї—М–Њ—А—Г, —Б–ї–∞–±–Ї–Њ–Ї–Є—Б–ї—Ц –љ–∞ —Б–Љ–∞–Ї. –•—Ц–Љ—Ц—З–љ–Є–є –Ї–Њ–љ—В—А–Њ–ї—М. –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П 1. –Ы—Г–ґ–љ–Є–є –≥—Ц–і—А–Њ–ї—Ц–Ј –Ј –њ–Њ–і–∞–ї—М—И–Њ—О –љ–µ–є—В—А–∞–ї—Ц–Ј–∞—Ж—Ц—Ф—О вАУ –≤–Є–њ–∞–і–∞—Ф –±—Ц–ї–Є–є –Њ—Б–∞–і –Ї–Є—Б–ї–Њ—В–Є —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ј —Е–∞—А–∞–Ї—В–µ—А–љ–Њ—О —В–µ–Љ–њ–µ—А–∞—В—Г—А–Њ—О –њ–ї–∞–≤–ї–µ–љ–љ—П (–Ф–§–£): 2. –Ю—Б–∞–і –Ї–Є—Б–ї–Њ—В–Є —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч, –Њ–і–µ—А–ґ–∞–љ–Є–є –≤ –њ–Њ–њ–µ—А–µ–і–љ—М–Њ–Љ—Г –≤–Є–њ—А–Њ–±—Г–≤–∞–љ–љ—Ц, –і–∞—Ф —А–µ–∞–Ї—Ж—Ц—О –љ–∞ —Б–∞–ї—Ц—Ж–Є–ї–∞—В–Є –Ј —А–Њ–Ј—З–Є–љ–Њ–Љ —Д–µ—А—Г–Љ—Г (III) —Е–ї–Њ—А–Є–і—Г; –ЈвАЩ—П–≤–ї—П—Ф—В—М—Б—П —Д—Ц–Њ–ї–µ—В–Њ–≤–µ –Ј–∞–±–∞—А–≤–ї–µ–љ–љ—П, —Й–Њ –љ–µ –Ј–љ–Є–Ї–∞—Ф –њ—Ц—Б–ї—П –і–Њ–і–∞–≤–∞–љ–љ—П –Ї–Є—Б–ї–Њ—В–Є –Њ—Ж—В–Њ–≤–Њ—Ч (–Ф–§–£): O C O CH3 COOH ONa O ONa ONa O ONa OH O OH + 3NaOH + CH3COONa +2H2O + 2H2SO4 + Na2SO4 t OH C OH O C O O O FeCl + Fe Cl3 + 2HCl 20 ... 20321 mmmm ++++ –Ю–і–љ–Њ—А—Ц–і–љ—Ц—Б—В—М –Љ–∞—Б–Є –і–ї—П –Њ–і–Є–љ–Є—Ж—Ц –і–Њ–Ј–Њ–≤–∞–љ–Њ–≥–Њ –ї—Ц–Ї–∞—А—Б—М–Ї–Њ–≥–Њ –Ј–∞—Б–Њ–±—Г m—Б–µ—А = %–≤—Ц–і.1 = %100* || 1 —Б–µ—А —Б–µ—А m mm вИТ
- 20. –Р–љ–∞–ї—Ц–Ј –ї—Ц–Ї–∞—А—Б—М–Ї–Њ—Ч —Д–Њ—А–Љ–Є 3. –£—В–≤–Њ—А–µ–љ–љ—П –∞—Г—А—Ц–љ–Њ–≤–Њ–≥–Њ –±–∞—А–≤–љ–Є–Ї—Г –Ј —Д–Њ—А–Љ–∞–ї—М–і–µ–≥—Ц–і–Њ–Љ —В–∞ –Ї–Њ–љ—Ж. —Б—Ц—А—З–∞–љ–Њ—О –Ї–Є—Б–ї–Њ—В–Њ—О –†–Њ–ґ–µ–≤–µ –Ј–∞–±–∞—А–≤–ї–µ–љ–љ—П–Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –Р–ї–Ї–∞–ї—Ц–Љ–µ—В—А—Ц—П –њ—А—П–Љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П –≤ —Б–њ–Є—А—В—Ц —А–Њ–Ј—З–Є–љ–Њ–Љ –љ–∞—В—А—Ц—О –≥—Ц–і—А–Њ–Ї—Б–Є–і—Г. –Ґ–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —А–µ–∞–Ї—Ж—Ц–є–љ–Њ—Ч —Б—Г–Љ—Ц—И—Ц –њ–Њ–≤–Є–љ–љ–∞ –±—Г—В–Є –љ–µ –≤–Є—Й–µ 18¬∞–°: —Ц–љ–і–Є–Ї–∞—В–Њ—А вАУ —Д–µ–љ–Њ–ї—Д—В–∞–ї–µ—Ч–љ (s=1) COOH COONa OCOCH3 OCOCH3 + H2ONaOH + –љ —Б–µ—А.—В–∞–±–їNaOHNaOH m mTKV X вЛЕвЛЕвЛЕ = ) –Љ–ї –≥( 1000 MsC T —Ж.)–∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц(–Ї.(NaOH) вЛЕвЛЕ = –Т–Љ—Ц—Б—В –і—Ц—О—З–Њ—Ч —А–µ—З–Њ–≤–Є–љ–Є –≤ —В–∞–±–ї–µ—В—Ж—Ц, —Г –≥—А–∞–Љ–∞—Е, —А–Њ–Ј—А–∞—Е–Њ–≤—Г—О—В—М –Ј–∞ —Д–Њ—А–Љ—Г–ї–Њ—О:
- 21. –Ы—Ц–Ї–∞—А—Б—М–Ї—Ц —А–µ—З–Њ–≤–Є–љ–Є, –њ–Њ—Е—Ц–і–љ—Ц –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –∞–Љ—Ц–љ–Њ–Ї–Є—Б–ї–Њ—В
- 22. –Я—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і (Procaini hydrochloridum) –Ъ—А–Є—Б—В–∞–ї—Ц—З–љ–Є–є –њ–Њ—А–Њ—И–Њ–Ї –±—Ц–ї–Њ–≥–Њ –Ї–Њ–ї—М–Њ—А—Г –∞–±–Њ –Љ–∞–є–ґ–µ –±—Ц–ї–Њ–≥–Њ –Ї–Њ–ї—М–Њ—А—Г –∞–±–Њ –±–µ–Ј–±–∞—А–≤–љ—Ц –Ї—А–Є—Б—В–∞–ї–Є. –Э–∞ —П–Ј–Є—Ж—Ц –≤–Є–Ї–ї–Є–Ї–∞—Ф –њ–Њ—З—Г—В—В—П –Ј–∞–љ—Ц–Љ—Ц–љ–љ—П. –†–Њ–Ј—З–Є–љ–љ—Ц—Б—В—М. –Ф—Г–ґ–µ –ї–µ–≥–Ї–Њ —А–Њ–Ј—З–Є–љ–љ–Є–є —Г –≤–Њ–і—Ц –†, —А–Њ–Ј—З–Є–љ–љ–Є–є –≤ –µ—В–∞–љ–Њ–ї—Ц (96%) –†. NH2 C O O CH2 CH2 N C2 H5 C2 H5 H Cl. –Ч–∞—Б—В–Њ—Б—Г–≤–∞–љ–љ—П –≤ –Љ–µ–і–Є—Ж–Є–љ—Ц –Ь—Ц—Б—Ж–µ–≤–Њ–∞–љ–µ—Б—В–µ–Ј—Г—О—З–Є–є –Ј–∞—Б—Ц–±. –Т–ї–∞—Б—В–Є–≤–Њ—Б—В—Ц –Я—А–Є –≤—Б–Љ–Њ–Ї—В—Г–≤–∞–љ–љ—Ц —Ц –њ—А–Є –±–µ–Ј–њ–Њ—Б–µ—А–µ–і–љ—М–Њ–Љ—Г –≤–≤–µ–і–µ–љ–љ—Ц –≤ –Ї—А–Њ–≤ –≤–њ–ї–Є–≤–∞—Ф –љ–∞ –≤–µ—Б—М –Њ—А–≥–∞–љ—Ц–Ј–Љ —Г —Ж—Ц–ї–Њ–Љ—Г. –Ч–Љ–µ–љ—И—Г—Ф —Г—В–≤–Њ—А–µ–љ–љ—П –∞—Ж–µ—В–Є–ї—Е–Њ–ї—Ц–љ—Г —Ц –Ј–љ–Є–ґ—Г—Ф –Ј–±—Г–і–ї–Є–≤—Ц—Б—В—М –њ–µ—А–Є—Д–µ—А–Є—З–љ–Є—Е —Е–Њ–ї—Ц–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Є—Е —Б–Є—Б—В–µ–Љ. –С–ї–Њ–Ї—Г—Ф –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Ц –≥–∞–љ–≥–ї—Ц—Ч. –Ч–Љ–µ–љ—И—Г—Ф —Б–њ–∞–Ј–Љ–Є –≥–ї–∞–і–Ї–Њ—Ч –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А–Є, –Ј–љ–Є–ґ—Г—Ф –Ј–±—Г–і–ї–Є–≤—Ц—Б—В—М –Љ'—П–Ј–∞ —Б–µ—А—Ж—П.
- 23. NH2 C O O CH2 CH2 N C2H5 C2H5 * HCl 1. –Т–Є–Ј–љ–∞—З–µ–љ–љ—П –Ґ–њ–ї, —П–Ї–∞ –Љ–∞—Ф –±—Г—В–Є –≤—Ц–і 154¬∞–° –і–Њ 158¬∞–°. 2. –Ж–љ—Д—А–∞—З–µ—А–≤–Њ–љ–Є–є —Б–њ–µ–Ї—В—А —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч –Љ–∞—Ф –≤—Ц–і–њ–Њ–≤—Ц–і–∞—В–Є —Б–њ–µ–Ї—В—А—Г –§–°–Ч –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г. –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г 3. –†–µ–∞–Ї—Ж—Ц—П –љ—Ц—В—А—Г–≤–∞–љ–љ—П —В–∞ —Г—В–≤–Њ—А–µ–љ–љ—П —Б–Њ–ї—Ц –Њ—А—В–Њ—Е—Ц–љ–Њ—Ч–і–љ–Њ—Ч –±—Г–і–Њ–≤–Є. –°–њ–Њ—Б—В–µ—А—Ц–≥–∞—Ф—В—М—Б—П –Ї–Њ—А–Є—З–љ–µ–≤–∞—В–Њ-—З–µ—А–≤–Њ–љ–µ –Ј–∞–±–∞—А–≤–ї–µ–љ–љ—П: ONH2 O R HNO3, t Co ONH2 O R O2 N O2N KOH (—Б–њ–Є—А—В–Њ–≤–Њ–є —А–∞—Б—В–≤–Њ—А) ONH O R N O2 N OK O _ + 4. –†–µ–∞–Ї—Ж—Ц—П –Ј–љ–µ–±–∞—А–≤–ї–µ–љ–љ—П —А–Њ–Ј—З–Є–љ—Г –Ї–∞–ї—Ц—О –њ–µ—А–Љ–∞–љ–≥–∞–љ–∞—В—Г (–≤—Ц–і–Љ—Ц–љ–љ—Ц—Б—В—М –≤—Ц–і —Ц–љ—И–Є—Е –∞–љ–µ—Б—В–µ—В–Є–Ї—Ц–≤). 5. –°—Г–±—Б—В–∞–љ—Ж—Ц—П –і–∞—Ф —А–µ–∞–Ї—Ж—Ц—Ч –љ–∞ —Е–ї–Њ—А–Є–і–Є (2.3.1): Cl- + AgNO3 вЖТ AgClвЖУ + NO3 - AgCl + 2NH4 OH вЖТ [Ag(NH3 ) 2 ]Cl + 2H2 O
- 24. 6. –°—Г–±—Б—В–∞–љ—Ж—Ц—П –і–∞—Ф —А–µ–∞–Ї—Ж—Ц—Ч –љ–∞ –њ–µ—А–≤–Є–љ–љ—Г –∞—А–Њ–Љ–∞—В–Є—З–љ—Г –∞–Љ—Ц–љ–Њ–≥—А—Г–њ—Г: 6.1 . –£—В–≤–Њ—А–µ–љ–љ—П –∞–Ј–Њ–±–∞—А–≤–љ–Є–Ї–∞ NH2 C O O CH2 CH2 N C2 H5 C2 H5 H Cl C O O CH2 CH2 N C2 H5 C2 H5 N + N H Cl OH NN NaO C O O CH2 CH2 N C2 H5 C2 H5 . NaNO2 HCl Cl- NaOH . 6.2 . –£—В–≤–Њ—А–µ–љ–љ—П –Њ—Б–љ–Њ–≤–Є –®–Є—Д—Д—Г NH2 C O O CH2 CH2 N C2H5 C2 H5 C N CH3 CH3O H NCH C O O CH2 CH2 N C2 H5 C2 H5 N CH3 CH3 H 2 O + - –Њ—Б–љ–Њ–≤–∞ –®–Є—Д—Д–∞ HCl –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г
- 25. –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г –Э—Ц—В—А–Є—В–Њ–Љ–µ—В—А—Ц—П, –њ—А—П–Љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П –Ј –Ї–Њ–љ—В—А–Њ–ї—М–љ–Є–Љ –і–Њ—Б–ї—Ц–і–Њ–Љ (–Ф–§–£). –Ґ–Є—В—А–∞–љ—В вАУ —А–Њ–Ј—З–Є–љ –љ–∞—В—А—Ц—О –љ—Ц—В—А–Є—В—Г; —А–µ–∞–Ї—Ж—Ц—О –њ—А–Њ–≤–Њ–і—П—В—М –≤ –њ—А–Є—Б—Г—В–љ–Њ—Б—В—Ц –Ї–Є—Б–ї–Њ—В–Є —Е–ї–Њ—А–Є—Б—В–Њ–≤–Њ–і–љ–µ–≤–Њ—Ч —А–Њ–Ј–≤–µ–і–µ–љ–Њ—Ч —В–∞ –Ї–∞—В–∞–ї—Ц–Ј–∞—В–Њ—А—Г –Ї–∞–ї—Ц—О –±—А–Њ–Љ—Ц–і—Г. –Ґ–Њ—З–Ї—Г –µ–Ї–≤—Ц–≤–∞–ї–µ–љ—В–љ–Њ—Б—В—Ц –≤–Є–Ј–љ–∞—З–∞—О—В—М –Ј–∞ –і–Њ–њ–Њ–Љ–Њ–≥–Њ—О –Ј–Њ–≤–љ—Ц—И–љ—Ц—Е (–є–Њ–і–Ї—А–Њ—Е–Љ–∞–ї—М–љ–Є–є –њ–∞–њ—Ц—А) –∞–±–Њ –≤–љ—Г—В—А—Ц—И–љ—Ц—Е —Ц–љ–і–Є–Ї–∞—В–Њ—А—Ц–≤ (—В—А–Њ–њ–µ–Њ–ї—Ц–љ 00, –љ–µ–є—В—А–∞–ї—М–љ–Є–є —З–µ—А–≤–Њ–љ–Є–є –∞–±–Њ —Б—Г–Љ—Ц—И —В—А–Њ–њ–µ–Њ–ї—Ц–љ—Г 00 –Ј –Љ–µ—В–Є–ї–µ–љ–Њ–≤–Є–Љ —Б–Є–љ—Ц–Љ) –∞–±–Њ –њ–Њ—В–µ–љ—Ж—Ц–Њ–Љ–µ—В—А–Є—З–љ–Њ. NH2 COO CH2 CH2 N C2 H5 C2 H5 COO CH2 CH2 N C2 H5 C2 H5 N + NNaNO2 HCl, KBr Cl-. HCl . HCl+ –£ –≤–Є–њ–∞–і–Ї—Г –≤–Є–Ї–Њ—А–Є—Б—В–∞–љ–љ—П –Ј–Њ–≤–љ—Ц—И–љ—М–Њ–≥–Њ —Ц–љ–і–Є–Ї–∞—В–Њ—А–∞ вАУ –є–Њ–і–Ї—А–Њ—Е–Љ–∞–ї—М–љ–Њ–≥–Њ –њ–∞–њ–µ—А—Г вАУ –њ–µ—А–µ–±—Ц–≥–∞—Ф –љ–∞—Б—В—Г–њ–љ–∞ —А–µ–∞–Ї—Ж—Ц—П: 5NaNO2 + 2KIO3 + 2HCl = I2 + 5NaNO3 + 2KCl + H2O –Т–Љ—Ц—Б—В –і—Ц—О—З–Њ—Ч —А–µ—З–Њ–≤–Є–љ–Є, —Г –≤—Ц–і—Б–Њ—В–Ї–∞—Е, —Г –њ–µ—А–µ—А–∞—Е—Г–љ–Ї—Г –љ–∞ —Б—Г—Е—Г —А–µ—З–Њ–≤–Є–љ—Г —А–Њ–Ј—А–∞—Е–Њ–≤—Г—О—В—М –Ј–∞ —Д–Њ—А–Љ—Г–ї–Њ—О: %–≤–Њ–ї.)(100m 100100TK)V–Ї.–і.(V–Њ.–і. % –љ )(NaNO)(NaNO 22 вИТвЛЕ вЛЕвЛЕвЛЕвЛЕвИТ = ) –Љ–ї –≥( 1000 MsC T –і—Г)–≥—Ц–і—А–Њ—Е–ї–Њ—А–Є(–њ—А–Њ–Ї–∞—Ч–љ—Г)(NaNO2 вЛЕвЛЕ = (s=1)
- 26. –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г –Ь–Њ–ґ–ї–Є–≤—Ц –Љ–µ—В–Њ–і–Є –Р–ї–Ї–∞–ї—Ц–Љ–µ—В—А—Ц—П, –њ—А—П–Љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П —А–Њ–Ј—З–Є–љ–Њ–Љ –љ–∞—В—А—Ц—О –≥—Ц–і—А–Њ–Ї—Б–Є–і—Г –Ј–∞ –Ј–≤вАЩ—П–Ј–∞–љ–Њ—О –Ї–Є—Б–ї–Њ—В–Њ—О —Е–ї–Њ—А–Є—Б—В–Њ–≤–Њ–і–љ–µ–≤–Њ—О –≤ –њ—А–Є—Б—Г—В–љ–Њ—Б—В—Ц —Е–ї–Њ—А–Њ—Д–Њ—А–Љ—Г (–і–ї—П –≤–Є–ї—Г—З–µ–љ–љ—П —Б–Є–ї—М–љ–Њ—Ч –Њ—Б–љ–Њ–≤–Є –њ—А–Њ–Ї–∞—Ч–љ—Г). NaOH NaCl NH2 COO CH2 CH2 N C2 H5 C2H5 NH2 COO CH2 CH2 N C2 H5 C2H5 + + . HCl H2O+ s=1 –Ж–љ–і–Є–Ї–∞—В–Њ—А вАУ —А–Њ–Ј—З–Є–љ —Д–µ–љ–Њ–ї—Д—В–∞–ї–µ—Ч–љ—Г –Т–Љ—Ц—Б—В –і—Ц—О—З–Њ—Ч —А–µ—З–Њ–≤–Є–љ–Є, —Г –≤—Ц–і—Б–Њ—В–Ї–∞—Е, —Г –њ–µ—А–µ—А–∞—Е—Г–љ–Ї—Г –љ–∞ —Б—Г—Е—Г —А–µ—З–Њ–≤–Є–љ—Г —А–Њ–Ј—А–∞—Е–Њ–≤—Г—О—В—М –Ј–∞ —Д–Њ—А–Љ—Г–ї–Њ—О: %–≤–Њ–ї.)(100m 100100TKV % –љ aOH вИТвЛЕ вЛЕвЛЕвЛЕвЛЕ = N ) –Љ–ї –≥( 1000 Ms–° T –і—Г)–≥—Ц–і—А–Њ—Е–ї–Њ—А–Є(–њ—А–Њ–Ї–∞—Ч–љ—Г(NaOH) вЛЕвЛЕ = –Р—А–≥–µ–љ—В–Њ–Љ–µ—В—А—Ц—П –Ј–∞ –Љ–µ—В–Њ–і–Њ–Љ –§–∞—П–љ—Б–∞ –Ј–∞ –Ј–≤вАЩ—П–Ј–∞–љ–Њ—О –Ї–Є—Б–ї–Њ—В–Њ—О —Е–ї–Њ—А–Є—Б—В–Њ–≤–Њ–і–љ–µ–≤–Њ—О. –Я—А—П–Љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П —А–Њ–Ј—З–Є–љ–Њ–Љ —Б—А—Ц–±–ї–∞ –љ—Ц—В—А–∞—В—Г; —Ц–љ–і–Є–Ї–∞—В–Њ—А вАУ –±—А–Њ–Љ—Д–µ–љ–Њ–ї–Њ–≤–Є–є —Б–Є–љ—Ц–є; (s=1).
- 27. –Р–љ–∞–ї—Ц–Ј –ї—Ц–Ї–∞—А—Б—М–Ї–Њ—Ч —Д–Њ—А–Љ–Є –†–Њ–Ј—З–Є–љ –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г 0,5 % (2%) –і–ї—П –Є–љвАЩ—Ф–Ї—Ж—Ц–є Solutio Procaini hydrochloridi 0,5 %(2%) –Ю–њ–Є—Б. –Я—А–Њ–Ј–Њ—А–∞, –±–µ–Ј–±–∞—А–≤–љ–∞ —А—Ц–і–Є–љ–∞. –•—Ц–Љ—Ц—З–љ–Є–є –Ї–Њ–љ—В—А–Њ–ї—М. –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П NH2 C O O CH2 CH2 N C2 H5 C2 H5 H Cl C O O CH2 CH2 N C2 H5 C2 H5 N + N H Cl OH NN NaO C O O CH2 CH2 N C2 H5 C2 H5 . NaNO2 HCl Cl- NaOH . 1. –†–µ–∞–Ї—Ж—Ц—Ч—П–љ–∞ –њ–µ—А–≤–Є–љ–љ—Г –∞—А–Њ–Љ–∞—В–Є—З–љ—Г –∞–Љ—Ц–љ–Њ–≥—А—Г–њ—Г. –£—В–≤–Њ—А–µ–љ–љ—П –∞–Ј–Њ–±–∞—А–≤–љ–Є–Ї–∞ 2. –†–µ–∞–Ї—Ж—Ц—П –Ј–љ–µ–±–∞—А–≤–ї–µ–љ–љ—П —А–Њ–Ј—З–Є–љ—Г –Ї–∞–ї—Ц—О –њ–µ—А–Љ–∞–љ–≥–∞–љ–∞—В—Г –≤ –њ—А–Є—Б—Г—В–љ–Њ—Б—В—Ц —Б—Ц—А—З–∞–љ–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є —А–Њ–Ј–≤–µ–і–µ–љ–Њ—Ч –† (–≤—Ц–і–Љ—Ц–љ–љ—Ц—Б—В—М –≤—Ц–і —Ц–љ—И–Є—Е –∞–љ–µ—Б—В–µ—В–Є–Ї—Ц–≤). –§—Ц–Њ–ї–µ—В–Њ–≤–µ –Ј–∞–±–∞—А–≤–ї–µ–љ–љ—П –≤—Ц–і—А–∞–Ј—Г –Ј–љ–Є–Ї–∞—Ф. –Ю–±вАШ—Ф–Љ –ї—Ц–Ї–∞—А—Б—М–Ї–Њ–≥–Њ –Ј–∞—Б–Њ–±—Г, —Й–Њ –≤–Є–ї—Г—З–∞—Ф—В—М—Б—П
- 28. –Р–љ–∞–ї—Ц–Ј –ї—Ц–Ї–∞—А—Б—М–Ї–Њ—Ч —Д–Њ—А–Љ–Є –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –Э—Ц—В—А–Є—В–Њ–Љ–µ—В—А—Ц—П, –њ—А—П–Љ–µ —В–Є—В—А—Г–≤–∞–љ–љ—П. –Ґ–Є—В—А–∞–љ—В вАУ —А–Њ–Ј—З–Є–љ –љ–∞—В—А—Ц—О –љ—Ц—В—А–Є—В—Г; —В–Є—В—А—Г–≤–∞–љ–љ—П –њ—А–Њ–≤–Њ–і—П—В—М –≤ –њ—А–Є—Б—Г—В–љ–Њ—Б—В—Ц –Ї–Є—Б–ї–Њ—В–Є —Е–ї–Њ—А–Є—Б—В–Њ–≤–Њ–і–љ–µ–≤–Њ—Ч —А–Њ–Ј–≤–µ–і–µ–љ–Њ—Ч —В–∞ –Ї–∞—В–∞–ї—Ц–Ј–∞—В–Њ—А—Г –Ї–∞–ї—Ц—О –±—А–Њ–Љ—Ц–і—Г. –Ґ–Њ—З–Ї—Г –µ–Ї–≤—Ц–≤–∞–ї–µ–љ—В–љ–Њ—Б—В—Ц –≤–Є–Ј–љ–∞—З–∞—О—В—М –Ј–∞ –і–Њ–њ–Њ–Љ–Њ–≥–Њ—О —Ц–љ–і–Є–Ї–∞—В–Њ—А–∞ –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —З–µ—А–≤–Њ–љ–Њ–≥–Њ: (s=1) NH2 COO CH2 CH2 N C2 H5 C2 H5 COO CH2 CH2 N C2 H5 C2 H5 N + NNaNO2 HCl, KBr Cl-. HCl . HCl+ –Т–Љ—Ц—Б—В –і—Ц—О—З–Њ—Ч —А–µ—З–Њ–≤–Є–љ–Є, —Г –≥—А–∞–Љ–∞—Е, —А–Њ–Ј—А–∞—Е–Њ–≤—Г—О—В—М –Ј–∞ —Д–Њ—А–Љ—Г–ї–Њ—О: ) –Љ–ї –≥( 1000 MsC T –і—Г)–≥—Ц–і—А–Њ—Е–ї–Њ—А–Є(–њ—А–Њ–Ї–∞—Ч–љ—Г)(NaNO2 вЛЕвЛЕ = –∞–љ–∞–ї–Є–Ј–∞–і–ї—П NaNONaNO V –Љ–їTKV –≥X _ 1 , 22 вЛЕвЛЕвЛЕ =
- 29. –Т–Ш–°–Э–Ю–Т–Ъ–Ш 1. –Э–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–љ–Њ–Љ—Г —А–Є–љ–Ї—Г –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –±–µ–Ј–ї—Ц—З –ї—Ц–Ї–∞—А—Б—М–Ї–Є—Е –Ј–∞—Б–Њ–±—Ц–≤, –њ–Њ—Е—Ц–і–љ–Є—Е –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –Ї–Є—Б–ї–Њ—В, –Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В —В–∞ —Ч—Е —Б–Њ–ї–µ–є, –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –∞–Љ—Ц–љ–Њ–Ї–Є—Б–ї–Њ—В, —П–Ї—Ц –≤–Њ–ї–Њ–і—Ц—О—В—М –∞–љ—В–Є—Б–µ–њ—В–Є—З–љ–Њ—О, –њ—А–Њ—В–Є–Љ—Ц–Ї—А–Њ–±–љ–Њ—О, –њ—А–Њ—В–Є–≥—А–Є–±–Ї–Њ–≤–Њ—О, –∞–љ–∞–ї—М–≥–µ—В–Є—З–љ–Њ—О, –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ–Њ—О, –ґ–∞—А–Њ–Ј–љ–Є–ґ—Г—О—З–Њ—О —В–∞ –Љ—Ц—Б—Ж–µ–≤–Њ –∞–љ–µ—Б—В–µ–Ј—Г—О—З–Њ—О –і—Ц—Ф—О. 2. –Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—О –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –Ї–Є—Б–ї–Њ—В, –Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В —В–∞ —Ч—Е —Б–Њ–ї–µ–є, –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –∞–Љ—Ц–љ–Њ–Ї–Є—Б–ї–Њ—В –њ—А–Њ–≤–Њ–і—П—В—М –≤–Є—Е–Њ–і—П—З–Є –Ј –≤—Ц–і–њ–Њ–≤—Ц–і–љ–Є—Е —Д—Г–љ–Ї—Ж—Ц–Њ–љ–∞–ї—М–љ–Є—Е –≥—А—Г–њ: –Ї–∞—А–±–Њ–Ї—Б–Є–ї—М–љ–Њ—Ч –≥—А—Г–њ–Є, —Д–µ–љ–Њ–ї—М–љ–Њ–≥–Њ –≥—Ц–і—А–Њ–Ї—Б–Є–ї—Г, –њ–µ—А–≤–Є–љ–љ–Њ—Ч –∞—А–Њ–Љ–∞—В–Є—З–љ–Њ—Ч –∞–Љ—Ц–љ–Њ–≥—А—Г–њ–Є —В–∞ –±–µ–љ–Ј–Њ–ї—М–љ–Њ–≥–Њ –Ї—Ц–ї—М—Ж—П. 3. –Ъ—Ц–ї—М–Ї—Ц—Б–љ–µ –≤–Є–Ј–љ–∞—З–µ–љ–љ—П –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –Ї–Є—Б–ї–Њ—В, –Њ–Ї—Б–Є–Ї–Є—Б–ї–Њ—В —В–∞ —Ч—Е —Б–Њ–ї–µ–є, –∞—А–Њ–Љ–∞—В–Є—З–љ–Є—Е –∞–Љ—Ц–љ–Њ–Ї–Є—Б–ї–Њ—В –њ—А–Њ–≤–Њ–і—П—В—М –Љ–µ—В–Њ–і–∞–Љ–Є –њ—А—П–Љ–Њ—Ч —В–∞ –Ј–≤–Њ—А–Њ—В–љ–Њ—Ч –∞–ї–Ї–∞–ї—Ц–Љ–µ—В—А—Ц—Ч, –∞—Ж–Є–і–Є–Љ–µ—В—А—Ц—Ч –≤ –љ–µ–≤–Њ–і–љ–Њ–Љ—Г —Б–µ—А–µ–і–Њ–≤–Є—Й—Ц, –Ј–≤–Њ—А–Њ—В–љ–Њ—Ч –±—А–Њ–Љ–∞—В–Њ–Љ–µ—В—А—Ц—Ч, –љ—Ц—В—А–Є—В–Њ–Љ–µ—В—А—Ц—Ч —В–∞ –њ—А—П–Љ–Њ—Ч –∞—А–≥–µ–љ—В–Њ–Љ–µ—В—А—Ц—Ч. 4. –Р–љ–∞–ї—Ц–Ј –ї—Ц–Ї–∞—А—Б—М–Ї–Є—Е —Д–Њ—А–Љ –њ—А–Њ–≤–Њ–і—П—В—М –Ј–∞ –і–Њ–њ–Њ–Љ–Њ–≥–Њ—О –µ–Ї—Б–њ—А–µ—Б –Љ–µ—В–Њ–і—Ц–≤.





![COO COO
3 + 2 Fe3+ + 3 H2O
3
Fe . Fe(OH)3 + 3 H+
ethanol
-
–±–ї—Ц–і–Њ-–ґ–Њ–≤—В–Є–є –Њ—Б–∞–і–±–ї—Ц–і–Њ-–ґ–Њ–≤—В–Є–є –Њ—Б–∞–і
–†–µ–∞–Ї—Ж—Ц—Ч –љ–∞ –љ–∞—В—А—Ц–є (–∞) (2.3.1):
a) –Ј –Ј–∞–ї—Ц–Ј–∞ (III) —Е–ї–Њ—А–Є–і–Њ–Љ
b) –Ј –Ї–Є—Б–ї–Њ—В–Њ—О —Б—Ц—А—З–∞–љ–Њ—О –Ї–Њ–љ—Ж. (—Б—Г–±–ї—Ц–Љ–∞—Ж—Ц—П)
c) –Ј –Ї–Є—Б–ї–Њ—В–Њ—О —Е–ї–Њ—А–Є—Б—В–Њ–≤–Њ–і–љ–µ–≤–Њ—О
–±—Ц–ї–Є–є —Б—Г–±–ї—Ц–Љ–∞—В –љ–∞ –≤–љ—Г—В—А—Ц—И–љ—Ц—Е–±—Ц–ї–Є–є —Б—Г–±–ї—Ц–Љ–∞—В –љ–∞ –≤–љ—Г—В—А—Ц—И–љ—Ц—Е
—Б—В—Ц–љ–Ї–∞—Е –њ—А–Њ–±—Ц—А–Ї–Є—Б—В—Ц–љ–Ї–∞—Е –њ—А–Њ–±—Ц—А–Ї–Є
–Ґ–њ–ї–Ґ–њ–ї=120¬∞C to 124¬∞C=120¬∞C to 124¬∞C
COO COOH
+ +HCl Cl
-
-
COO COOHconc. H2SO4
to
-
–Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –љ–∞—В—А—Ц—О –±–µ–љ–Ј–Њ–∞—В—Г
–†–µ–∞–Ї—Ж—Ц—Ч –љ–∞ –±–µ–љ–Ј–Њ–∞—В–Є(2.3.1):
–Ј —А–Њ–Ј—З–Є–љ–Њ–Љ –Ї–∞–ї—Ц—О –њ—Ц—А–Њ–∞–љ—В–Є–Љ–Њ–љ–∞—В—Г –њ—А–Є –љ–∞–≥—А—Ц–≤–∞–љ–љ—Ц —Ц –љ–∞—Б—В—Г–њ–љ–Њ–Љ—Г
–Њ—Е–Њ–ї–Њ–і–ґ–µ–љ–љ—Ц —Г—В–≤–Њ—А—О—Ф—В—М—Б—П –±—Ц–ї–Є–є –Њ—Б–∞–і:
Na+
+ K[Sb(OH)6] вЖТ Na[Sb(OH)6]вЖУ + K+](https://image.slidesharecdn.com/9-170703082728/85/9-6-320.jpg)




![–Ь–Њ–ґ–ї–Є–≤—Ц —А–µ–∞–Ї—Ж—Ц—Ч:
пГШ –Ф–µ–Ї–∞—А–±–Њ–Ї—Б–Є–ї—О–≤–∞–љ–љ—П
( —Г –њ—А–Є—Б—В—Г–љ–Њ—Б—В—Ц –љ–∞—В—А—Ц—О —Ж–Є—В—А–∞—В—Г):
пГШ –†–µ–∞–Ї—Ж—Ц—П —Г—В–≤–Њ—А–µ–љ–љ—П –∞—Г—А—Ц–љ–Њ–≤–Њ–≥–Њ –±–∞—А–≤–љ–Є–Ї–∞:
COOH
OH
OH
C
O
OH
OH
t
o
+ CO2
phenol
—Е—Ц–љ–Њ—Ч–і–љ–∞ —Б—В—А—Г–Ї—В—Г—А–∞
OH
COOHH
OH
COOHC
H H
HOOC
HO
CHHOOC
HO
COOH
O
O
C
H H
OH
HOOC H
[O]:
conc. H2SO4
-H2O
conc. H2SO4
—З–µ—А–≤–Њ–љ–µ
–Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П —Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є](https://image.slidesharecdn.com/9-170703082728/85/9-12-320.jpg)


![16
COOH
O C
O
CH3
—Д—Ц–Њ–ї–µ—В–Њ–≤–µ –Ј–∞–±–∞—А–≤–ї–µ–љ–љ—П
OH
C
O
OH
C
O
O
Fe
O Cl
FeCl3 2 HCl+ +
OH
COOHH
OH
COOHC
H H
HOOC
HO
CHHOOC
HO
COOH
O
O
C
H H
OH
HOOC H
[O]:
conc. H2SO4
-H2O
conc. H2SO4
–Ю—Б–∞–і, –Њ–і–µ—А–ґ–∞–љ–Є–є –≤ –њ–Њ–њ–µ—А–µ–і–љ—М–Њ–Љ—Г –≤–Є–њ—А–Њ–±—Г–≤–∞–љ–љ—Ц –і–∞—Ф —А–µ–∞–Ї—Ж—Ц—О (a) –љ–∞
—Б–∞–ї—Ц—Ж–Є–ї–∞—В–Є: —Ц–Ј –Ј–∞–ї—Ц–Ј–∞ —Е–ї–Њ—А–Є–і–Њ–Љ
–Ь–Њ–ґ–ї–Є–≤–∞ —А–µ–∞–Ї—Ж—Ц—П –љ–∞ —Б–∞–ї—Ц—Ж–Є–ї–∞—В:
—Г—В–≤–Њ—А–µ–љ–љ—П –∞—Г—А—Ц–љ–Њ–≤–Њ–≥–Њ –±–∞—А–≤–љ–Є–Ї—Г –Ј —Д–Њ—А–Љ–∞–ї—М–і–µ–≥—Ц–і–Њ–Љ —В–∞ –Ї–Њ–љ—Ж. —Б—Ц—А—З–∞–љ–Њ—О –Ї–Є—Б–ї–Њ—В–Њ—О
–Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –∞—Ж–µ—В–Є–ї—Б–∞–ї—Ц—Ж–Є–ї–Њ–≤–Њ—Ч –Ї–Є—Б–ї–Њ—В–Є](https://image.slidesharecdn.com/9-170703082728/85/9-16-320.jpg)






![NH2
C
O
O CH2 CH2 N
C2H5
C2H5
* HCl
1. –Т–Є–Ј–љ–∞—З–µ–љ–љ—П –Ґ–њ–ї, —П–Ї–∞ –Љ–∞—Ф –±—Г—В–Є –≤—Ц–і 154¬∞–° –і–Њ 158¬∞–°.
2. –Ж–љ—Д—А–∞—З–µ—А–≤–Њ–љ–Є–є —Б–њ–µ–Ї—В—А —Б—Г–±—Б—В–∞–љ—Ж—Ц—Ч –Љ–∞—Ф –≤—Ц–і–њ–Њ–≤—Ц–і–∞—В–Є
—Б–њ–µ–Ї—В—А—Г –§–°–Ч –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г.
–Ж–і–µ–љ—В–Є—Д—Ц–Ї–∞—Ж—Ц—П –њ—А–Њ–Ї–∞—Ч–љ—Г –≥—Ц–і—А–Њ—Е–ї–Њ—А–Є–і—Г
3. –†–µ–∞–Ї—Ж—Ц—П –љ—Ц—В—А—Г–≤–∞–љ–љ—П —В–∞ —Г—В–≤–Њ—А–µ–љ–љ—П —Б–Њ–ї—Ц –Њ—А—В–Њ—Е—Ц–љ–Њ—Ч–і–љ–Њ—Ч
–±—Г–і–Њ–≤–Є. –°–њ–Њ—Б—В–µ—А—Ц–≥–∞—Ф—В—М—Б—П –Ї–Њ—А–Є—З–љ–µ–≤–∞—В–Њ-—З–µ—А–≤–Њ–љ–µ –Ј–∞–±–∞—А–≤–ї–µ–љ–љ—П:
ONH2
O
R
HNO3, t Co
ONH2
O
R
O2
N
O2N
KOH
(—Б–њ–Є—А—В–Њ–≤–Њ–є —А–∞—Б—В–≤–Њ—А)
ONH
O
R
N
O2
N
OK
O
_ +
4. –†–µ–∞–Ї—Ж—Ц—П –Ј–љ–µ–±–∞—А–≤–ї–µ–љ–љ—П —А–Њ–Ј—З–Є–љ—Г –Ї–∞–ї—Ц—О –њ–µ—А–Љ–∞–љ–≥–∞–љ–∞—В—Г (–≤—Ц–і–Љ—Ц–љ–љ—Ц—Б—В—М –≤—Ц–і —Ц–љ—И–Є—Е
–∞–љ–µ—Б—В–µ—В–Є–Ї—Ц–≤).
5. –°—Г–±—Б—В–∞–љ—Ж—Ц—П –і–∞—Ф —А–µ–∞–Ї—Ж—Ц—Ч –љ–∞ —Е–ї–Њ—А–Є–і–Є (2.3.1):
Cl-
+ AgNO3
вЖТ AgClвЖУ + NO3
-
AgCl + 2NH4
OH вЖТ [Ag(NH3
) 2
]Cl + 2H2
O](https://image.slidesharecdn.com/9-170703082728/85/9-23-320.jpg)



































































