bab3stoikiometri-160204025004kimiadasar.ppt
- 1. Stoikiometri
- 2. Perjanjian internasional: 1 atom 12 C “beratnya” 12 sma Jika ditimbang 1 H = 1,008 sma 16 O = 16,00 sma Massa atom merupakan massa dari atom dalam satuan massa atom (sma). Secara Mikro atom & molekul Secara Makro gram 3.1
- 3. Litium alam: 7,42% 6 Li (6,015 sma) 92,58% 7 Li (7,016 sma) 7,42 x 6,015 + 92,58 x 7,016 100 = 6,941 sma 3.1 Massa atom rata-rata dari litium:
- 4. Massa Atom Rata-rata (6,941)
- 5. Mol adalah banyaknya suatu zat yang mengandung entitas dasar (atom, molekul, atau partikel lain) sebanyak jumlah atom yang terdapat dalam 12 gram karbon-12. 3.2 1 mol = NA = 6,0221367 x 1023 Bilangan Avogadro (NA)
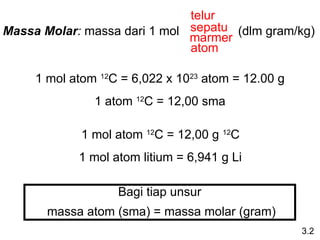
- 6. Massa Molar: massa dari 1 mol (dlm gram/kg) telur sepatu marmer atom 1 mol atom 12 C = 6,022 x 1023 atom = 12.00 g 1 atom 12 C = 12,00 sma 1 mol atom 12 C = 12,00 g 12 C 1 mol atom litium = 6,941 g Li Bagi tiap unsur massa atom (sma) = massa molar (gram) 3.2
- 7. Satu mol dari: C S Cu Fe Hg 3.2
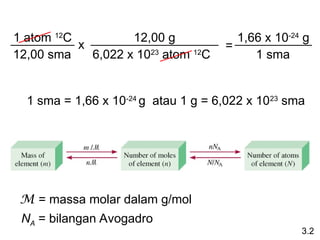
- 8. 1 sma = 1,66 x 10-24 g atau 1 g = 6,022 x 1023 sma 1 atom 12 C 12,00 sma x 12,00 g 6,022 x 1023 atom 12 C = 1,66 x 10-24 g 1 sma 3.2 M = massa molar dalam g/mol NA = bilangan Avogadro
- 9. Apakah Anda Sudah Mengerti Massa Molar? berapa jumlah atom pada 0,551 g potasium (K) ? 1 mol K = 39,10 g K 1 mol K = 6,022 x 1023 atom K 0,551 g K 1 mol K 39,10 g K x x 6,022 x 1023 atom K 1 mol K = 8,49 x 1021 atom K 3.2
- 10. Massa Molekul (berat molekul) adalah jumlah dari massa-massa atom (dalam sma) dalam suatu molekul. SO2 1S 32,07 sma 2O + 2 x 16,00 sma SO2 64,07 sma Bagi tiap molekul massa molekul (sma) = massa molar (gram) 1 molekul SO2 = 64,07 sma 1 mol SO2 = 64,07 g SO2 3.3
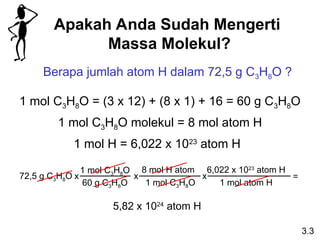
- 11. Apakah Anda Sudah Mengerti Massa Molekul? Berapa jumlah atom H dalam 72,5 g C3H8O ? 1 mol C3H8O = (3 x 12) + (8 x 1) + 16 = 60 g C3H8O 1 mol H = 6,022 x 1023 atom H 5,82 x 1024 atom H 3.3 1 mol C3H8O molekul = 8 mol atom H 72,5 g C3H8O 1 mol C3H8O 60 g C3H8O x 8 mol H atom 1 mol C3H8O x 6,022 x 1023 atom H 1 mol atom H x =
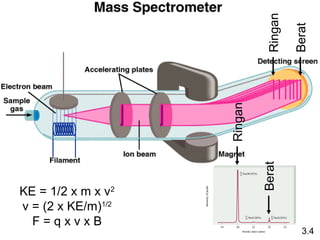
- 12. KE = 1/2 x m x v2 v = (2 x KE/m)1/2 F = q x v x B 3.4 Ringan Ringan Berat Berat
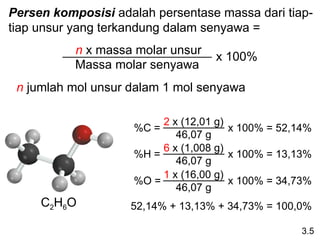
- 13. Persen komposisi adalah persentase massa dari tiap- tiap unsur yang terkandung dalam senyawa = n x massa molar unsur Massa molar senyawa x 100% n jumlah mol unsur dalam 1 mol senyawa C2H6O %C = 2 x (12,01 g) 46,07 g x 100% = 52,14% %H = 6 x (1,008 g) 46,07 g x 100% = 13,13% %O = 1 x (16,00 g) 46,07 g x 100% = 34,73% 52,14% + 13,13% + 34,73% = 100,0% 3.5
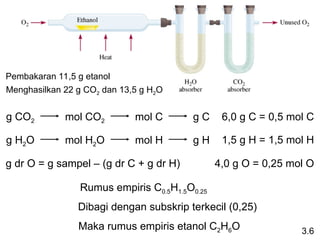
- 14. 3.6 g CO2 mol CO2 mol C g C g H2O mol H2O mol H g H g dr O = g sampel – (g dr C + g dr H) Pembakaran 11,5 g etanol Menghasilkan 22 g CO2 dan 13,5 g H2O 6,0 g C = 0,5 mol C 1,5 g H = 1,5 mol H 4,0 g O = 0,25 mol O Rumus empiris C0.5H1.5O0.25 Dibagi dengan subskrip terkecil (0,25) Maka rumus empiris etanol C2H6O
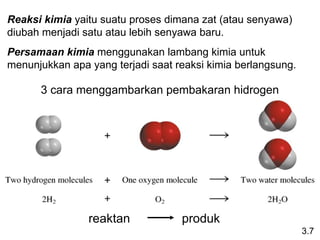
- 15. 3.7 3 cara menggambarkan pembakaran hidrogen Reaksi kimia yaitu suatu proses dimana zat (atau senyawa) diubah menjadi satu atau lebih senyawa baru. Persamaan kimia menggunakan lambang kimia untuk menunjukkan apa yang terjadi saat reaksi kimia berlangsung. reaktan produk
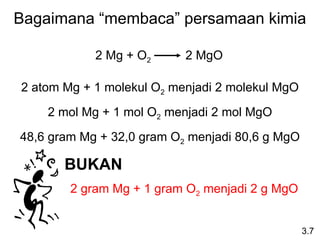
- 16. Bagaimana “membaca” persamaan kimia 2 Mg + O2 2 MgO 2 atom Mg + 1 molekul O2 menjadi 2 molekul MgO 2 mol Mg + 1 mol O2 menjadi 2 mol MgO 48,6 gram Mg + 32,0 gram O2 menjadi 80,6 g MgO BUKAN 2 gram Mg + 1 gram O2 menjadi 2 g MgO 3.7
- 17. Menyetarakan Persamaan Kimia 1. Identifikasi semua reaktan dan produk kemudian tulis rumus molekul yang benar masing-masing pada sisi kiri dan kanan dari persamaan. Etana bereaksi dg oksigen membentuk karbon dioksida dan air C2H6 + O2 CO2 + H2O 2. Ubah koefisien (angka di depan rumus molekul) tetapi jangan ubah subskripnya (angka dalam rumus molekul). 3.7 2C2H6 BUKAN C4H12
- 18. Menyetarakan Persamaan Kimia 3. Pertama-tama, carilah unsur yang muncul hanya sekali pada tiap sisi persamaan dengan jumlah atom yang sama pada tiap sisi. C2H6 + O2 CO2 + H2O 3.7 mulai dari C atau H bukan O 2 karbon di kiri 1 karbon di kanan kalikan CO2 dengan 2 C2H6 + O2 2CO2 + H2O 6 hidrogen di kiri 2 hidrogen di kanan kalikan H2O dengan 3 C2H6 + O2 2CO2 + 3H2O
- 19. Menyetarakan Persamaan Kimia 4. Periksa persamaan yang disetarakan tersebut untuk memastikan jumlah total tiap jenis atom pada kedua sisi persamaan adalah sama. 3.7 2 oksigen di kiri 4 oksigen (2x2) C2H6 + O2 2CO2 + 3H2O + 3 oksigen (3x1) Kalikan O2 dg 7 2 = 7 oksigen di kanan C2H6 + O2 2CO2 + 3H2O 7 2 hilangkan pecahan, bagi kedua sisi dg 2 2C2H6 + 7O2 4CO2 + 6H2O
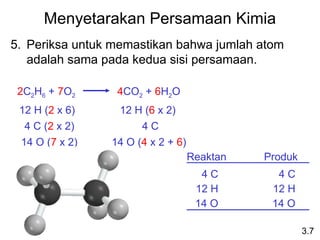
- 20. Menyetarakan Persamaan Kimia 5. Periksa untuk memastikan bahwa jumlah atom adalah sama pada kedua sisi persamaan. 3.7 2C2H6 + 7O2 4CO2 + 6H2O Reaktan Produk 4 C 12 H 14 O 4 C 12 H 14 O 4 C (2 x 2) 4 C 12 H (2 x 6) 12 H (6 x 2) 14 O (7 x 2) 14 O (4 x 2 + 6)
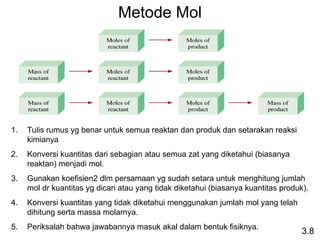
- 21. 1. Tulis rumus yg benar untuk semua reaktan dan produk dan setarakan reaksi kimianya 2. Konversi kuantitas dari sebagian atau semua zat yang diketahui (biasanya reaktan) menjadi mol. 3. Gunakan koefisien2 dlm persamaan yg sudah setara untuk menghitung jumlah mol dr kuantitas yg dicari atau yang tidak diketahui (biasanya kuantitas produk). 4. Konversi kuantitas yang tidak diketahui menggunakan jumlah mol yang telah dihitung serta massa molarnya. 5. Periksalah bahwa jawabannya masuk akal dalam bentuk fisiknya. Metode Mol 3.8
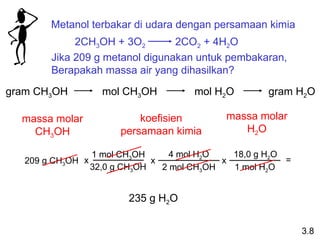
- 22. Metanol terbakar di udara dengan persamaan kimia 2CH3OH + 3O2 2CO2 + 4H2O Jika 209 g metanol digunakan untuk pembakaran, Berapakah massa air yang dihasilkan? gram CH3OH mol CH3OH mol H2O gram H2O massa molar CH3OH koefisien persamaan kimia massa molar H2O 209 g CH3OH 1 mol CH3OH 32,0 g CH3OH x 4 mol H2O 2 mol CH3OH x 18,0 g H2O 1 mol H2O x = 235 g H2O 3.8
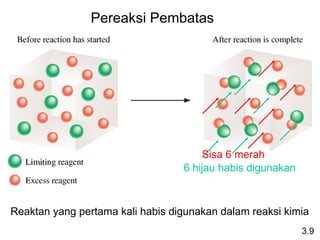
- 23. 6 hijau habis digunakan Sisa 6 merah Pereaksi Pembatas 3.9 Reaktan yang pertama kali habis digunakan dalam reaksi kimia
- 24. Apakah Anda Mengerti Pereaksi Pembatas? Dlm suatu proses, 124 g Al bereaksi dg 601 g Fe2O3 2Al + Fe2O3 Al2O3 + 2Fe Hitung massa Al2O3 yang terbentuk. g Al mol Al dibthkan mol Fe2O3 dibthkan Fe2O3 ATAU g Fe2O3 mol Fe2O3 dibthkan Al dibthkan g Al 124 g Al 1 mol Al 27.0 g Al x 1 mol Fe2O3 2 mol Al x 160 g Fe2O3 1 mol Fe2O3 x = 367 g Fe2O3 124 g Al membthkan 367 g Fe2O3 Menghasilkan Fe2O3 (601 g) shg Al adalah pereaksi pembatas 3.9
- 25. Gunakan pereaksi pembatas untuk menghitung jumlah produk yang dapat dihasilkan. g Al mol Al mol Al2O3 g Al2O3 124 g Al 1 mol Al 27,0 g Al x 1 mol Al2O3 2 mol Al x 102 g Al2O3 1 mol Al2O3 x = 234 g Al2O3 2Al + Fe2O3 Al2O3 + 2Fe 3.9
- 26. Hasil Teoritis yaitu jumlah produk yang akan terbentuk jika seluruh pereaksi pembatas terpakai pada reaksi. Hasil Sebenarnya merupakan jumlah produk sebenarnya yang dihasilkan. % Hasil = Hasil Aktual Hasil Teoritis x 100 3.10
- 27. Kimia Dalam Kehidupan: Pupuk Kimia Tumbuhan membutuhkan: N, P, K, Ca, S, & Mg 3H2 (g) + N2 (g) 2NH3 (g) NH3 (aq) + HNO3 (aq) NH4NO3 (aq) 2Ca5(PO4)3F (s) + 7H2SO4 (aq) 3Ca(H2PO4)2 (aq) + 7CaSO4 (aq) + 2HF (g) fluorapatite