Bab 2 kimia dasar toikiometri kimia.pptx
- 1. BAB I STOIKIOMETR I Stoikiometri : Kajian tentang hubungan- hubungan kuatitatif dalam reaksi kimia
- 2. Hukum-Hukum Dasar Hukum Kekekalan Massa (Lavoisier, 1783) Hukum Perbandingan Tetap (Proust, 1799) Hukum Kelipatan Perbandingan (Dalton, 1803) Hukum Perbandingan Timbal Balik (Richter, 1792) Hukum Perbandingan Setara Hukum Penyatuan volume (gay Lussac, 1808) Hukum Avogadro (1811)
- 3. Hukum Kekekalan Massa ŌĆ£Pada setiap reaksi kimia, massa zat- zat yang bereaksi adalah sama dengan massa produk reaksi.ŌĆØ Contoh : Dalam versi modern : Setiap reaksi kimia tidak dapat dideteksi perubahan massa Hidrogen ’Ć½ Oksigen ’é« Air 2 g 16 g 18 g
- 4. Bukti : c Hidrogen ’Ć½Oksigen ’é« Air 100 g 900g Menurut Einstein : ’üäH ’é░ ’ĆĮ 12x106 J 9x1016 E ’ĆĮ mc2 12x106 ’ĆĮ m ’Ć©3x108 ’Ć® 2 m ’ĆĮ 12x106 ’ĆĮ 1, 33x10’ĆŁ10 kg m ’ĆĮ 1, 33x10’ĆŁ10 g (kecil sekali) massa hilang tiap pembentukan 900 g air
- 5. Hukum Perbandingan Tetap ŌĆ£Pada setiap reaksi kimia, massa zat yang bereaksi dengan sejumlah tertentu zat lain, selalu tetap.ŌĆØ Contoh : Air mengandung hidrogen 11,19% 1: 8 oksigen 88,81% } J
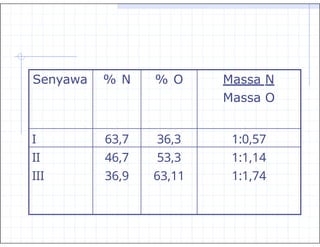
- 6. Hukum Kelipatan Perbandingan ŌĆ£Bila dua unsur dapat membentuk lebih dari satu senyawa, maka perbandingan massa dari unsur yang satu, yang bersenyawa dengan sejumlah tertentu zat lain, merupakan bilangan yang mudah dan bulat.ŌĆØ Contoh :
- 7. Senyawa % N % O Massa N Massa O I 63,7 36,3 1:0,57 II 46,7 53,3 1:1,14 III 36,9 63,11 1:1,74
- 8. Hukum Perbandingan Timbal Balik ŌĆ£Jika dua unsur A dan B masing-masing bereaksi dengan unsur C yang massanya sama membentuk AC dan BC, maka perbandingan massa A dan massa B dalam membentuk AB adalah sama dengan perbandingan massa A dan massa B ketika membentuk AC dan BC atau kelipatan dari perbandingan ini.ŌĆØ
- 9. Contoh : 75 75g 25g oksigen 57,14g 99,99g hidrogen ’Ć½ oksigen ’é« air 11,11g 88,89g 1 : 8 Perbandingan hidrogen dan oksigen yang masing- masing bereaksi dengan 75 g C adalah 25:99,99 atau 1:4 | ŌÄĀ x57,14 ŌÄ× | ŌÄØ 42,86 ( ’é« karbon monoksida 75g karbon ’Ć½ 42,86g karbon ’Ć½ hidrogen ’é« metana
- 10. Hukum Perbandingan Setara Dari hukum 3 & 4 lahir hukum perbandingan setara dan pengertian massa ekivalen ŌĆ£Bila suatu unsur bergabung dengan unsur lain, maka perbandingan kedua unsur tersebut adalah sebagai perbandingan massa ekivalennya atau kelipatan sederhana darinya.ŌĆØ
- 11. Hukum Perbandingan Setara Massa ekivalen suatu unsur adalah massa unsur tersebut yang bereaksi dengan 8 gr oksigen atau setara ini, misalnya 1,008 gr hidrogen atau 35,5 gr klor.
- 12. 2 2 2 2 2 2 H O H ’Ć½ 1 O ’é« ’é» ’é» biloks 0 0 ’é» ’é» ’Ć½ 2 - 2 1 mol H2 ’é╗ 1 mol elektron 1 mol H ’é╗ 1 ekivalen | ’ü£ massa 1 ekiv H ’ĆĮ 1gr } | 2 1 mol H2 ’ĆĮ 2gram J 2 2 1 2 1 mol O ’é╗ 2 ekivalen | ’ü£ massa 1 ekiv O ’ĆĮ 8gr } mol O2 ’ĆĮ 16gr | |J
- 13. Hukum Penyatuan Volume ŌĆ£Pada kondisi suhu dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan gas-gas produk reaksi merupakan bilangan yang mudah dan bulat.ŌĆØ Contoh : hidrogen ’Ć½ nitrogen ’é« amonia 3 vol 1 vol 2 vol Hidrogen ’Ć½ Oksigen ’é« uap air 2 vol 1 vol 2 vol
- 14. Hukum Avogadro 2 vol 2 molekul 2 vol 1 vol 2 molekul 1 molekul ŌĆ£Pada suhu dan tekanan yang sama, volume yang sama dari semua gas mengandung sejumlah molekul yang sama.ŌĆØ Contoh : hidrogen ’Ć½ oksigen ’é« air
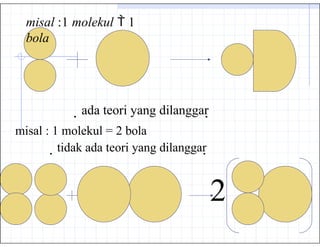
- 15. misal :1 molekul ’ĆĮ 1 bola ’Ć©ada teori yang dilanggar’Ć® misal : 1 molekul = 2 bola ’Ć©tidak ada teori yang dilanggar’Ć® 2
- 16. Teori Atom Dalton 1. Materi terdiri dari partikel yang tak dapat dibagi- bagi lagi. 2. Atom suatu unsur tertentu adalah sama dalam semua hal dan berbeda dari atom unsur lain. 3. Jika atom-atom bergabung membentuk senyawa, perbandingan atom-atom ini merupakan angka yang sederhana. Menurut hipotesis Avogadro : massa molekul relatif ’ĆĮ
- 17. Massa Atom Relatif (Ar) 12 1 massa satu atom C ’ĆŁ12 ŌĆ£Sejak 1961 ditetapkan isotop C-12 sebagai dasar penentuan Ar.ŌĆØ Ar ’ĆĮ massa satu atom unsur Untuk semua unsur, ditemukan hubungan: Ar ’ĆĮ massa ekivalen x valensi
- 18. Penentuan Massa Atom Relatif untu k 1. Hukum Dulong-petit (1819) unsur logam Ar kira ’ĆŁ kira x kalor jenis ’é╗ 26,8 J gram.K atau Ar kira ’ĆŁ kira x kalor jenis ’é╗ 6,4 kal gram.K Contoh : Suatu logam mempunyai kalor jenis 0,24 j/gr K dan massa ekivalen 38,3. Hitung Ar yang tepat!
- 19. untu k 2. Metode Cannizzaro (1858) non logam ŌĆ£Massa terkecil dari unsur X yang terdapat dalam satu mol senyawa itu adalah massa atom relatif X (cari FPB) 0, 24 Jawab : 27 Ar kira-kira ’é╗ ’é╗ 112 valensi ’ĆĮ 112 ’é╗ 3 (bilangan bulat) 38, 3 ’ü£Ar yang tepat = 3 x 38,3=114,9
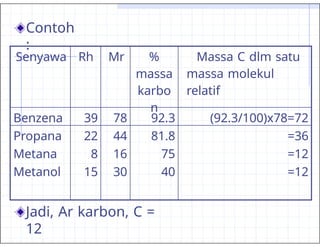
- 20. Contoh : Jadi, Ar karbon, C = 12 Senyawa Rh Mr % massa karbo n Massa C dlm satu massa molekul relatif Benzena 39 78 92.3 (92.3/100)x78=72 Propana 22 44 81.8 =36 Metana 8 16 75 =12 Metanol 15 30 40 =12
- 21. 3. Spektroskopi Massa Perlu dua data : Kelimpahan isotop Massa isotop relatif Contoh : 69Ga dan 31 31 71Ga dengan kelimpahan berturut-turut 60% dan 40%. Ar Ga yang tepat ’ĆĮ ( 60 x69 ŌÄ× ’Ć½ ( 40 x71ŌÄ× ’ĆĮ 69.8 | 100 | 100 | | ŌÄØ ŌÄĀ ŌÄØ ŌÄĀ
- 22. Mo l massa ’Ć© g ’Ć® massa molar ’Ć©g mol ’Ć® Contoh : Mr NaOH = 40 maka massa molar NaOH = 40 g/mol Yang artinya, 1 mol NaOH = mol ’ĆĮ
- 23. 1. Penerapan konsep mol pada gas a) Persamaan gas ideal : PV = nRT b) Pada keadaan STP (T=0┬░C;P=1 atm), volume satu mol gas = 22.4 L Contoh : Suatu gas sebanyak 11.09 g menempati wadah 5.6 L pada STP. Hitung massa molar! Jawab : 0.25 5.6L massa molar(g / mol) 5.6L ’é╗ 22.4L x1mol ’ĆĮ 0.25mol 0.25mol ’ĆĮ 11.09g ’ü£ massa molar ’ĆĮ 11.09 ’ĆĮ 44g / mol
- 24. 2. Penerapan konsep mol pada larutan molar ’ĆĮ mol ’ĆĮ mmol liter mL Contoh : hitung kemolaran larutan yang mengandung 24.5 g H2SO4 dalam 2 L larutan! Jawab: M 98g / mol 2L mol ’ĆĮ 24.5g ’ĆĮ 0.25mol C ’ĆĮ 0.25mol ’ĆĮ 0.125M
- 25. Persen komposisi Mr Contoh : Hitung % Na dalam Na2SO4 (Ar Na = 23; S = 32; O = 16) Jawab : % unsur ’ĆĮ jumlah atom x Ar x 100% 142 %Na ’ĆĮ 2x23 x100% ’ĆĮ 32.4%
- 26. Rumus senyawa 1. Rumus empiris : perlu data Ō×ó Macam unsur dalam senyawa Ō×ó % komposisi unsur Ō×ó Massa atom relatif unsur yang bersangkutan 2. Rumus molekul : perlu data Ō×ó RE Ō×ó Massa molekul dan hasil eksperimen
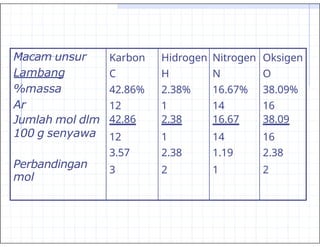
- 27. Contoh : tentukan rumus molekul suatu senyawa dengan persen komposisi, H=2.38%; C=42.86%; N=16.67%; O=38.09%. Massa molekul relatif 168┬▒0.5
- 28. Macam unsur Karbon Hidrogen Nitrogen Oksigen Lambang C H N O %massa 42.86% 2.38% 16.67% 38.09% Ar 12 1 14 16 Jumlah mol dlm 42.86 2.38 16.67 38.09 100 g senyawa 12 1 14 16 Perbandingan mol 3.57 3 2.38 2 1.19 1 2.38 2
- 29. Rumus empiris: C3H2NO2 (3x12+2x1+1x14+2x16)n = 168┬▒0.5 n Ōēł 2 Jadi, RM : C6H4N2O4
- 30. Reaksi Kimia 1. Reaksi sintesis 2. Reaksi penetralan 3. Reaksi redoks 4. ŌĆ”..
- 31. Bilangan Oksidasi (biloks) Dalam senyawa, biloks flour sama dengan -1 : HF; F = -1 Senyawa netral, biloks sama dengan nol ; H2SO4 = 0 Senyawa bermuatan, biloks sama dengan 4 muatan ion ; SO 2- = - 2 Unsur bebas, biloks sama dengan nol; H2 = 0
- 32. Bilangan Oksidasi (biloks) Unsur gol IA dan IIA dalam senyawa diberi biloks sesuai dengan golongannya; KMnO4; K=+1 Tiap hidrogen dalam senyawa, biloks sama degan +1; H2SO4; H = 2x1 = +2 Tiap oksigen dalam senyawa, biloks sama dengan -2. H2SO4 ; O = 4x(-2) = -8
- 33. Penyetaraan reaksi redoks 1. Cara setengah reaksi 2. Cara perubahan biloks
- 34. Cara perubahan biloks 1. Tulis pereaksi dan hasil reaksi Cr2O7 2- + H2SO3 Cr3+ + HSO4 - 2. Tandai unsur-unsur yang mengalami perubahan biloks Cr2O7 2- + H2SO3 Cr3+ + HSO4 - +6 +4 +3 +6
- 35. 3. Setarakan jumlah unsur yang mengalami perubahan biloks di ruas kiri dan kanan persamaan reaksi Cr2O7 2- + H2SO3 2Cr3+ + HSO4 - +12 +4 +6 +6
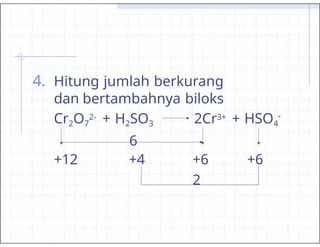
- 36. 4. Hitung jumlah berkurang dan bertambahnya biloks - Cr2O7 2- + H2SO3 2Cr3+ + HSO4 6 +12 +4 +6 +6 2
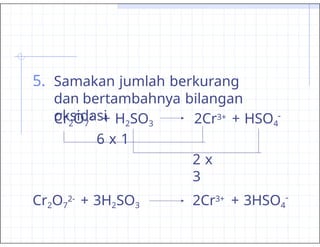
- 37. 5. Samakan jumlah berkurang dan bertambahnya bilangan oksidasi Cr2O7 2- + H2SO3 2Cr3+ + HSO4 - 6 x 1 2 x 3 Cr2O7 2- + 3H2SO3 2Cr3+ + 3HSO4 -
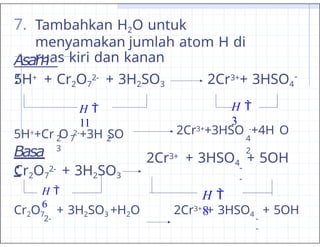
- 38. 6. Samakan jumlah muatan di ruas kiri dan kanan dengan menambahkan H+ bila larutan bersifat asam, OH- bila basa Cr2O7 2- + 3H2SO3 2Cr3+ + 3HSO4 - -2 + 0 = -2 +6 ŌĆō 3 = +3 2Cr3+ + 3HSO4 - Asam : 5H+ + Cr2O7 2- + 3H2SO3 Basa : Cr2O7 2- + 3H2SO3 2Cr3+ + 3HSO4 + 5OH - -
- 39. 7. Tambahkan H2O untuk menyamakan jumlah atom H di ruas kiri dan kanan Asam : 5H+ + Cr2O7 2- + 3H2SO3 2Cr3++ 3HSO4 - 5H++Cr O 2-+3H SO 2 7 2 3 2Cr3++3HSO -+4H O 4 2 Basa : Cr2O7 2- + 3H2SO3 2Cr3+ + 3HSO4 + 5OH - - Cr2O7 + 3H2SO3 +H2O 2- 2Cr3+ + 3HSO4 + 5OH - - H ’ĆĮ 11 H ’ĆĮ 3 H ’ĆĮ 6 H ’ĆĮ 8
- 40. Ekivalen Ekivalen asam-basa Ō¢Ā Satu ekivalen asam adalah sejumlah asam yang dapat menghasilkan satu mol H+ Ō¢Ā Satu ekivalen basa adalah sejumlah basa yang dapat meghasilkan satu mol OH- atau dapat menetralkan satu mol H+ Ō¢Ā Contoh :
- 41. + Cl- H+ 1 mol = 1 ekiv = 1 ekiv HCl 1 mol 1 mol H+ 1 mol HCl 1 mol HCl = 36.5 gram Jadi, massa 1 ekiv HCl = 36.5 gram + 4 SO 2- H2SO4 1 mol 2 mol H+ 1 mol H2SO4 1 mol H2SO4 2H+ 2 mol = 2 ekiv = 2 ekiv = 98 gram Jadi, massa 1 ekiv H2SO4 = 49 gram
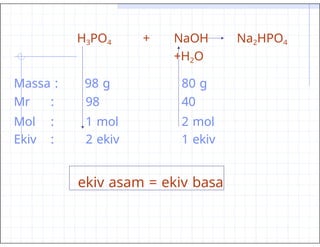
- 42. H3PO4 + NaOH Na2HPO4 +H2O Massa : 98 g 80 g Mr : Mol : Ekiv : 98 1 mol 2 ekiv 40 2 mol 1 ekiv ekiv asam = ekiv basa
- 43. Ekivalen redoks Satu ekivalen oksidator adalah sejumlah zat tertentu yang dapat menerima satu mol elektron Contoh : Fe3+ + e Fe2+ 1 mol Fe3+ ’é╗ 1 ekiv Satu ekivalen reduktor adalah sejumlah zat tertentu yang dapat melepaskan satu mol elektron Contoh : Cu Cu2+ + 2e 1 mol Cu ’é╗ 2 mol elektron 1 mol Cu ’é╗ 2 ekiv
- 44. Dalam reaksi redoks 1. Jumlah elektron yang diterima = jumlah elektron yang dilepaskan - 8H+ + MnO4 + 5e 5Fe2+ Mn2+ + 4H2O 5Fe3+ + 5e 2. Jumlah ekivalen oksidator = jumlah ekivalen reduktor 0.1 ekiv MnO4 = 0.1 ekiv Fe - 2+
- 45. V2O5 2VO +10 6 +4 Mr V2O5 = 182 1 mol V2O5 = 182 gram massa 1 ekiv V2O5= (182/6) gram 3. massa ekiv oksidator = massa 1 mol oksidator jumlah mol elektron yang diterima
- 46. Fe FeO 0 2 +2 Ar Fe = 56 1 mol Fe = 56 gram massa 1 ekiv Fe = (56/2) gram 4. massa ekiv reduktor = massa 1 mol reduktor jumlah mol elektro yg dilepaskan
- 47. Pereaksi pembatas Pereaksi yang habis bereaksi disebut pereaksi pembatas Contoh : 2Zn + O2 2ZnO Massa : 28.6 g 7.44 Ar : 65.4 16 Mol : 0.438 0.232 Dibagi koefisie n : 0.219 mol 0.232 mol
- 48. Setelah dibagi dg koefisien masing- masing, zat dg mol terkecil merupakan pereaksi pembatas atau yg habis bereaksi. Dalam hal ini Zn. Jadi, mol ZnO massa ZnO = mol Zn = 0.438 mol = 0.438(65.4+16) = 35.6 gram
- 49. Persen Hasil Contoh : C2H4 + 3O2 2CO2+2H2O Massa : 3.86 g 11.84 g Mr : 28 32 Mol Dibagi : 0.1378 0.37 Koefisien : 0.1378 mol 0.123 mol % hasil = massa produk nyata x 100% massa produk menurut perhitungan
- 50. Jadi, pereaksi pembatas, O2, sehingga menurut perhitungan : g massa CO2 = ( 2 x ŌÄ× | 3 0.37 |mol x 44 mol ’ĆĮ 10.85 gram ŌÄØ ŌÄĀ massa hasil eksperimen CO2 = 6.96 gr 10.85 shg, 6.96 % hasil = x100% ’ĆĮ 64%